【テクニカルレポート】遺伝子組換えタンパク質を用いたエンドトキシン測定試薬
本記事は、和光純薬時報 Vol.90 No.2(2022年4月号)において、富士フイルム株式会社 バイオサイエンス&エンジニアリング研究所福地 大樹 和様に執筆いただいたものです。
はじめに
エンドトキシンはグラム陰性細菌の細胞壁外膜に存在するリポ多糖(Lipopolysaccharide)であり、血中に入ると極微量で発熱性を示し、大量ではエンドトキシンショックから死に至るような強い毒性を示すことがある1)。グラム陰性細菌は環境中に広く存在しているため製造工程に混入するリスクがあり、また混入したエンドトキシンは耐熱性のため容易に失活しないことから、注射剤や医療機器はエンドトキシン汚染を厳密に管理することが求められている。近年、再生医療、ワクチン、抗体や核酸医薬に関連する製品の開発が盛んに行われているが、そのような製品においてもエンドトキシン管理は重要である。
エンドトキシンは、カブトガニの血球抽出成分の血液凝固系を利用した試薬(ライセート試薬;Limulus Amebocyte Lysate, LAL)を用いて測定されているのが現在の主流であるが、カブトガニ保護、試薬の安定供給、製品ロット間差の解消及び試験の安定性の向上を目的として、人工原料である遺伝子組換えタンパク質を用いたエンドトキシン測定試薬の開発が各LALメーカーで進められるようになってきた。
エンドトキシン試験法の測定原理
エンドトキシン試験法はカブトガニの血球成分より調製されたライセート試薬を用いてエンドトキシンを検出または定量する方法である。カブトガニの血球抽出成分にはエンドトキシンに対して凝固を引き起こす反応系が存在し、この凝固反応は複数のセリンプロテアーゼ前駆体が順次活性化するカスケード反応に基づいている(図1)。
エンドトキシンがカブトガニ血球抽出成分に含まれるC因子を活性化し、続いて活性型C因子がB因子を活性化する。次に活性型B因子が凝固酵素前駆体を活性化し、活性化した凝固酵素が基質であるコアギュローゲンを加水分解することにより凝固性タンパク質であるコアギュリンに変換し、生じた不溶性ゲルにより凝固が起こる。
また、カブトガニの血球抽出成分にはβ-グルカンに反応するG因子から始まるカスケード反応も存在しておりβ-グルカンによっても凝固反応が起こるが(図1)、エンドトキシンのみを対象とする場合にはG因子の除去、またはG因子から始まるカスケード反応を抑制して測定する。
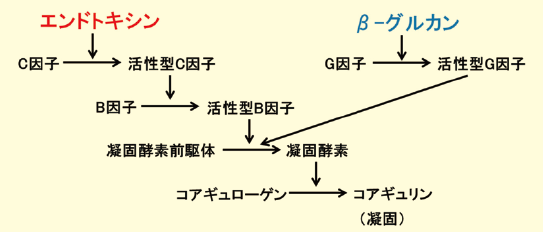
図1.エンドトキシン、β- グルカンによる凝固反応カスケード
エンドトキシンの測定方法
エンドトキシン測定には大きく分けて、ライセート試薬のゲル形成を指標とするゲル化法、ゲル化に伴う濁度変化を吸光度または透過率を用いて測定する比濁法、及び合成基質の加水分解による発色を指標にする比色法の3種類がある。比色法はゲル化法、比濁法に比べ感度が高い。遺伝子組換えタンパク質を用いたエンドトキシン測定試薬には、発色合成基質を用いた比色法以外に蛍光合成基質を用いた測定法も存在する。
遺伝子組換えタンパク質を用いたエンドトキシン測定試薬
現在、各社より上市されている遺伝子組換えタンパク質を用いたエンドトキシン測定試薬は、C因子の遺伝子組換えタンパク質を使用した1因子系試薬と、C因子、B因子、凝固酵素前駆体の遺伝子組換えタンパク質を使用した3因子系試薬の2種類に分類される(図2)。
前者の1因子系試薬は3因子系試薬に比べ1テストあたりのコストは安く抑えられるが、カスケード反応による増幅がないため生成するプロテアーゼ活性が小さく蛍光基質を使用した蛍光検出を行う必要がある。3因子系試薬は1因子系に比べ生成する酵素活性が大きく、発色で検出可能なため一般的なプレートリーダーで測定可能である。
また近年、エンドトキシンに対する特異性に関してB因子が重要な役割を果たしているという報告があり2, 3)、C因子のみの1因子系ではなく、C因子、B因子、凝固酵素前駆体を含む3因子系でエンドトキシンを測定する意義は大きい。富士フイルム和光純薬では3因子系での開発を進め、他社商品と同等以上の性能を有する遺伝子組換えタンパク質を使用したエンドトキシン測定試薬(パイロスター™ネオ)を発売した。
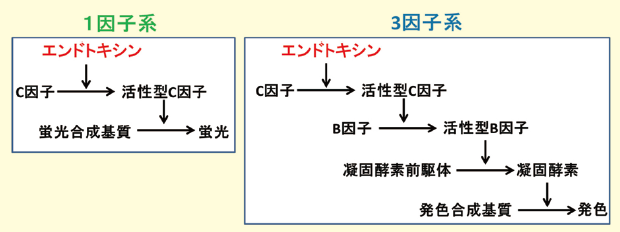
図2.遺伝子組換えタンパク質を使用したエンドトキシン検出試薬の種類
パイロスター™ ネオ
今回富士フイルム和光純薬が発売したパイロスター™ ネオは遺伝子組換えタンパク質を使用した他社商品と比較して以下のような特長を有している。ブランク値上昇を極力抑え、安定的な制御が可能となったため、他社3因子系よりも低濃度のエンドトキシン濃度から測定可能となった(表1)。またライセート試薬の一般的な解析方法の一つである比色時間分析法で測定するため、カイネティック測定のできる恒温プレートリーダー、及び一般的なソフトウェアを用い、測定・解析可能である。パイロスター™ ネオは0.001EU/mL ~ 50EU/mLまでの幅広いエンドトキシン濃度を定量でき、高い相関の検量線(相関係数0.980以上)が得られる試薬である。
表1. パイロスター™ ネオと他社商品との比較
| パイロスター™ ネオ | 他社商品1 | 他社商品2 | 他社商品3 | |
|---|---|---|---|---|
| 因子 | 3 因子系 | 1 因子系 | ||
| 定量範囲(EU/mL) | 0.001 〜50(比色時間分析法) | 0.005 〜50(比色時間分析法) 0.002 〜0.1(反応速度法) |
0.005 〜5 | 0.005 〜50 |
| 検出方法 | 発色 | 発色 | 蛍光 | 蛍光 |
おわりに
現在使用されているエンドトキシン測定試薬は生物原料を使用したライセート試薬が主流であり、人工原料である遺伝子組換えタンパク質を使用したエンドトキシン測定試薬はまだ歴史が浅く普及していないのが現状である。
こうした中、2021年に欧州薬局方では蛍光法を用いた遺伝子組換えC因子試薬が一般試験法として収載された。最新版である第十八改正日本薬局方では参考情報として、「エンドトキシン試験法と測定試薬に遺伝子組換えタンパク質を用いる代替法」が記載されたが、エンドトキシン試験法で規定されている「カブトガニの血球抽出成分より調製されたライセート試薬」には該当しないとされている。米国薬局方でも遺伝子組換えエンドトキシン測定試薬は代替法としての位置づけである。代替法として使用する際は、ライセート試薬を用いたエンドトキシン試験法と比較して同等以上の真度、精度、感度、特異性などが得られることを確認する必要があり、そのような比較検討の取組みが報告されている4)。
今後、遺伝子組換えタンパク質を用いたエンドトキシン測定試薬の使用検討が進むと思われるが、代替法として検討している製薬企業などのユーザーに受け入れられるにはこうした要求事項に応える必要がある。ユーザーニーズと、環境及びカブトガニ保護を両立できるよう取り組んでいきたい。
参考文献
- 棚元憲一:エンドトキシンと医薬品の品質管理,国立医薬品食品衛生研究所報告,126,19(2008).
- Kobayashi, Y. et al. : J. Biol. Chem., 290, 19379 (2015).
- Tsuchiya, M. : Int. J. Dev. Res., 10, 36751 (2020).
- 菊池裕 他:医薬品医療機器レギュラトリーサイエンス,48,252(2017).
関連記事