エクソソーム
エクソソームとは、細胞から放出される直径30-100 nm の膜小胞で、細胞外小胞 (EV: Extracellular vesicles)の一種です。核酸 (mRNA、microRNA)やタンパク質を内包しており、細胞間情報伝達におけるコミュニケーションツールとしての役割やがんを始めとする様々な疾患におけるバイオマーカーとしての利用に関心が高まっています。しかしエクソソームの実験技術は未だ発展途上であり、課題も多く存在します。
当社では金沢大学医学系免疫学 華山教授と共同で、エクソソームの表面に存在するホスファチジルセリン(PS)とカルシウムイオン依存的に結合するタンパク質Tim4を利用したPSアフィニティー法を確立し、本手法を用いたエクソソーム単離キットを開発しました。本キットにより、従来法と比較して高純度かつダメージの少ないエクソソームの単離が可能となりました。
当社はエクソソーム関連製品・サービスをワンストップで提供できます!
| 工程 |

試料調達/産生
|
単離/精製
|

検出/定量
|

解析
|
|---|---|---|---|---|
| 概要 | 生体液を入手する、あるいは培養細胞にエクソソームを産生させる。培地の選択で産生量は変わる。 | 培養上清や体液検体などからエクソソームを単離・精製する。手法により純度や回収量が異なる。 | エクソソームの表面マーカー抗原などを利用してエクソソームを検出・定量する。 | エクソソームに存在する核酸(miRNAやmRNA)やタンパク質、脂質などを解析する。 |
| 製品 |
培地 血清 培養器材 精製エクソソーム |
単離/精製キット (★) 吸着防止/凍結保護試薬 |
ELISAキット (★) フローサイトメトリーキット (★) 抗体 染色試薬 |
RNA解析試薬 タンパク質解析試薬 |
| サービス | 生体試料調達 |
単離/精製 単離/精製 (多検体) 大量精製 |
ELISA解析 ナノサイト解析 電子顕微鏡解析 |
マイクロアレイ解析 NGS解析 プロテオーム解析 リピドミクス解析 メタボローム解析 |
★: PSアフィニティー法を原理とした製品が含まれています。
学術コンテンツ
エクソソームとは? 金沢大学医学系免疫学 教授 華山 力成
近年、細胞外小胞(EV)の研究が加速的に進展している。2011 年には年間 200 報程度の論文数であったが、2016 年には 1000 報以上の論文が発表され、様々な生理機能や病態発症との関連が示唆されている。EV は大きく分けてエンドソーム由来のエクソソームと形質膜由来のマイクロベジクルなどに分類することができるが、現在最も精製に用いられている分画遠心法で両者を厳密に分離するのは困難であり、便宜的に 10,000 × g で沈降しない EV を small EV (主にエクソソーム)と呼んでいる1)。
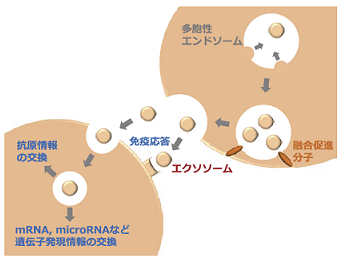
エクソソームは様々な細胞が分泌する小型(直径 30~100 nm 程度)の膜小胞で、殆どの体液(血液や尿、髄液など)や細胞培養液中に存在している。エクソソームは脂質二重膜で囲まれた膜小胞で、多胞性エンドソームと呼ばれる細胞内小胞の中で産生され、多胞性エンドソームが細胞膜と融合することにより細胞外へと放出される(図 1)。
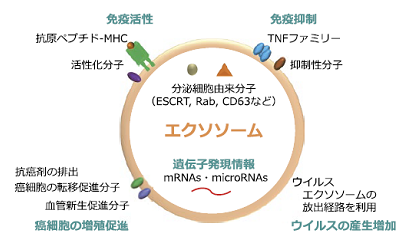
エクソソームには、エンドソーム由来の蛋白質(ESCRT など)や細胞内輸送に関与する蛋白質(CD63, CD81 など)をはじめ様々な分泌細胞由来の蛋白質や RNA が含まれているとともに、分泌細胞の細胞膜やエンドソーム膜由来の脂質(コレステロールやスフィンゴミエリンなど)が含まれている2)(図 2)。
長年エクソソームは、不要な細胞内容物の放出に関与すると考えられていた。しかし近年では、生体内で脂質・蛋白質・RNA などを運ぶ新たな細胞間情報伝達媒体として注目されており、その生理的または病態生理的機能の解明とともに、これらの機能を用いた臨床応用研究、特に診断や治療、バイオマーカーの開発が急速に展開されている。
現在、エクソソームの研究は、ほぼ全ての研究領域(免疫、神経、癌、内分泌、循環器など)に跨り進められている。例えば、免疫細胞(特に樹状細胞)由来のエクソソームには抗原ペプチド/MHC 複合体や様々な抗原が含まれていることが示されており(図 2)、免疫細胞間での抗原情報の交換や、免疫細胞の活性化など様々な免疫応答を制御する可能性が示されている3)(図 1)。
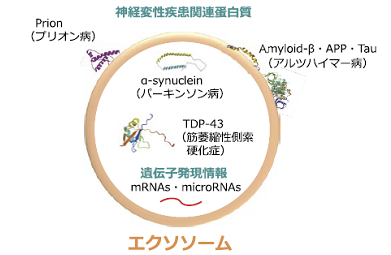
神経系では、神経回路の制御に関連するとともに4)、様々な神経変性疾患の原因蛋白質がエクソソームによって細胞外へ放出され他細胞へと伝播される事が明らかとなり、病態の進展に深く関与する可能性が示されている5)(図 3)。
癌細胞が放出するエクソソームには、血管新生や免疫抑制に関連する分子が多数含まれており、癌細胞の成長に適した微小環境を構築し、癌の進展を促進するのに寄与していると考えられている6)(図 2)。また、癌細胞由来エクソソーム上の接着分子の発現様式により、どの臓器へと癌が転移するかが決められていることが明らかになっている7)。
最近、脂肪細胞が放出するエクソソームは、肝臓での遺伝子発現を制御することが報告されている8)。また、多くのウイルスがエクソソームの産生経路を利用して産生される一方で、細胞に感染した細菌や寄生虫が、エクソソームを介して他細胞に感染している細菌・寄生虫の活動を制御する可能性が示されている9, 10)。
これらの機能の殆どが、エクソソームに存在する分泌細胞由来の分子によって引き起こされる。中でも、エクソソーム内に分泌細胞由来の mRNA や miRNA が存在することが判明してからは、エクソソームが細胞間における遺伝子発現情報の水平伝播に関与する可能性が非常に注目されている11)。
これらの RNA はエクソソームの脂質二重膜に守られている為、RNase により分解されず、血中や体液中で安定なまま存在している。標的細胞に取り込まれたエクソソームは、エンドソーム膜と融合することにより、中に抱え込んでいた RNA を標的細胞の細胞質へと放出する(図 1)。
放出された mRNA は蛋白質に翻訳される一方、miRNA は標的遺伝子の翻訳を抑制することで、エクソソームは標的細胞内での遺伝子発現を制御する。1 つのエクソソームに含まれる蛋白質は数万種類、mRNA、miRNA は数千種類以上あると想定されているが、その構成は由来細胞ごとで異なるとともに、その細胞の状態によっても変化する。また、エクソソームにおけるこれらの構成は、分泌細胞内での構成と異なっており、エクソソームに特異的な蛋白質や mRNA/miRNA が選択的にエクソソームへと積載される機構が存在すると考えられる。
このような特異性から、エクソソーム内の RNA はバイオマーカーとして、更に治療開発の標的として注目されている。一方、エクソソーム中の mRNA は標的細胞に取り込まれるとその細胞内で機能性蛋白質の発現を引き起こしうるが、エクソソーム中の miRNA の多くが、機能性 miRNA ではなく前駆体であるため、それが、どのような生理的意義をもつかが研究されている。
このように、エクソソームには多種多様な蛋白質や RNA、脂質が含まれているため、細胞ごとに分類し、データベース化(ExoCarta)することが進められている。更に、プロテオミクスやトランスクリプトミクス、システムバイオロジーを駆使した大規模解析が世界各地で個別に行われているが、解析法の共通化を目指した解析ツールとして FunRich の EV plugin が公開されている。
今後、エクソソーム研究を推進するにあたっては、様々な分野の研究者が情報を共有することが必須である。
エクソソームを用いた治療法や診断法の開発
エクソソームの機能が明らかになるにつれ、近年ではその機能を応用した治療法の開発が行われている。例えば、血中の線維細胞(間葉系前駆細胞の一種)から放出されたエクソソームは、角化細胞の遊走と増殖、血管新生を促進することで創傷治癒を促進する。
この過程でエクソソーム内の血管新生促進性 miRNA や抗炎症性 miRNA、コラーゲン沈着促進性 miRNA などが関与すると報告されている12)。また、癌患者の樹状細胞から放出されたエクソソームには、様々な癌細胞由来の蛋白質が含まれており、癌細胞特異的な細胞傷害性 T 細胞の強い活性化を引き起こす。この機構を用いた抗腫瘍免疫療法の開発が初期臨床研究の段階にある13)。
一方、病態発症に関与するエクソソームの機能を抑制する試みもなされている。例えば、関節リウマチ患者の滑膜線維芽細胞から放出されるエクソソームには、細胞死を誘導する TNF-αが高濃度に集積しており、関節リウマチの病態を憎悪させている14)。
また上述の通り、癌細胞由来エクソソームには癌進展関連分子、神経細胞由来エクソソームには神経変性疾患関連分子が含まれている為、これらのエクソソームを阻害または除去することにより、病態の発症を抑制できる可能性がある。今後の研究の発展により、エクソソームを用いることが期待される。
さらに、エクソソームを用いて、siRNA や抗癌剤などの薬剤を目的の細胞に運ぶ試みがなされている。エクソソーム膜表面には様々な細胞接着分子が発現しており、その様式によってエクソソームがどの細胞へと運ばれるかが明らかになりつつある為、この特性を応用した新規 DDS の開発が期待されている 15)。
エクソソームは体液中で非常に安定であるとともに、小胞内に含まれる蛋白質や RNA はエクソソームの脂質二重膜に守られており分解されない。また、採取後長期間保存された体液中においてもエクソソームは比較的安定である為、エクソソームは臨床検査における新たな疾患バイオマーカーとして有望視されている。
様々な疾患との相関が調べられているが、特に血中に放出された癌細胞由来エクソソームは、健常細胞由来エクソソームと構成分子の違いが注目されており、癌の早期診断のツールとして癌進展との相関関係が調べられている16)。更に、尿中のエクソソームは腎臓や前立腺、膀胱疾患の新たな診断マーカーとして、髄液中のエクソソームは脳内の腫瘍や神経変性疾患の新たなマーカーとして期待されている。
エクソソーム研究の課題と今後
エクソソームの役割について既に数多くの研究が報告されているが、これらの現象の根拠となる実験では、体液や培養細胞上清などから精製し、高度に濃縮されたエクソソームが用いられているため、生体内の本来の性状を反映していない可能性がある。従って、このような現象が生体内で本当に起きているのかは未だに確かではない。
エクソソームの生理作用を明らかにする唯一の方法は、エクソソームの放出機構を明らかにし、それを亢進または阻害することによって、どのような生理現象が引き起こされるのかを解明することであり、更なる研究の発展が期待される。更には、生体内におけるエクソソームの動態(どのエクソソームがどこへ行くのか)も今後の研究開発において取組むべき重要な課題である。
また、これまでエクソソームを精製する方法として、超遠心法や PEG 沈殿法を利用した各種市販キットが主に用いられてきたが、これらの方法では非常に多くの夾雑物が混入しており、実験結果が本当にエクソソームの構成分子による作用であるのかは慎重な解析を要する。
更に、超遠心法は操作が煩雑である為、回収量が不安定で定量的な解析が行えない上に、高額な超遠心機を必要とし多検体の解析が行えないなどの問題点が存在する。このような状況では、エクソソームの研究を進めるのは困難であり、エクソソームを簡易に高純度で精製する技術の開発が早急に求められている。そこで我々は、マクロファージに発現するエクソソームの受容体 Tim4 に着目し、Tim4 の細胞外領域と磁気ビーズとを結合させた「Tim4 磁気ビーズ」を作製した17)。
Tim4 はエクソソーム膜表面のリン脂質ホスファチジルセリンとカルシウムイオン依存的に結合することから、キレート剤である EDTA を含む溶出バッファーを用いることで遊離させ、高純度なエクソソームをインタクトな状態で精製することが可能である。
実際、Tim4 アフィニティー法を用いて、ヒト白血病細胞から放出されたエクソソームを精製し、その純度を超遠心法や PEG 沈殿法により精製したエクソソームと比較したところ、Tim4 アフィニティー法では他の方法に比べ 10~100 倍以上にエクソソーム特異的な蛋白質が強く検出されるとともに、エクソソーム以外の夾雑物がほとんど混入しておらず、高純度なエクソソームを再現性よく回収できることが明らかとなった。
その結果、これまで同定することができなかったエクソソーム上の蛋白質や RNA を数多く同定することが可能となった。更に、Tim4 のエクソソームへの強い結合能を応用し、エクソソームを ELISA や FACS で高感度に検出・定量することが可能となった。また、マイクロベジクルは本来、分画遠心法で粗精製することしかできなかったが、Tim4 アフィニティー法を用いることで高純度なマイクロベジクルの精製も可能になった。
今後この技術の有用性が世界中で評価され、エクソソームやマイクロベジクル本来の生理機能の解明に大きく貢献することを期待している。
エクソソームの検出や単離の難しさ、更には種々の分類方法があるため、どのような方法により精製した細胞外小胞をエクソソームと呼ぶのかが研究者間で統一されておらず、実験データの解釈や再現性の確認を困難にしている。近年、国際細胞外小胞学会が設立され、世界的な研究者コミュニティーが形成されつつあり、国際基準の MISEV ガイドラインが提案されているので、新たに EV の研究を行おうと考えている研究者は是非一読頂きたい18, 19)。
また、このような混乱を回避する方法の 1 つとして、各論文における実験条件を記録する EV-TRACK knowledge database が設立されている20)。
一方、EV 研究が世界的に注目されるにつれ、各国で大型研究プロジェクトが開始されている。既に米国では NIH による戦略的大型プロジェクト(Extracellular RNA Communication)が開始されており、Gordon Conference や Keystone Symposia といった国際的に権威のある懐疑においても 2016 年より分科会が発足している。
欧州の医薬品研究開発官民パートナーシップ「革新的医薬品イニシアチブ(IMI)」の支援を受け進められている CANCER-ID プロジェクトでは、EV を含めた研究が既に実施されている。日本においても、2017 年の文部科学省の研究開発戦略目標の1つとして EV 研究が選定され、今後研究の加速が期待されている。
何れにせよ、今後の EV 研究の発展には、その基盤となる確固たる研究手法や技術の開発が必須であり、Tim4 アフィニティー法がその1つとなることに期待している。
参考文献
- Kowal, J. et al. : Proc. Natl. Acad. Sci. USA, 113 (8), E968-977 (2016).
- Colombo, M., Raposo, G. and Thery, C. : Annu. Rev. Cell Dev. Biol., 30, 255-289 (2014).
- Bobrie, A., Colombo, M., Raposo, G. and Thery, C. : Traffic, 12 (12), 1659-1668 (2011).
- Bahrini, I., Song, J. H., Diez, D. and Hanayama, R. : Sci. Rep., 5, 7989 (2015).
- Kramer-Albers, E. M. and Hill, A. F. : Curr. Opin. Neurobiol., 39, 101-107 (2016).
- Tkach, M. and Thery, C. : Cell , 164 (6), 1226-1232 (2016).
- Hoshino, A. et al. : Nature, 527 (7578), 329-335 (2015).
- Thomou, T. et al. : Nature, 542 (7642), 450-455 (2017).
- Izquierdo-Useros, N., Puertas, M. C., Borras, F. E., Blanco, J. and Martinez-Picado, J. : Cell. Microbiol., 13(1), 10-17 (2011).
- Regev-Rudzki, N. et al. : Cell, 153 (5), 1120-1133 (2013).
- Valadi, H. et al. : Nat. Cell Biol., 9 (6), 654-659 (2007).
- Geiger, A., Walker, A. and Nissen, E. : Biochem. Biophys. Res. Commun., 467 (2), 303-309 (2015).
- Bell, B. M., Kirk, I. D., Hiltbrunner, S., Gabrielsson, S. and Bultema, J. J. : Nanomedicine, 12 (1), 163-169 (2016).
- Zhang, H. G. et al. : J. Immunol., 176 (12), 7385-7393 (2006).
- Batrakova, E. V. and Kim, M. S. : J. Control. Release, 219, 396-405 (2015).
- Thind, A. and Wilson, C. : J. Extracell. Vesicles, 5, 31292 (2016).
- Nakai, W. et al. : Sci. Rep., 6, 33935 (2016).
- Witwer, K. W. et al. : J. Extracell. Vesicles, 2 (2013).
- Lotvall, J. et al. : J. Extracell. Vesicles , 3, 26913 (2014).
- EV-TRACK Consortium, Van Deun, J. et al. : Nat. Methods, 14 (3), 228-232 (2017).
資料集
これまでに当社が発表したポスターや講演資料を掲載しております。
総説やテクニカルレポートは当社ブログのSiyaku blogにも掲載されておりますので合わせてご覧ください。
ポスター
| タイトル | 学会 | 発表年 | 言語 | データ |
|---|---|---|---|---|
| A novel affinity-based method for the isolation of highly purified extracellular vesicles | International Society for Extracellular Vesicles 他 | 2017 | 英語 | |
| PSアフィニティー法を利用したExosomeのフローサイトメトリー解析 | 生命科学系学会合同年次大会 (ConBio2017) | 2017 | 日本語 | |
| Development of high sensitive Exosome ELISA by using PS affinity | 生命科学系学会合同年次大会 (ConBio2017) | 2017 | 英語 | |
| Characteristics of PS-affinity method for isolation and detection of EVs | International Society for Extracellular Vesicles 他 | 2018 | 英語 | |
| Characteristics of PS-affinity method for isolation and detection of Evs | 日本細胞外小胞学会学術集会 | 2018 | 英語 | |
| A novel affinity-based method for the isolation of highly purified extracellular vesicles | 日本分子生物学会年会 | 2018 | 英語 | |
| A novel affinity-based method for isolation and quantification of extracellular vesicles | International Society for Extracellular Vesicles | 2019 | 英語 | |
| A novel affinity-based method for the isolation of highly purified extracellular vesicles | 日本細胞外小胞学会学術集会 | 2019 | 英語 | |
| A novel affinity-based method for the isolation of highly purified extracellular vesicles | 日本分子生物学会年会 | 2019 | 英語 | |
| Application of PS-affinity-based methods to extracellular vesicle research | 日本分子生物学会年会 | 2019 | 英語 | |
| Powerful Tools for EV Research and Production | International Society for Extracellular Vesicles | 2022 | 英語 | |
| Powerful Tools for EV Research and Production | International Society for Extracellular Vesicles | 2023 | 英語 | |
| Development of a method for large scale purification of Extracellular Vesicles using the PS Affinity Method | International Society for Cell & Gene Therapy | 2024 | 英語 | |
| Exosome ELISAを用いたパーキンソン病患者血液検体中のEVマーカー量解析 | Liquid Biopsy研究会 | 2025 | 日本語 | |
| 細胞外小胞を利用した治療用製剤の製造におけるPS アフィニティ法の有用性評価 | 第24回日本再生医療学会総会 | 2025 | 日本語 | |
| Development of a method for large scale purification of Extracellular Vesicles using the PS Affinity Method | International Society for Extracellular Vesicles | 2025 | 英語 |
講演資料
| タイトル | 学会 | 発表年 | 言語 | データ |
|---|---|---|---|---|
| Characteristics on PS Affinity for Isolation and Detection of EVs: Advantages Clarified from Comparison with Conventional Methods | German Society for Extracellular Vesicles 他 | 2019 | 英語 | |
| 新規細胞外小胞精製技術 PSアフィニティー法 | 第19回日本再生医療学会総会 | 2020 | 日本語 | |
| PSアフィニティー法が実現した高活性なMSC由来細胞外小胞の精製 | 第7回日本細胞外小胞学会学術集会 | 2020 | 日本語 | |
| TIM4 affinity methods targeting phosphatidylserine for isolation or detection of extracellular vesicles (PS affinity methods) | International Society for Extracellular Vesicles | 2022 | 英語 |
技術資料
| タイトル | 作成年 | 言語 | データ |
|---|---|---|---|
| 総タンパク質量は、Extracellular vesiclesの量を反映しない ー テトラスパニン ELISA による EV 収量の比較 ー |
2022 | 日本語 英語 |
動画
| 動画 | タイトル | 言語 | データ |
|---|---|---|---|
| エクソソームの単離/抽出/精製キット:MagCapture™ Exosome Isolation Kit PS Ver.2 (Youtube 7:48) | 日本語 | Youtube | |
| 【プロトコル】 MassivEV™ EV Purification Column PSを用いた細胞外小胞の大量精製 (Youtube 3:26) |
日本語 | Youtube | |
| 【プロトコル】 MagCapture™ EV Isolation Kit PS for HTSを用いた多検体からの細胞外小胞精製 (Youtube 2:36) |
日本語 | Youtube | |
| 【プロトコル】[Auto-Pure Mini編] MagCapture™ EV Isolation Kit PS for HTSを用いた多検体からの細胞外小胞精製 (Youtube 2:21) |
日本語 | Youtube | |
| 【プロトコル】[Maxwell® RSC Instrument 編] MagCapture™ EV Isolation Kit PS for HTSを用いた多検体からの細胞外小胞精製 (Youtube 3:07) |
日本語 | Youtube | |
| 【プロトコル】 精製EV用マイクロRNAエキストラクター®キット (Youtube 5:02) |
日本語 | Youtube | |
| 【プロトコル】 エクソソーム内部のタンパク質検出 (Youtube 5:22) |
日本語 | Youtube | |
| TIM4 affinity methods targeting phosphatidylserine for isolation or detection of extracellular vesicles (PS affinity methods) (Youtube 21:40) |
英語 | Youtube | |
| Products for EV Detection (Youtube 4:54) |
英語 | Youtube |
製品ラインアップ
-
単離/精製
-
検出
-
吸着防止剤
-
精製エクソソーム
-
エクソソーム産生用培地
-
器材
-
解析








