エクソソーム単離/精製キット
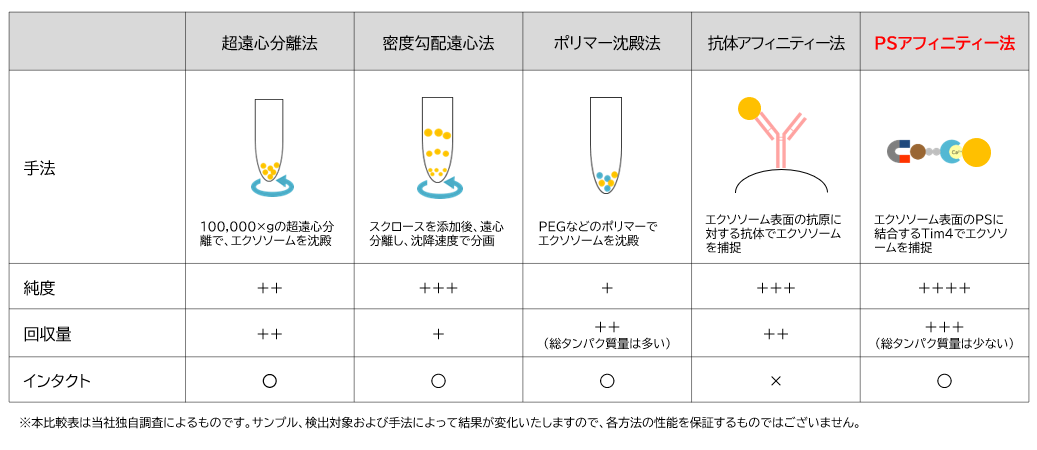
エクソソーム研究では、いかに生体に近い状態のエクソソームを高純度かつ高収量で単離・精製できるかが重要です。エクソソームの単離・精製手法として超遠心分離法(超遠心法) やポリマー沈殿法など様々な手法が存在しますが、多くの夾雑物が混入する、回収量が少ない、エクソソームへのダメージが大きいなどそれぞれの手法によって課題が存在します。当社ではエクソソームをはじめとする細胞外小胞の表面に存在するホスファチジルセリン(PS: Phosphatidylserine)へ特異的に結合するTim4タンパク質を利用した新規エクソソーム単離・精製手法「PSアフィニティー法」を金沢大学医学系免疫学の華山教授と共同で開発し、キット化しました。
学術コンテンツ
ホスファチジルセリンとTim4 を用いた新規エクソソーム精製法
エクソソーム膜は分泌細胞由来のタンパク質や脂質を含んでいますが、その中でもホスファチジルセリン(PS)は、生細胞ではフリッパーゼという酵素の働きによって細胞膜の内側に配向しているのに対して、エクソソームでは膜の外側にも露出していることが知られています1)。また、マクロファージによるアポトーシス細胞の貪食受容体として知られるT-cell immunoglobulin domain and mucin domain-containing protein 4(Tim4)タンパク質は、細胞外領域にあるIgV ドメインを介してカルシウムイオン依存的にPS と結合することがわかっています2)。
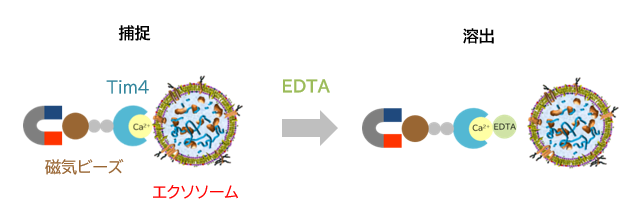
当社はTim4 を固相化した磁気ビーズを用い、カルシウムイオン存在下で細胞培養上清や血清などのサンプル中のエクソソームを捕捉し、キレート剤を添加することによってエクソソームを精製することができる、既存の手法とは一線を画す新たなエクソソーム精製法を金沢大学医学系免疫学の華山教授と共同で開発し、キット化に成功しました3)。PSアフィニティー法は、従来のエクソソーム精製法よりも高純度なエクソソームをインタクトな状態で簡便に精製することを実現しており、これまでゴールドスタンダードとされてきた超遠心法に置き換わる新たなエクソソーム精製法として確立されつつあります。
エクソソーム単離・精製手法の比較
PSアフィニティー法の性能データ
| アプリケーションデータ | 指標 | 実験手法 | 従来法との比較 | ||
|---|---|---|---|---|---|
| 超遠心分離法 | ポリマー沈殿法 | 抗体アフィニティー法 | |||
| NanoSightによる粒子解析 | 粒子 | Nanoparticle Tracking Analysis | ✔ | ✔ | - |
| ViewSizer3000による粒子解析 | 粒子 | Nanoparticle Tracking Analysis | ✔ | - | - |
| 電子顕微鏡による粒子解析 | 粒子 | 電子顕微鏡観察 | ✔ | - | - |
| Tim4と抗エクソソームマーカー抗体のキャプチャー性能の比較 | マーカータンパク質 | ELISA | - | - | ✔ |
| ウエスタンブロッティングによる生体試料(血清・血漿・尿)から精製したエクソソームの解析 | マーカータンパク質 | ウエスタンブロッティング | ✔ | ✔ | ✔ |
| ウエスタンブロッティングによる回収量および純度比較 | マーカータンパク質 | ウエスタンブロッティング | ✔ | ✔ | - |
| microRNAおよびmRNAの回収量比較 | microRNA/mRNA | リアルタイム定量PCR | ✔ | - | - |
| BCAアッセイによるエクソソームのタンパク質定量 | 総タンパク質 | BCAアッセイ | - | - | - |
| プロテオミクス解析 | プロテオミクス | LC-MS | ✔ | ✔ | - |
| エクソソームの標識と細胞への添加試験 | 細胞の取り込み | 蛍光顕微鏡観察、フローサイトメトリー | - | - | - |
▼NanoSightによる粒子解析

NanoSight(ナノサイト)は、NTA(Nanoparticle Tracking Analysis)により溶媒中のナノ粒子のブラウン運動を可視化することで、ナノ粒子の粒子径や粒子濃度の解析を可能にする解析装置である。溶媒中の粒子が様々な物質の混合物や粒子径のばらつく多分散系であるときでも、可視化技術によって得られたナノ粒子のブラウン運動観察ビデオを用いて各粒子径ごとの粒子数を測定できる。
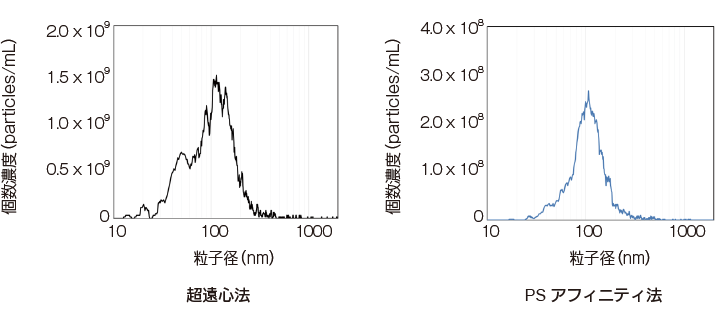
PSアフィニティー法、超遠心分離法、ポリマー沈殿法により細胞培養上清から取得したエクソソームを超純水でそれぞれ適切な濃度に希釈し、NanoSight LM10により粒子径と粒子濃度の解析を行った。
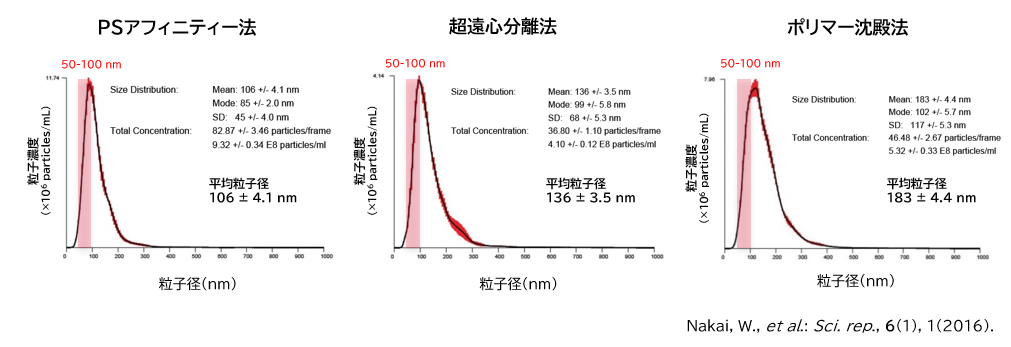
結果:PSアフィニティー法はエクソソームの粒径(50~100nm)に相当する粒子がより濃縮されており、純度が高いことが示された。
▼ViewSizer3000による粒子解析

(提供:株式会社堀場製作所)
ViewSizer3000はブラウン運動のイメージング解析を原理とする堀場製作所のナノ粒子径分布・濃度測定装置である。3波長光源とカラーCCDによるワイドレンジの粒子径測定と高いサイズ分解能(個数基準)が特長で、粒子径分布が広い試料の測定に有効である。
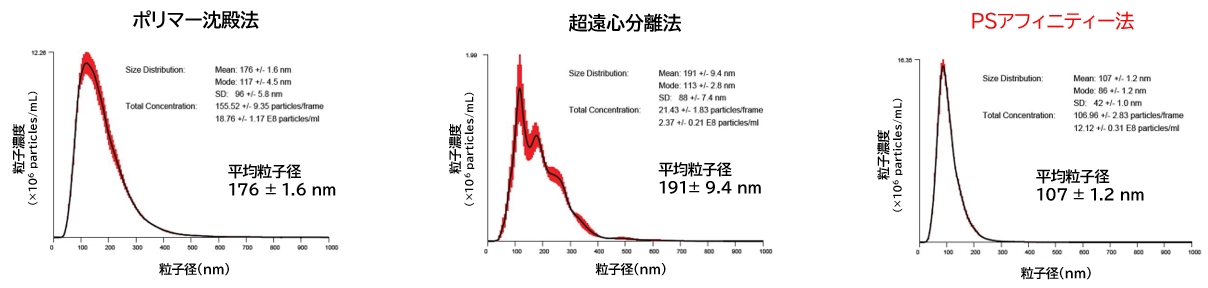
超遠心分離法とPSアフィニティー法により精製した細胞外小胞をViewSizer3000で解析した。
結果:超遠心分離法では夾雑物も含んでいることが推測されるが、PSアフィニティー法では、100 nm 付近にシャープな分布が確認でき、高純度に精製されたエクソソームの粒子径と個数濃度の情報が得られた。
▼電子顕微鏡による粒子解析
電子顕微鏡は、電子線を用いて測定対象物の拡大像を得ることができる。電子線は電磁波として見た場合、非常に波長の短い波のため、光学顕微鏡よりはるかに高い倍率での形態観察が可能で、金属・高分子材料から生体組織・植物・食品等の含水物まで、あらゆる試料の観察・解析に使用されている。今回、透過型電子顕微鏡(TEM)を用いてエクソソームの電子顕微鏡解析を行った。

PSアフィニティー法
サンプル: COLO201細胞培養上清 10 mL
粒子数: 3.69x1010 particles/mL
超遠心分離法
サンプル: COLO201細胞培養上清 10 mL
粒子数: 1.68x1010 particles/mL
結果:PSアフィニティー法は粒子数が多く、純度が高いエクソソームが単離できた。
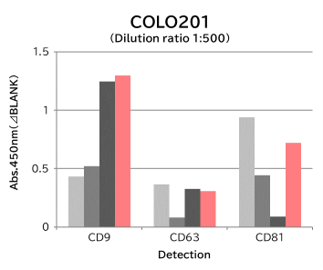
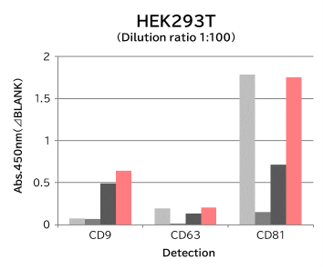
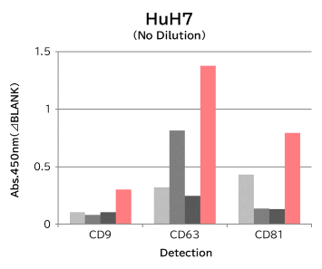
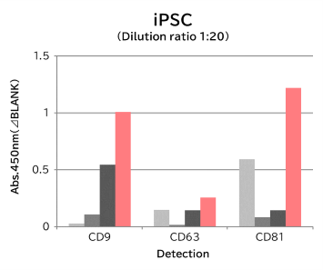
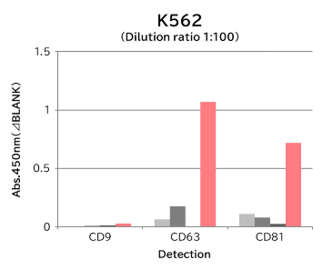
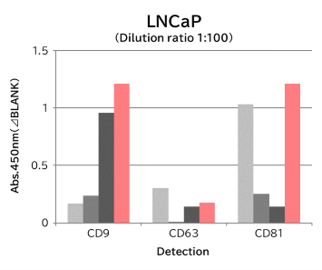
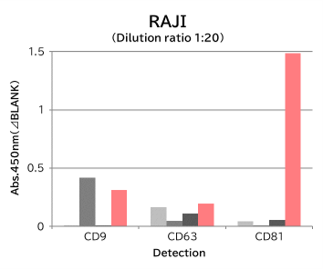
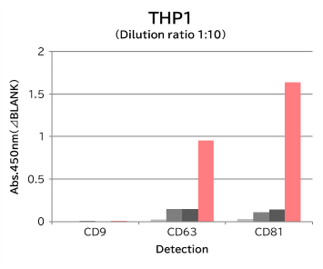
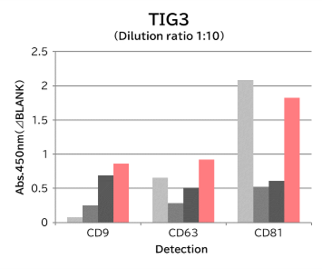
▼Tim4と抗エクソソームマーカー抗体のキャプチャー性能の比較
9種類の細胞培養上清(10,000 x g 遠心処理)を用いて、サンプル中のエクソソームを Tim4 および各エクソソームマーカー抗体(CD9, CD63, CD81)で捕捉後、ビオチン標識抗エクソソームマーカー抗体を用いて測定した。

結果: 抗エクソソームマーカー抗体と比較して、Tim4は幅広い細胞種に由来するエクソソームを効率的に捕捉できた。
▼ウエスタンブロッティングによる生体試料(血清・血漿・尿)から精製したエクソソームの解析
>ヒト血清
- ヒト血清サンプル 1mL からPSアフィニティー法、超遠心分離法、抗体アフィニティー法によりエクソソームを回収し、ウエスタンブロッティング (抗CD9抗体、抗CD63抗体) により検出を行った。
各レーンは150 μLの血清サンプルに相当する。精製したエクソソーム溶液 100 μLから15 μL抜き取り、4×SDSサンプルバッファーを5 μL添加し、全量アプライした。 
結果: PSアフィニティー法は、超遠心分離法や抗体アフィニティー法よりもエクソソームの回収量が多かった
>ヒト血漿 (EDTA)
- EDTA血漿、EDTA血漿 (限界ろ過でバッファー交換)、ヒト血清サンプル 各1 mL からPSアフィニティー法によりエクソソームを回収し、ウエスタンブロッティング (抗 Flotillin-2 抗体) により検出を行った。
各レーンは150 μLの血漿および血清サンプルに相当する。精製したエクソソーム溶液 100 μLから15 μL抜き取り、4×SDSサンプルバッファーを5 μL添加し、全量アプライした。 
結果: 限外ろ過でバッファー交換をすることでより効率よくエクソソームを回収できた。
>ヒト尿
- ヒト尿サンプル 1 mL からPSアフィニティー法、ポリマー沈殿法、超遠心分離法によりエクソソームを回収し、ウエスタンブロッティング (抗CD9 抗体) により検出を行った。
各レーンは150 μLの尿サンプルに相当する。精製したエクソソーム溶液 100 μLから15 μL抜き取り、4×SDSサンプルバッファーを5 μL添加し、全量アプライした。 
結果: 尿サンプルからも高純度のエクソソームを回収することができた。
<参考> NanoSightによる粒子解析 (ヒト尿サンプル)
▼ウエスタンブロッティングによる回収量および純度比較
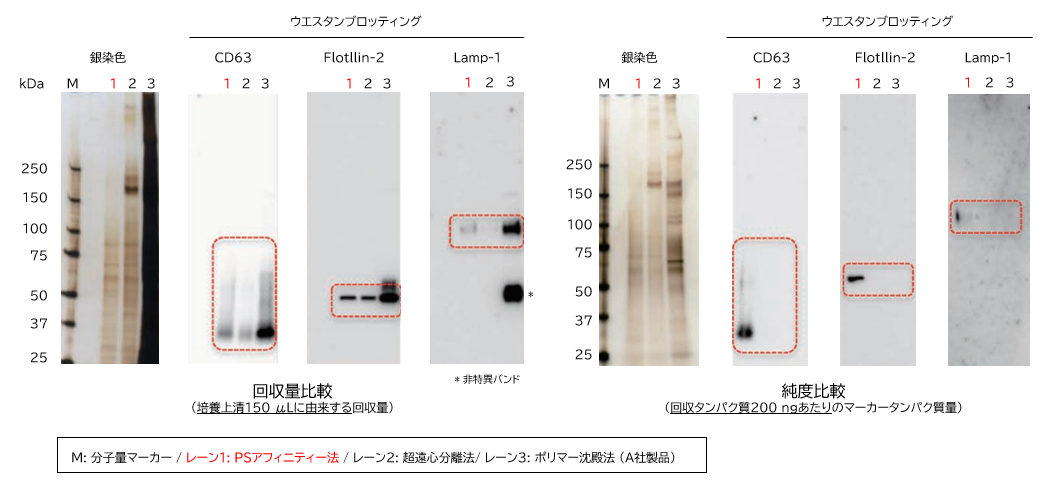
K562 細胞培養上清(10% Exosome-depleted FBS 添加培地)からPSアフィニティー法、超遠心分離法、ポリマー沈殿法で回収したサンプルを電気泳動した後、銀染色およびウェスタンブロット(抗CD63 抗体、抗Flotillin-2 抗体、抗Lamp-1 抗体)により検出を行った。また、各回収画分をMS 解析し、同定した全ペプチドのうちK562 細胞に由来するヒトペプチドの割合を比較した。
<参考> MS解析により同定したヒト由来ペプチドの比較
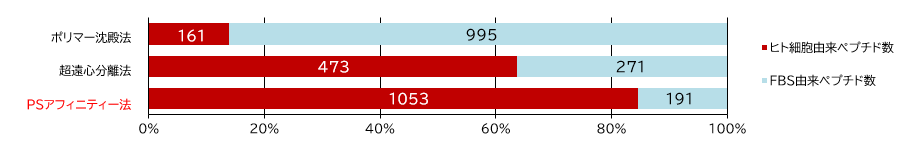
結果:PSアフィニティー法はFBS添加培地からも高純度なエクソソームを回収することができた。
▼microRNAおよびmRNAの回収量比較
超遠心分離法とPSアフィニティー法で健常ヒト血清サンプルからエクソソームを単離した後、microRNA Extractor® SP Kitを用いてRNA を回収し、定量PCR 法によりmicroRNA 量(let-7a,miR-16,miR-92a,miR-142-3p)およびmRNA 量(GAPDH, PIK3CB)を測定し、Ct 値で比較した。
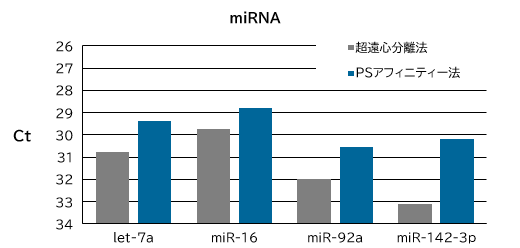
結果:超遠心分離法よりPSアフィニティー法で回収したエクソソームの方がより多くのmicroRNAおよびmRNAを回収できた。
▼BCAアッセイによるエクソソームのタンパク質定量
PSアフィニティー法を用いてCOLO201細胞培養上清から精製したエクソソームのタンパク質濃度を、Protein Assay BCA Kit (製品コード 297-73101)の高感度プロトコールにより測定した。
- PSアフィニティー法で精製したエクソソーム溶液 25 μL を96 ウェルプレート上に分注し、Protein Assay BCA Kit 付属の試薬 A と試薬 B の混合液を 200 μL 添加した。その後、60℃で 30 分間インキュベーションし、560 nm の吸光度を測定した。
細胞培養上清(5倍濃縮) 10mLから精製したエクソソームタンパク質濃度
吸光度(ーBLANK) = 0.1152
タンパク質濃度 = 49.2 μg/mL 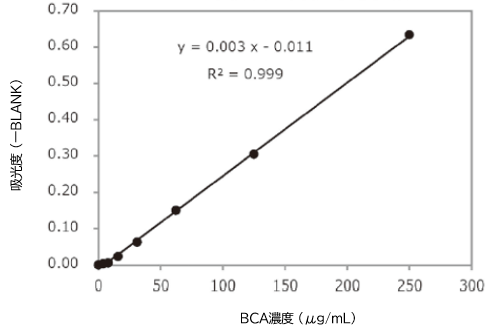
結果: Protein Assay BCA Kit の高感度プロトコールで、精製エクソソームのタンパク質濃度を測定できた。
* エクソソームのタンパク質濃度は非常に低いため、BCAアッセイの場合はサンプルを希釈せずに測定してください。
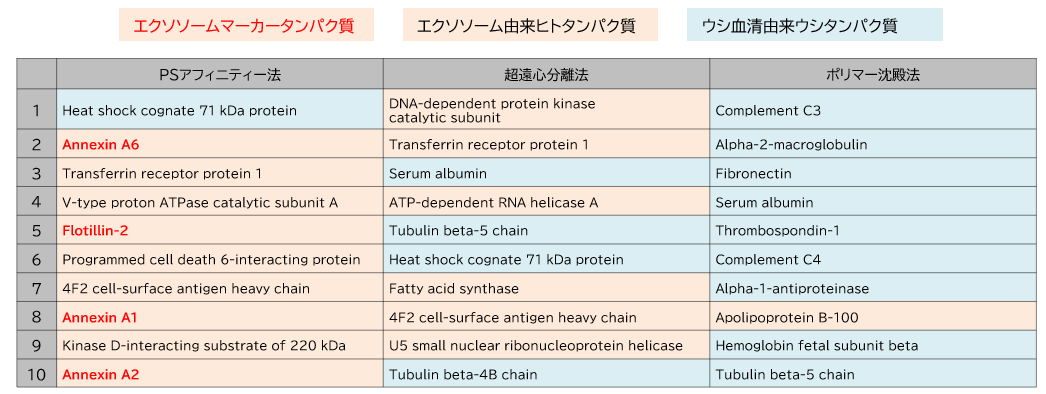
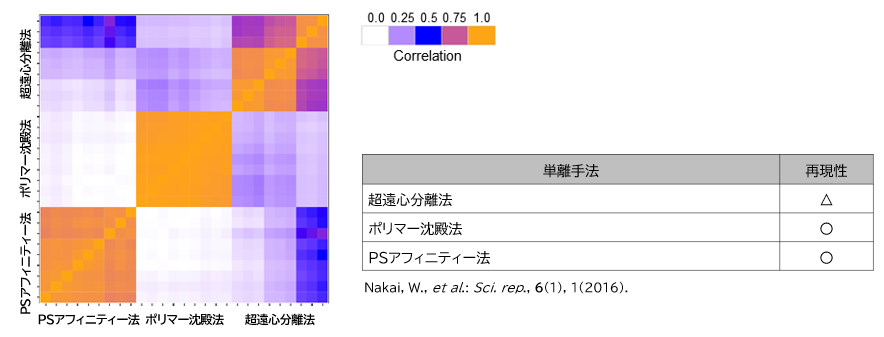
▼プロテオミクス解析
PS アフィニティー法、超遠心分離法、ポリマー沈殿法を用いて、K562 細胞培養上清(10% Exosome-depleted FBS 添加培地)からエクソソームを精製した。精製したサンプルを10% ポリアクリルアミド電気泳動で分離し、タンパク質バンド全体を切り出した。その後、ゲル内消化を行い、LC-MS でタンパク質を同定した。また、各手法で精製したエクソソーム (n=3)における同定タンパク質のpair-wise相関を比較した。
①同定したタンパク質の含有量トップ10 比較
②Pair-wise相関の比較
▼エクソソームの標識と細胞への添加試験
PSアフィニティー法で精製したエクソソームを PKH67 Green Fluorescent Cell Linker Kit (Sigma-Aldrich社)で標識し、HeLa 細胞の取り込み能を確認した。
<PKH67 を用いたエクソソーム標識>
- PSアフィニティー法でCOLO201 細胞培養上清からエクソソームを精製する*1。
- BCAアッセイ および NanoSight を用いてエクソソーム溶液のタンパク質濃度と粒子濃度を測定する。
- 1.5 mL チューブにエクソソーム溶液を分注する*2。
- 2.0 μL の PKH67 linker を 0.25 mL の Diluent C (PKH67 キット添付) に溶解させる・・・ 4 x Dye solution*3
- サンプルに対して 1/3 量の 4 x Dye solution を添加し、混合後に室温で 5 - 10 分間インキュベーションする。
- Exosome Spin Columns (MW 3000) (Thermo Fisher Scientific社) を添付プロトコルに沿って PBS で平衡化する。
- 上記平衡化済みカラムに 100 μL ずつサンプルをそれぞれ添加し*4、750 x g、2 分間遠心する。
- 前日ディッシュに播種しておいたHeLa細胞に溶液を全量添加*5し、24 時間後に顕微鏡観察およびフローサイトメトリー解析を実施する。
*1 キット添付の溶出液にEV-SaveTM 細胞外小胞ブロッキング試薬(製品コード 058-09261)を加えると、工程7 のゲル濾過処理時で標識サンプルの吸着ロスを抑制することができます。
*2 タンパク質量で3 μg、粒子数 1 x 1010個相当のエクソソームを使用しましたが、標識に必要なエクソソーム量は適宜調節してください。
*3 標識に必要な量を適宜調製してください。
*4 カラム一本への最大添加量は100 μL のため、サンプル量が100 μL 以上の場合は必要本数用意してください。
*5 添加するエクソソーム量を適宜調節してください。
- 顕微鏡観察
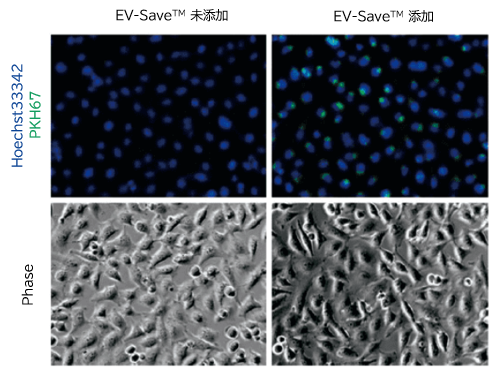
- フローサイトメトリー解析
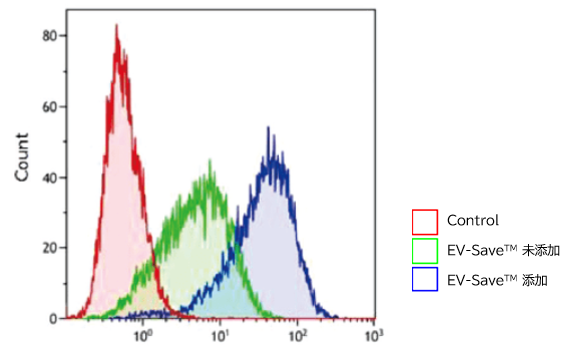
結果: PKH67標識されたエクソソームがエンドサイトーシスで取り込まれていることが、顕微鏡でもフローサイトメーターでも確認できた。 また、EV-SaveTM を添加したサンプルは、Dye を除去する時のゲルろ過カラムへの吸着ロスを抑制した。
参考文献
1) Trajkovic, K. et al. : Science 319(5867), 1244(2008).
2) Miyanishi, M. et al. : Nature 450(7168), 435(2007).
3) Nakai, W., et al.: Sci. rep. 6(1), 1(2016).