イメージング
ライフサイエンス分野におけるイメージングは、形態・構造をみる、分布・局在をみる、動態・相互作用をみるなどの目的で用いられ、使用する顕微鏡や観察対象、試料の種類によって様々な手法が存在します。 当社では、組織透明化、光-電子相関顕微鏡法 (CLEM) など新規イメージング技術を支える試薬をはじめ、イメージングでよく使用される発光/蛍光プローブを多数ラインアップしています。
学術コンテンツ
イメージングに必要な装置・試薬
顕微鏡
顕微鏡では肉眼では見えない小さな対象を拡大して観察することができます。組織や細胞の構成要素は光に対して同じような透過性があるため、そのままではコントラストが低く、形態や構造を認識することは困難です。一般的な光学顕微鏡では染色や光学的処理によってコントラストをつけて観察します。その他にも蛍光顕微鏡や電子顕微鏡など様々な顕微鏡が存在します(表1)。
表1: 主な顕微鏡の特徴と用途
| 顕微鏡 | 特長 | 用途 |
|---|---|---|
| 明視野顕微鏡 | 一般的な光学顕微鏡。照明で視野全体を明るくする。染色でコントラストをつける。 | 染色試料の観察 |
| 暗視野顕微鏡 | 試料の側方から光を当て、散乱した光を観察する。 | 無染色試料の観察 |
| 位相差顕微鏡 | 試料の屈折率の違いで生じる回析光と直進光の位相差を明暗に変換してコントラストをつけて観察する。 | 無色透明な試料の観察 |
| 微分干渉顕微鏡 | 試料内の光路長 (屈折率×厚さ)の勾配を明暗に変換しコントラストをつけて観察する。 | 無色透明な試料の観察 |
| 蛍光顕微鏡 | 試料中の蛍光物質に励起光を照射し、発せられた蛍光を画像化する。 | 蛍光色素で標識した細胞や組織の観察 |
| 共焦点顕微鏡 | 点光源とピンホールにより試料内の焦点を絞ることで、非侵襲の切片画像を高解像度で取得できる。 | 細胞や組織の立体観察 (多くは蛍光色素で標識) |
| 走査型電子顕微鏡 | 試料に電子線を走査し、二次電子や反射電子などから得られた像を観察する。 | 試料表面にある微細構造の観察 |
| 透過型電子顕微鏡 | 試料に電子線をあて、透過した電子から得られた像を観察する。 | 試料内部にある微細構造の観察 |
Focus - 光-電子相関顕微鏡法 (CLEM)用試薬 -
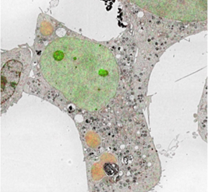
蛍光顕微鏡の重ね合わせ画像
光-電子相関顕微鏡法 (CLEM)は同一試料を光学顕微鏡と電子顕微鏡を用いて観察し、それぞれの像を比較することにより、
細胞内における細胞小器官・細胞分子の局在および形態を解析する手法です。
従来法では蛍光色素の退色により、同一切片で光学顕微鏡と電子顕微鏡観察を行うことは困難でしたが、
当社の蛍光復活試薬により同一切片での観察が可能になりました。
前処理試薬
顕微鏡で組織や細胞を観察する場合、生体本来の状態を固定、維持する必要があります。固定は試料の不動化や分解・腐敗の防止を目的に、ホルマリン溶液などを使用して生体分子を架橋する方法が一般的です。またタンパク質の検出で抗体を使用する場合には、細胞膜を透過させるため界面活性剤 (TritonX-100)や有機溶媒で処理します。その他にも実験系によって、不要な染色試薬・プローブの除去や、抗体の非特異的な吸着を防ぐブロッキングなどの操作があります。
Focus - 透明化試薬 -

(左: 未処理、右: 処理後)
生体組織には屈折率の異なる様々な物質が存在しているため、光散乱が生じます。
そのため、生体組織を透明にするには、組織から高屈折率成分を取り除いたり、溶媒を高屈折率液体に
置き換えたり、もしくは両方を取り入れて、組織中の屈折率を均一にすることが必要となります。
組織を透明化することにより、深部観察、高解像度観察等が可能になります。
プローブ
特定の細胞・分子や生命現象を観察するには対象に特異的なプローブの選択が必要です。
ここではイメージングで多用される発光/蛍光プローブについて解説します。
発光プローブ
化学反応によって基質が励起状態となり、その後基底状態へ戻る際に光を発するプローブです。化学反応を利用しているため選択性が高く、ノイズが小さく、大きなシグナルを得られることが特長です。広いダイナミックレンジに対応できるためATPやカルシウムイオンの動態を調べる際に良く使用されます。
代表的な発光プローブとしてホタルルシフェリン-ルシフェラーゼ (FLuc)やアポイクオリンもしくはウミシイタケルシフェラーゼ(RLuc)-セレンテラジンがあります。
蛍光プローブ
蛍光は励起光により励起状態になり、基底状態に戻る際に光を発します。発光プローブとは異なり、反応基質が不要であるため励起光を当てるだけでシグナルを得られるというメリットがあります。一方で、生体内には蛍光プローブ以外の蛍光物質も存在するため発光プローブに比べノイズが大きく、ダイナミックレンジも狭いというデメリットもあります。
蛍光プローブとしてはローダミンやフルオレセインなどの有機系蛍光色素や、GFPなどの蛍光タンパク質が良く用いられています。当社では細胞・細胞小器官などを特異的に標識するプローブや生体機能解析に使用するプローブを多数取り扱っております(表2)。
表2: 観察対象別 蛍光プローブ
| 観察対象 | 標的と蛍光プローブ |
|---|---|
| 細胞の形態や運動 | 細胞骨格 (アクチンフィラメント、微小管、中間径フィラメント) ファロイジンはアクチンフィラメント特異的に結合するため、標識ファロイジンがプローブとして使用される。 細胞骨格タンパク質特異的な抗体や細胞骨格タンパク質と蛍光タンパク質の融合タンパク質も多用される。 |
| 特定の細胞小器官・細胞 | 細胞核 DAPI、ビスベンズイミド (Hoechst) 33258/33342、 Propidium IodideなどのDNA特異的蛍光色素で染色する。 核小体 RNA特異的蛍光色素を使用すると、rRNAの産生の場である核小体で特に強い蛍光を観察できる。 ミトコンドリア エネルギー産生によるプロトン勾配で膜電位が生じているため、膜電位依存的な蛍光試薬で染色可能。 Rhodamine123やJC-1が良く用いられるが、細胞滞留性や細胞毒性を改良した製品も販売されている。 小胞体・ゴルジ体 代謝型の蛍光脂質が汎用的な染色試薬である。小胞体やゴルジ体に局在するタンパク質と蛍光タンパク質の融合タンパク質も利用される。 神経細胞(回路) 神経細胞に注入することで神経細胞および神経回路の標識が可能になる。細胞体に注入し、神経終末を標識する色素を順行性トレーサーといい、 神経終末に注入し、細胞体を標識する色素を逆行性トレーサーという。カルボシアニン色素やデキストランゴールドなどが使用される。 |
| 生体分子の局在 | 核酸 検出したい核酸と相補的な核酸をプローブとして用いる。プローブとなる核酸はFITCやCy5などで標識される。 タンパク質 目的のタンパク質特異的な抗体を用いるのが一般的。一次抗体に直接蛍光色素を結合させるか、蛍光色素標識二次抗体を使用して検出する。 適切な抗体がない場合は、あらかじめアフィニティータグや蛍光タンパク質でタグ付けしたタンパク質を発現させる。 糖鎖 糖鎖に特異的に結合するレクチンを蛍光標識して検出する。 |
| 細胞内活動 | 細胞内シグナル伝達 カルシウム濃度によって蛍光強度が変化するプローブを使用することで、カルシウムの細胞内シグナル伝達の観察が可能である。 カルシウムプローブはイクオリン、Indo1、Fluo4、Fura2などが存在する。 pH変化 pHによって蛍光強度が変化するプローブを使用することで、オートファージーにおけるリソソームとの融合・内容物の分解などを検出できる。 BCECFやSNARF-1が代表的なpH依存性蛍光プローブである。 |
| 相互作用 | タンパク質相互作用 2つのタンパク質をそれぞれ別の蛍光色素(例えばCFPとYFP)で標識し、2つが接近した時に一方の蛍光がもう片方を励起する FRET(fluorecent resonance energy transfer)の原理を利用することでタンパク質の相互作用を観察できる。 |
参考文献
宮脇敦史 編, 実験医学別冊 GFPとバイオイメージング, 羊土社, 2000
三輪佳宏 編, 実験がうまくいく蛍光・発光試薬の選び方と使い方, 羊土社, 2007
高田邦昭, 斎藤尚亮, 川上速人 編, 第5版 実験医学別冊 染色・バイオイメージング実験ハンドブック, 羊土社,2012
製品ラインアップ
-
組織透明化
-
光-電子相関顕微鏡法 (CLEM)
-
プローブ/トレーサー
-
-
- 同仁化学 リソソーム pH 検出キット(Green/Deep Red)
- 同仁化学 pH センサーラベル化キット
- 同仁化学 リソソーム染色色素
- Biotium社 NucSpot Live Cell Nuclear Stains
- Biotium社 ViaFluor Live Cell Microtubule Stains
- 同仁化学 エンドソーム染色試薬
- 同仁化学 細胞膜染色試薬
- 小胞体特異的蛍光プローブ
- DNA特異的蛍光プローブ
- ゴルジ体特異的蛍光プローブ
- ミトコンドリア膜電位感受性蛍光プローブ
- 膜電位感受性蛍光プローブ
- 同仁化学 核小体染色試薬(Nucleolus Bright Green Nucleolus Bright Red)



