官能基保護剤・脱保護剤
複数の官能基のうち、特定の官能基だけを反応させる時には、それ以外の官能基を一時的に不活性な形に変換します。
この反応を保護反応といい、導入された部位を保護基と呼びます。目的とする反応を終えた後に保護基を外す反応もセットとなっており、これを脱保護反応といいます。保護基には、高収率で導入され、かつ容易に外すことができる性質が求められます。特に全合成などの多段階反応では、どの保護基を選択してどのように外すかが合成戦略上で重要となってきます。当社では各官能基に合わせた保護試薬をご用意しており、用途に合わせてお選びいただけます。詳細については各ラインアップをクリックしてご確認ください。
学術コンテンツ
保護基の役割
複数の異なる官能基を有する基質の反応では、ターゲットとなる官能基の反応性が別の官能基より低かったり、いくつかの官能基が同時に反応してしまう場合があります。その際は、反応させたくない官能基のみを一時的に保護しておく必要があります。この際に用いる試薬が保護剤であり、官能基の反応性が低下した誘導体に変換できます。
例として、ケト基とエステル基を同一分子内に有する基質のうち、エステル基のみを還元したい場合を取り上げ、保護基の役割や使い方を紹介します。
目的とするエステル基の還元には、水素化アルミニウムリチウム(LiAlH4)が有効です。しかし同一分子内にケト基が存在する場合、目的となるエステル基とともに還元されてしまいます(図1)。
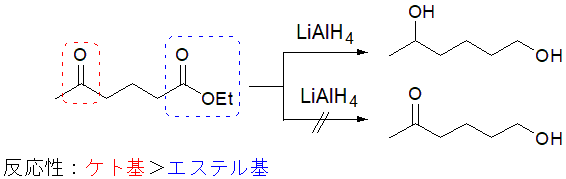
図1 ケト基とエステル基を持つ基質のLAH還元反応
このような場合は、酸触媒存在下でエチレングリコールを反応させて、ケト基をアセタール保護する方法が有効です(図2)。
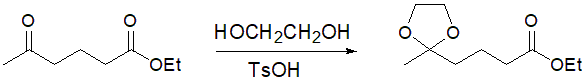
図2 ケト基の保護反応(アセタール化)
その後、LiAlH4と反応させれば、エステル基をヒドロキシ基に還元できます(図3)。アセタールはエーテルであるため、求核種や塩基、さらにLiAlH4のような還元剤に対して安定です。
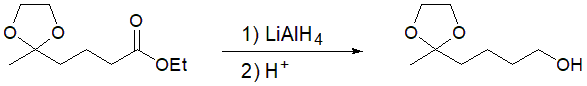
図3 エステル基の還元反応
還元反応後に酸加水分解条件で脱保護すると、ケト基に戻すことができ、目的物が得られます(図4)。
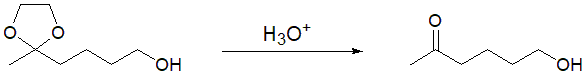
図4 脱保護反応によるケト基への変換(脱アセタール化)
保護反応試薬に求められる条件
有機合成において保護反応はよく活用されますが、試薬を選択する際は以下の点を考慮する必要があります。
〇高収率で簡単な方法であること
このタイプの反応は、必然的に保護と脱保護の2つの反応がセットになります。反応工程が長くなる分、一方のみでも収率を劇的に低下させる可能性がある場合、コストに影響をします。創薬などの全合成においては重要視すべきです。
〇安価で入手が容易であること
保護基を使用する場合には、高い収率が得られる保護基の選択が必須ですが、保護試薬自身も入手が容易で安価の方が好ましいです。
〇クロマトグラフィーに対して安定であること
場合によっては、保護基をつけたまま精製することも想定されますので、カラムクロマトグラフィーで分解しない保護基が適切です。精製せず不純物を含む状態で反応を進めると、後工程で除去できなくなるリスクが残ります。
〇保護体が次工程で扱いやすいこと
保護反応時の触媒などが残留して、後の反応に悪影響を与える場合は適切ではありません。また、保護体が揮発性化合物になったり、有機溶媒に不溶になるなど、物性の問題を抱えていないことが重要です。
〇特定の条件下で選択的かつ効率的に除去できること
脱保護反応で生じた副生成物は、容易に分離されるものでなければいけません。また、副生成物が既知であり、その残存量も容易に検出できることも重要です。
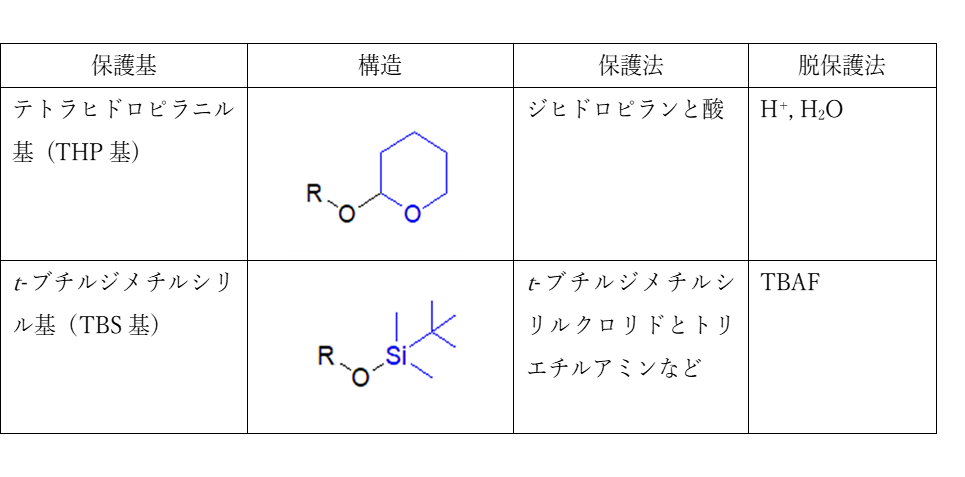
ヒドロキシ基の保護基の種類、反応条件
ヒドロキシ基の一般的な保護法はエーテル化です。ヒドロキシ基を持つ基質を酸触媒条件下でジヒドロピランと反応させると、テトラヒドロピラン(THP)基がエーテル結合した形で保護できます。脱保護には酸加水分解条件を用います。
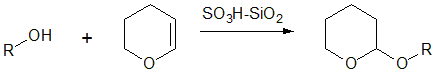
図5 THP保護の例1)
酸性条件に耐えうる保護基など、その他の多くの場合にはシリルエーテルが用いられます。シリルエーテルは置換基の種類により安定性が異なり、t-ブチルジメチルシリル基(TBS基)やトリイソプロピルシリル基(TIPS基)などが挙げられます。シリルエーテルの最も有利な点は脱保護の容易さであり、テトラブチルアンモニウムフルオリド(TBAF)で処理する操作です。Si-F結合はSi-O結合よりもさらに強力ですので、フッ化物イオン(F-)によって、高収率、高選択的にSi-O結合が切断できます。
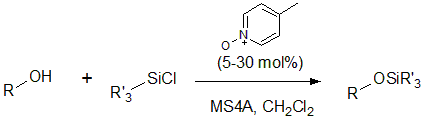
図6 シリルエーテル保護の例2)
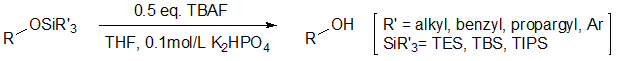
図7 シリルエーテルの脱保護3)
また、その他にもメトキシメチル基(MOM基)、メトキシエトキシメチル基(MEM基)、アセチル基(Ac基)、ピバロイル基(Pv基)、ベンゾイル基(Bz基)、ベンジル基(Bn基)などの保護基が挙げられます。
カルボニル基の保護基の種類、反応条件
アルデヒドおよびケトンなどのカルボニル基は、一般的にアセタール保護が用いられます。安定性の面で環状アセタールが選択されることが多く、各種の求核反応から官能基を保護することができます。アセタールは過剰の酸性加水分解条件で脱保護できます。
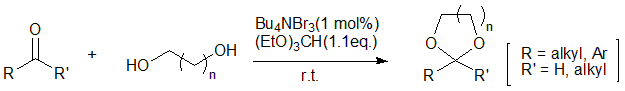
図8 アセタール化によるカルボニル基の保護4)

アミノ基の保護基の種類、反応条件
アミノ基の一般的な保護基は Boc基(t-ブトキシカルボニル基)と Cbz(ベンジルオキシカルボニル基)です。これらの保護基は、ペプチド合成などでよく用いられます。
Boc基は塩基条件や求核反応に対して安定であり、塩化水素-ジオキサン溶液やトリフルオロ酢酸(TFA)等で脱保護できます。
Cbz基で保護されたアミンはカルバミン酸エステルであり、アミドと同様、窒素の非共有電子対がカルボニル基と共役しているため、求核性はありません。Cbz基は酸や塩基条件では安定であり、接触水素化(Pd/C, H2)によって脱保護されます。
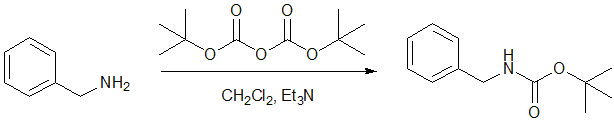
図9 アミノ基のBoc保護5)
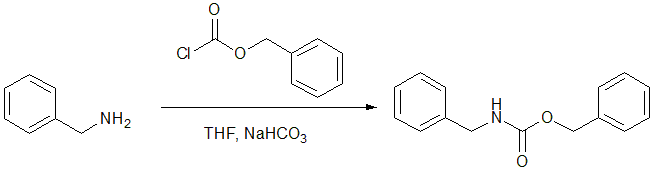
図10 アミノ基のCbz保護6)
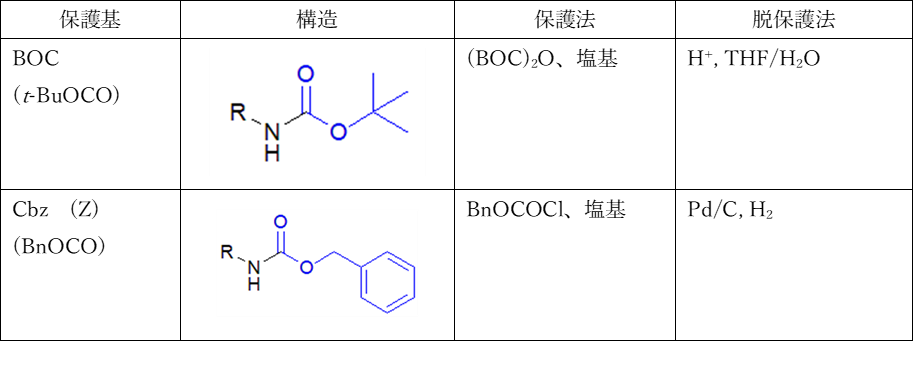
また、その他にも9-フルオレニルメチルオキシカルボニル基(Fmoc基)、アリルオキシカルボニル基(Alloc基)、2, 2, 2-トリクロロエトキシカルボニル基(Troc基)、2-ニトロベンゼンスルホニル基(Ns基)などがあります。
カルボキシ基の保護基の種類、反応条件
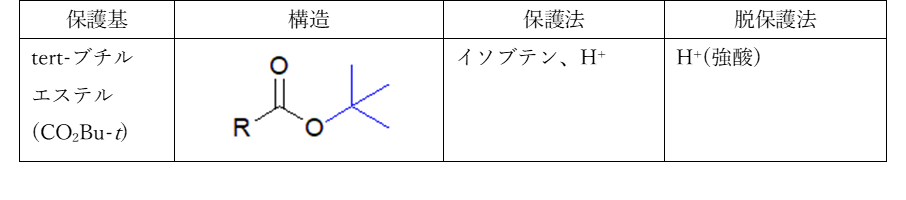
カルボン酸(カルボキシ基)の保護基としては、通常t-ブチルエステルが用いられます。t-ブチルエステルは硫酸存在下、イソブテンから生成したカチオンとカルボン酸を反応させて合成します。t-ブチルエステルはその立体障害のために塩基性条件での求核攻撃も起こりにくいですが、酸性条件では容易に加水分解して、脱保護できます。
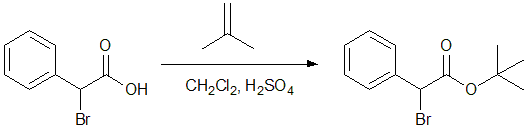
図11 カルボキシ基の保護7)
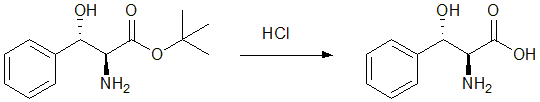
図12 カルボキシ基の脱保護8)
参考文献
1) Shimizu, K., Hayashi, E., Hatamachi, T., Kodama, T., Kitayama, Y.: Tetrahedron Lett., 45, 5135 (2004).DOI: 10.1016/j.tetlet.2004.04.186
2) Yoshida, K., Fujino, Y., Itatsu, Y., Inoue, H., Kanoko, Y., Takao, K.: Tetrahedron Lett., 57, 627 (2016).DOI: 10.1016/j.tetlet.2015.12.114
3) DiLauro, A. M., Seo, W., Phillips, S. T.: J. Org. Chem., 76, 7352 (2011).DOI: doi.org/10.1021/jo200848j
4) Gopinath, R., Haque, Sk. J., Patel, B. K.: J. Org. Chem., 67, 5842 (2002).DOI: 10.1021/jo025701o
5) Cresswell, A. J., Eey, S. T. C. , Denmark, S. E.: Nat. Chem., 7, 146 (2015).
6) Tran, V. H., Kim, H. K.: New J. Chem., 43, 14093 (2019).DOI: 10.1039/C9NJ03111A
7) Schuster, M. C., Mann, D. A., Buchholz, T. J., Johnson, K. M., Thomas, W. D., Kiessling, L. L.: Org. Lett., 5, 1407 (2003).DOI: 10.1021/ol0340383
8) Davies, S. G., Fletcher, A. M., Frost, A. B., Roberts, P. M., Thomson, J. E.: Tetrahedron, 70, 5849-5862 (2014).DOI: 10.1016/j.tet.2014.06.057



