ゲノム編集関連試薬
ゲノム編集とは、狙った位置でDNAを切断し、DNAの除去およびDNAを挿入する技術です。これまでにZinc-Finger Nuclease (ZFN)やTranscription activator-like effector nuclease(TALEN)など様々なゲノム編集技術が開発されてきましたが、その中でも2012年にダウドナ教授・シャルパンティエ教授らによって報告されたCRISPR-Cas9(クリスパーキャスナイン)は、設計・操作の簡便性や適用範囲の広さから幅広い分野で利用されています。
当社ではニッポンジーンの高濃度Cas9タンパク質やCas9 mRNA、ガイドRNA合成キット、変異検出キットなどゲノム編集関連製品をラインアップしています。
学術コンテンツ
ゲノム編集とは?

ゲノムはDNAの遺伝情報全体のことを指し、生物の設計図に例えられます。ゲノム編集とは、ゲノム内の特定箇所を意図的に改変する技術です。ゲノム編集技術を用いることにより、標的DNA配列を改変し、生物の性質を変えられます。
ゲノム編集技術を利用することにより、標的遺伝子の欠損(ノックアウト:knock-out, KO)、標的遺伝子への変異導入、遺伝子の挿入(ノックイン:knock-in, KI)が可能です。モデル生物として、動物、微生物、植物と幅広く用いられています。特に、哺乳類の代表的なモデル生物であるマウスは、多くの研究に用いられています。ノックアウトマウス、ノックインマウスなど、既に様々な遺伝子改変マウスが樹立されており、簡便かつスピーディーに研究を進められます(遺伝子改変動物作製の受託サービスはこちら)。
現在のゲノム編集技術では、標的DNA配列の切断と、その後に起こる修復を利用してDNA配列を改変します。この切断を行う方法として、CRISPR/Cas9、TALEN、ZFNがあります。
CRISPR/Cas9 : Clustered Regularly Interspaced Short Palindromic Repeat
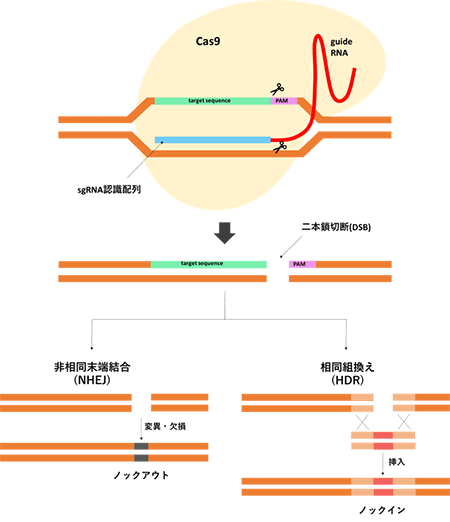
CRISPR/Cas9(クリスパーキャスナイン)は、現在のゲノム編集の主流となっている技術です。この技術は2020年のノーベル化学賞を受賞したことでも良く知られています。
CRISPR/Cas9では以下の2つが複合体を形成して標的DNAを切断します。
- gRNA(ガイドRNA、sgRNA):標的DNA配列に対応したRNA
- Cas9:DNA切断酵素
gRNAは、PAM(proto-spacer adaptor motif)配列とそれに続く20塩基を認識して結合し、Cas9を誘導します。Cas9は標的DNA配列を選択的に切断します。二本鎖切断されたDNAは、ドナーDNAがある場合には相同組換え(HDR, homology-directed repair)によりノックインが可能です。ドナーDNAがない場合には、非相同末端結合(NHEJ:non-homologous end joining)により切断部位の修復が行われますが、数塩基の挿入・欠損が起こるため、ノックアウトが可能です。
CRISPR/Cas9の利点は、標的DNA配列を認識するためにRNAを使うことにあります(次に紹介するTALENやZFNでは酵素が標的DNA配列を認識します)。RNAは化学的に合成できるため、標的DNA配列に合わせたガイドRNAを容易に作製できます。
当社では、ゲノム編集に使用するガイドRNAなどの短鎖RNAを合成・精製するためのキット CUGA®7 gRNA Synthesis Kitを取り扱っています。目的のガイドRNAを正確かつ大量に調製します。
TALEN : Transcription activator effector-like nuclease
(石野良純(2017)を参考に改変)
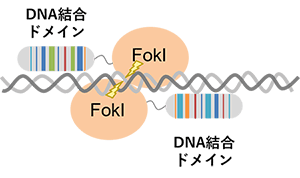
TALENは、植物病原菌Xanthomonas spp.由来のTAL effector(TALE) とFokIヌクレアーゼを用いるゲノム編集技術です。
TALEは34アミノ酸の繰り返し配列からなるDNA結合ドメインを有しており、1リピートが標的DNA配列の1塩基を認識します。繰り返し配列の12番目と13番目のアミノ酸はrepeat variable di-residues(RVD)と呼ばれ、RVDによって標的の塩基が決定されます。この配列を並べ替えることにより、任意の標的配列へのDNA結合ドメインを作製します。TALENは、DNA配列上において2分子が向かい合うように設計することで、 FokIヌクレアーゼが二量体化し、DNA切断活性を示します。切断されたDNAは、細胞内のDNA修復機構によって修復されますが、その過程で遺伝子欠損や挿入などの変異が導入されます。
ZFN : Zinc-finger nuclease
(石野良純(2017)を参考に改変)
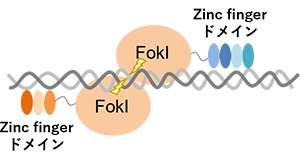
Zinc-finger nuclease(ZFN)は、TALENと同じく、特定のDNA配列を切断する制限酵素です。ZFN は3~6個のzinc fingerを持ち、1つのzinc fingerは3塩基を認識することから、9~18bpの塩基に結合します。DNA切断時にはZNFが二量体化するため、18~36bpの配列特異的にDNA二本鎖を誘導できます。
ZFNが開発されたのは1996年であり、TALEN(2010年)やCRISPR/Cas9(2012年)よりも先行して研究されていました。しかし、標的DNA配列のみを切断できるZFNの設計は容易では無いことから、多くの研究者にとって気軽に利用できるものではありませんでした。
ゲノム編集(CRISPR/Cas9法)のプロトコル

CRISPR/Cas9を用いて動物由来の培養細胞のゲノム編集を行う方法に、プラスミド法とRNP(Ribonucleoprotein)法の2つがあります。
①プラスミド法
対象の細胞内でガイドRNAとCas9の複合体を作る方法です。
- ガイドRNAとCas9をコードしたプラスミドを作成します。プラスミドから転写されたガイドRNAは、発現したCas9と細胞内で複合体を形成します。ガイドRNAとCas9をそれぞれ個別のプラスミドに組み込む場合と、両者を同じプラスミドに組み込む場合があります。
- 対象の細胞にプラスミドをトランスフェクションします。リポソーム法等を用いた一般的なトランスフェクション試薬で細胞内へ導入できます。
②RNP法
- ガイドRNAとCas9(タンパク質)を含む溶液を混合し、試験管内で複合体(RNP)を形成させます。ガイドRNAとして1本のRNA(sgRNA)を使う方法と、2本のRNA(crRNAとtracrRNA)を使う方法があります。
- 対象の細胞にRNPをトランスフェクションします。RNPのトランスフェクションに適した専用の試薬も販売されています。
いずれの方法でも、トランスフェクション後、培養細胞で目的遺伝子が発現していることを確認し、ソーティングや限界希釈法を用いてゲノム編集された細胞を取得します。
ゲノム編集(CRISPR/Cas9法)に必要な試薬

CRISPR/Cas9法によるゲノム編集実験においては、下記のような試薬を用います。
- 高発現Cas9 mRNA: CleanCap® Cas9 mRNA
- Cas9タンパク質:Cas9 ヌクレアーゼ プロテイン NLS
- ガイドRNA合成:CUGA®7 ガイドRNA合成キット
- 変異導入確認キット:Rapid Indel Detection Kit
- 抗Cas9抗体:抗Cas9モノクローナル抗体
- ゲノム編集促進試薬:CRISPR効率化促進化合物
また、受託サービスとしては以下があります。
- 動物の遺伝子改変:CRISPR/Cas9による遺伝子改変動物作製
- 細胞の遺伝子改変:ヒトiPS細胞およびがん細胞の遺伝子改変サービス
ガイドRNAの設計と合成

CRISPR/Cas9で用いられるガイドRNAの役割は、標的のDNA配列を認識してDNA切断酵素であるCas9を標的の場所に誘導することです。Cas9によるDNAの切断にはPAM配列(5ʼ-NGG-3ʼ)が必要です。このPAM配列の上流にある約20塩基がガイドRNAの標的認識配列です。
ガイドRNAを設計する際に重要なポイントは以下の2つです。
①標的DNA配列に高い切断活性を持つこと
②標的DNA配列以外の配列を切断しないこと
ガイドRNA設計には、無料オンライン設計ツールがよく使用されます。以下に2つのツールを紹介します。
CHOPCHOP:PAM配列の上流20塩基をソフトウェアが分析し、ガイドRNAの候補をランキング化します。また、ゲノム上の類似配列がリスト化されるため、オフターゲットの可能性がある部位を確認できます。
CRISPRdirect:標的配列特異的なガイドRNAをハイライトで表示します。また、オフターゲット候補部位を検索できます。さらに、ゲノム情報があれば、どのような生物種でも対応可能です。
ゲノム編集におけるオフターゲットとは
ゲノム編集におけるオフターゲットとは、意図した標的以外のDNA配列を指します。ゲノム上に標的としたDNA配列に類似した(もしくは同じ)配列が存在した場合、オフターゲットに対してゲノム編集が起こる恐れがあります(オフターゲット効果)。
ガイドRNAによるDNA配列のミスマッチにより、標的外の領域に二本鎖切断が誘導され、NHEJによる挿入・欠損が生じます。このオフターゲット効果を回避するための方策として、以下が考案されています。
(1)ダブルニッキング法
Cas9の2つのヌクレアーゼドメインのうち、片方を不活性化し一本鎖DNA切断型Cas9を用いる方法です。これにより、2箇所で切断された場合に変異が入ります。

(Mali P(2013)を参考に改変)
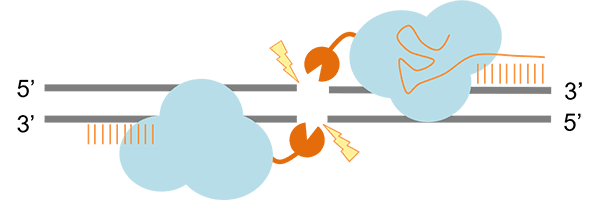
(2) FokI-dCas9 融合タンパク質法
Cas9のヌクレアーゼ活性を不活性化させTALENやZFNで使用するヌクレアーゼFokIを融合したFokI-dCas9融合タンパク質を用いる方法です。FokIが二量体化することで二本鎖DNAを切断します。
(Mali P(2013)を参考に改変)
(3) 短縮型gRNA法
ガイドRNAの長さを短くすることにより、標的DNA配列への特異性を高める方法です。
当社では、ゲノム編集による変異導入を迅速に確認できるキットRapid Indel Detection Kitや試薬(T7 Endonuclease I reaction Mix、抗Cas9モノクローナル抗体)を取り扱っています。
ゲノム編集の応用:社会からの期待

CRISPR-Cas9の開発により、ゲノム編集の応用の幅が広がり、医療分野での大きな発展が期待されています。病気の理解や創薬に関する研究だけでなく、病気の原因となる遺伝子を直接改変する遺伝子治療における実用化も進んでいます。また、食品分野への応用も期待されており、生産性や品質に優れた農産物や、肉質やサイズが改善された魚の研究が進められています。
ゲノム編集の成果を社会で活かすためには、ゲノム編集に関する法制度の整備や、正しい知識の普及による社会の理解増進が今後の課題です。
参考文献
- Martin, J. et al: Science, 337(6096): 816–821(2012).
- Havlicek, S. et al.: Mol. Ther., 25, 342 (2017)
- Miller, J. C. et al.: Nat. Biotechnol., 29, 143 (2011).
- Mali P. et al. Nature Methods, 10:957963 (2013).
- 安本周平, 關光, 村中俊哉: 生物工学会誌: 92(10), (2014).
- 石野良純: 生物工学会誌: 95(7), (2017)
- 山本 卓, 坂本 尚昭, 佐久間 哲史:ウイルス, 64(1): 75-82(2014)




