【総説】超高純度ヒト骨髄由来間葉系幹細胞REC
本記事は、和光純薬時報 Vol.90 No.2(2022年4月号)において、島根大学 医学部 生命科学講座、PuREC株式会社 陶山 隆史様、松崎 有未様に執筆いただいたものです。
はじめに
間葉系幹細胞(MSC)は、抽出した骨髄細胞から、MSCの培養皿への接着性を利用して比較的簡単な手順で分離することができ、主にin vitroで軟骨や骨への分化誘導を行い、その後、局所移植を行うなどの臨床研究が行われてきた。
近年、MSCはサイトカインなどの様々な体液性因子を産生し、T細胞や樹状細胞などの炎症細胞に作用して、強い免疫抑制・抗炎症作用を発揮することが報告されている1)。この効果を利用して、ヒト骨髄由来のMSCは、移植片対宿主病(GVHD)の再生医療製品として承認され、臨床現場で使用されている2, 3)。
その他にも、低ホスファターゼ症4)、潰瘍性大腸炎やクローン病などの炎症性腸疾患5)、心筋梗塞、B型肝炎6)、糖尿病7)、全身性エリテマトーデス8)、進行多発性硬化症9)、脊髄損傷10)、変形性関節症11)、乳がん保存療法後の乳房再建12)、筋ジストロフィー13)など、幅広い疾患を対象とした臨床研究が進行中である(図1)。そのほとんどで、治療に必要な細胞数は1患者あたり1~10億個14)と設定されており、この場合、品質を維持したまま大量の細胞を培養する必要がある。
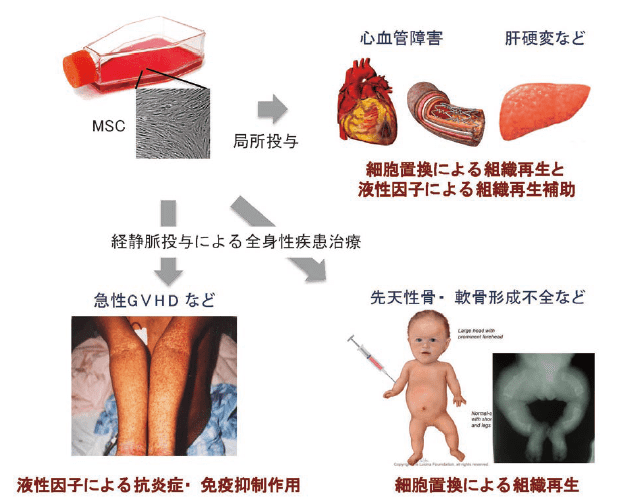
図1.間葉系幹細胞が持つ機能と臨床応用
培養MSCの性質と問題点
現在広く用いられているMSCの多くは、骨髄単核細胞を培養皿に播種し、2~3週間の培養後に出現する線維芽細胞様のコロニー形成細胞を回収して得られる(図2上段)。しかし、この方法で得られた接着性細胞集団(以下、培養MSCと記載)には、分化能が低い、あるいは完全に失われた老化細胞や間葉系以外の血球その他の細胞が混入していることはよく知られており、我々が調べた限り、分化・増殖能を有する未分化細胞、つまり真の幹細胞は1000細胞あたり1~3個という低い頻度でしか含まれていない15)。
また、培養MSCは、増殖サイクル数が限られており、通常4~6回の継代で増殖能を失い、分化能も著しく低下する(以上、未発表データ)。また、継代中に細胞の性質に変化が生じ、骨髄では遊走性を維持していたMSCが培養中に遊走性を失ってしまうため、経静脈投与による全身疾患治療には適用できないことも報告されている16, 17)。
培養MSCが持つこれらの欠点は特に臨床応用の現場で大きな問題となりうる。すなわち、細胞集団の純度の低さは製造されたロット間での細胞機能の差となり、培養による細胞老化は大量培養の制約となる。また遊走性の欠如は投与方法が限定される、などの困難が生じることが容易に予想できる。
超高純度間葉系幹細胞RECの発見
これらの問題を解決するために、我々は接着培養に頼らずに骨髄細胞から直接MSCを分離する先行分離法を開発した(図2下段)。LNGFR(CD271)とTHY-1(CD90)の2つの細胞表面タンパク質を指標に、セルソーターを用いて、LNGFRとTHY-1の共陽性細胞(LT細胞)を直接分離することで、ヒト骨髄由来単核細胞からヒトMSCを濃縮分離できることを報告した18)。LT細胞は、6個に1個という極めて高い頻度で線維芽細胞様のコロニーを形成する。計算上、全骨髄単核細胞の約3万倍にコロニー形成細胞が濃縮されている。
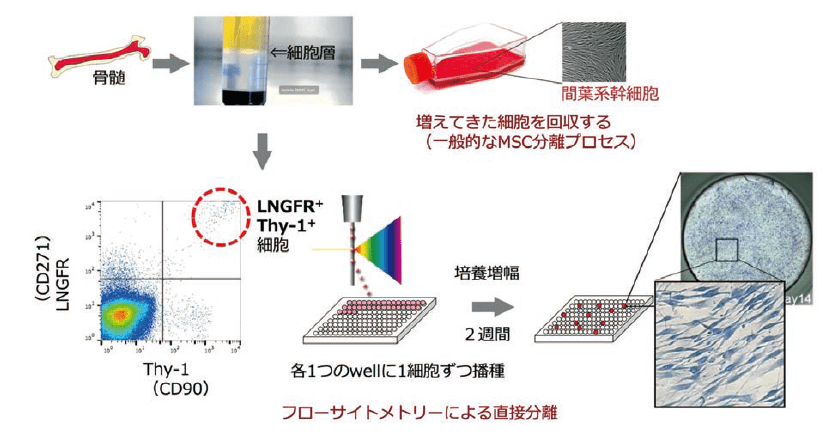
図2.一般的なMSC 培養プロセスと超高純度ヒト間葉系幹細胞(REC)の分離法
さらに、96ウェルプレートでLT細胞をシングルセルソーティングした後、各ウェルを個別に観察し、増殖が速く2週間後にはコンフルエントになったクローンをREC(Rapidly Expanding MSC Clone)、3週間後にコンフルエントになったクローンをMEC(Moderately Expanding MSC Clone)、さらに遅れてコンフルエントになったクローンをSEC(Slowly Expanding MSC Clone)と分類した(図3)。
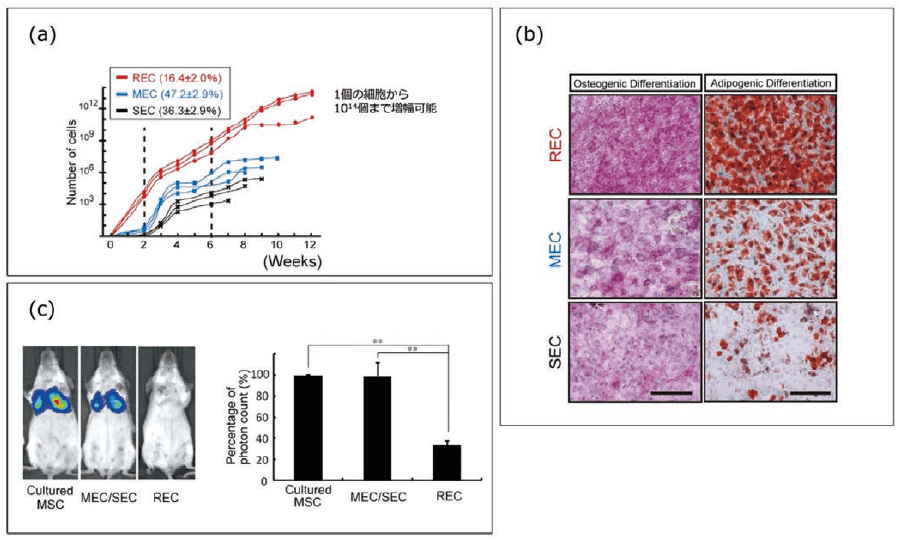
図3.超高純度ヒト間葉系幹細胞(REC)の特徴
(a)増殖能 (b)分化能/ 骨分化(ALP 染色)、脂肪分化(Oil Red O 染色)(c)遊走能/ マウスへの移植実験(ルシフェラーゼによる発光イメージング解析)
これら3グループの細胞機能を詳細に解析した結果、RECはMECやSECに比べて、①細胞形態が小さく均一であること、②細胞老化の指標の一つであるSA-β-galで染色されない新鮮な細胞であること、③増殖期の指標であるKi67がほぼ全細胞で陽性であること、④10継代以上の長期培養が可能であること、⑤脂肪、骨、軟骨への高い分化能を保持していることなどがわかった。またRECの最も大きな特長として、⑥マウスに静脈内投与しても肺毛細血管に捕捉される細胞は見られず、遊走性を保持していた。
以上の結果から、RECは現在市販されている培養MSCと比較して、増殖能・分化能・遊走能全てにおいて高く、かつ形態的にも機能的にも均一性が高い細胞集団である。
おわりに
我々はこの超高純度ヒト骨髄由来間葉系幹細胞RECを臨床に応用すべく、2021年には低ホスファターゼ症に対する探索的治験を開始した。また、脊柱管狭窄症、変形性関節症などの疾患をターゲットとした非臨床および臨床研究を現在進めている。特に大動物を用いたヘルニアモデルでは、RECとアルギン酸ナトリウムゲルの混合物を髄核摘出後の髄腔内に投与することで椎間板変性を効果的に予防できるなどの高い臨床効果を認めており19)、来年度中に探索的治験に入る予定である(図4)。
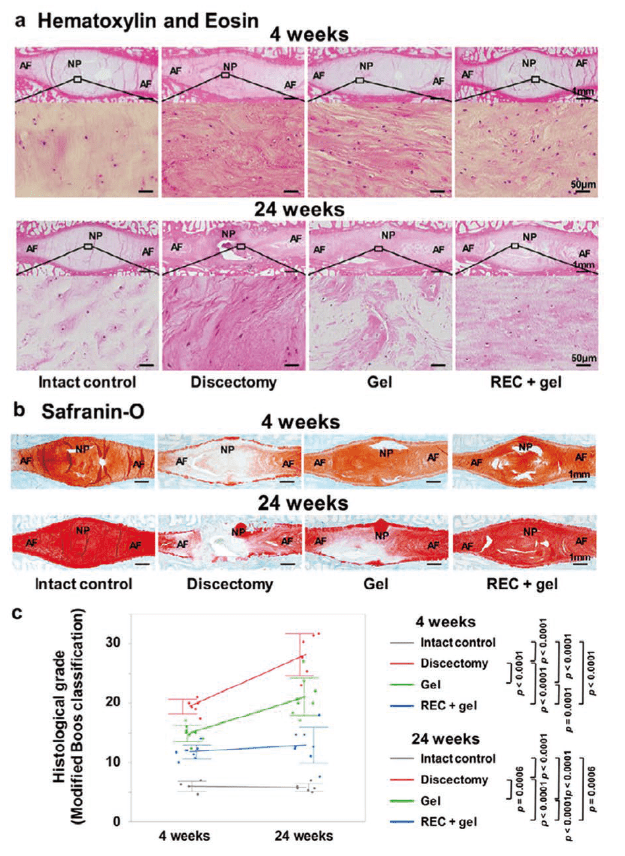
図4.REC を用いた椎間板ヘルニアモデル(ヒツジ)の治療効果
(a)HE 染色 (b)Safranin-O 染色 (c)Histological grade一般的な培養MSCが持つ全ての問題点をクリアーしたRECはMSCによる治療効果が認められた全疾患をより効果的に治療できる可能性を秘めており、今後より多くの難治性疾患治療への展開が期待される。
参考文献
- Ghannam, S., Bouffi, C., Djouad, F., Jorgensen, C. and Noël, D. : Stem Cell Res. Ther., 1 (1), 2 (2010).
- Muroi, K., Miyamura, K., Okada, M., Yamashita, T., Murata, M., Ishikawa, T., Uike, N., Hidaka, M., Kobayashi, R., Imamura, M., Tanaka, J., Ohashi, K., Taniguchi, S., Ikeda, T., Eto, T., Mori, M., Yamaoka, M. and Ozawa, K. : Int. J. Hematol., 103 (2), 243 (2016).
- Miyamura, K. : Int. J. Hematol., 103 (2), 155 (2016).
- Taketani, T., Oyama, C., Mihara, A., Tanabe, Y., Abe, M., Hirade, T., Yamamoto, S., Bo, R., Kanai, R., Tadenuma, T., Michibata, Y., Yamamoto, S., Hattori, M., Katsube, Y., Ohnishi, H., Sasao, M., Oda, Y., Hattori, K., Yuba, S., Ohgushi, H. and Yamaguchi, S. : Cell Transplant., 24 (10), 1931 (2015).
- Otagiri, S., Ohnishi, S., Miura, A., Hayashi, H., Kumagai, I., Ito, Y. M., Katsurada, T., Nakamura, S., Okamoto, R., Yamahara, K., Cho, K. Y., Isoe, T., Sato, N. and Sakamoto, N. : BMJ Open Gastroenterol., 5 (1), e000206 (2018).
- Volarevic, V., Markovic, B. S., Gazdic, M., Volarevic, A., Jovicic, N., Arsenijevic, N., Armstrong, L., Djonov, V., Lako, M. and Stojkovic, M. : Int. J. Med. Sci., 15 (1), 36 (2018).
- Bhansali, A., Asokumar, P., Walia, R., Bhansali, S., Gupta, V., Jain, A., Sachdeva, N., Sharma, R. R., Marwaha, N. and Khandelwal, N. : Cell Transplant., 23 (9), 1075 (2014).
- Sun, L., Wang, D., Liang, J., Zhang, H., Feng, X., Wang, H., Hua, B., Liu, B., Ye, S., Hu, X., Xu, W., Zeng, X., Hou, Y., Gilkeson, G. S., Silver, R. M., Lu, L. and Shi, S. : Arthritis Rheum., 62 (8), 2467 (2010).
- Connick, P., Kolappan, M., Crawley, C., Webber, D. J., Patani, R., Michell, A. W., Du, M. Q., Luan, S. L., Altmann, D. R., Thompson, A. J., Compston, A., Scott, M. A., Miller, D. H. and Chandran, S. : Lancet Neurol., 11 (2), 150 (2012).
- Pal, R., Venkataramana, N. K., Bansal, A., Balaraju, S., Jan, M., Chandra, R., Dixit, A., Rauthan, A., Murgod, U. and Totey, S. : Cytotherapy, 11 (7), 897 (2009).
- Koizumi, K., Ebina, K., Hart, D. A,, Hirao, M., Noguchi, T., Sugita, N., Yasui, Y., Chijimatsu, R., Yoshikawa, H. and Nakamura, N. : Osteoarthritis Cartilage, 24 (8), 1413 (2016).
- O'Halloran, N., Courtney, D., Kerin, M. J. and Lowery, A. J. : Breast Cancer (Auckl), 11, 1178223417726777 (2017).
- Ichim, T. E., Alexandrescu, D. T., Solano, F., Lara, F., Campion, R. de N., Paris, E., Woods, E. J., Murphy, M. P., Dasanu, C. A., Patel, A. N., Marleau, A. M., Leal, A. and Riordan, N. H. : Cell. Immunol., 260 (2), 75 (2010).
- Galipeau, J. and Sensébé, L. : Cell Stem Cell, 22 (6), 824 (2018).
- Colter, D. C., Class, R., DiGirolamo, C. M. and Prockop, D. J. : Proc. Natl. Acad. Sci. USA., 97 (7), 3213 (2000).
- Rombouts, W. J. and Ploemacher, R. E. : Leukemia, 17 (1), 160 (2003).
- Morikawa, S., Mabuchi, Y., Kubota, Y., Nagai, Y., Niibe, K., Hiratsu, E., Suzuki, S., Miyauchi-Hara, C., Nagoshi, N., Sunabori, T., Shimmura, S., Miyawaki, A., Nakagawa, T., Suda, T., Okano, H. and Matsuzaki, Y. : J. Exp. Med., 206 (11), 2483 (2009).
- Mabuchi, Y., Morikawa, S., Harada, S., Niibe, K., Suzuki, S., Renault-Mihara, F., Houlihan, D. D., Akazawa, C., Okano, H. and Matsuzaki, Y. : Stem Cell Reports, 1 (2), 152 (2013).
- Ukeba, D., Yamada, K., Suyama, T., Lebl, D. R., Tsujimoto, T., Nonoyama, T., Sugino, H., Iwasaki, N., Watanabe, M., Matsuzaki, Y. and Sudo, H. : EBioMedicine, 76, 103845 (2022).




