不斉反応
医農薬分野で重要視される不斉反応では、光学異性体を選択的に合成するためにデザインされた触媒や反応剤を使用します。こちらでは不斉合成において実績がある光延反応で使用する試薬、また様々なタイプのの有機触媒などをご紹介しております。
学術コンテンツ
キラル化合物について1)2)
キラル化合物とは、一般的に炭素原子に4つの異なる官能基が結合している化合物で自身の鏡像と重なり合うことのない化合物、または軸不斉を持つ化合物と定義されます。鏡像異性体、またはエナンチオマーとも呼ばれます。キラル化合物は、その特性から合成化学、医農薬といった分野で広く研究されています。
「キラル」という単語はギリシャ語の「cheir」(=手という意味)が由来であり、キラル化合物は「利き手を持つ」という形で解釈できます。エナンチオマーはRS表示法またはDL表示法で区別されます。糖とアミノ酸はDL表示法で、それ以外の物質はRS表示法が主流です。エナンチオマーは鏡映しの関係にある点を除けば構造的な違いがないため、数少ない例外を除いて物理化学的性質が同一となります。その数少ない例外が、平面偏光がエナンチオマーを通過するときに偏光面が回転する旋光性と、酵素反応における基質特異性です。
基質と酵素は「鍵と鍵穴」の関係に例えられます。エナンチオマーの一方は鍵穴にヒットする鍵になる正しい空間配置を持っているので反応しますが、他方は反応しません。酵素が触媒となり支配している生体反応においては、一方のエナンチオマーのみが有益となりますので、目的のエナンチオマーのみを選択的に得る不斉合成が重要です。
キラル化合物の一般的な合成法
医薬品等の開発では、生理活性を持つキラル化合物を効率的に得るプロセスが必要不可欠になります。キラル化合物の合成方法には、キラルビルディングブロックの活用、光学分割、不斉合成などがあります。
キラルビルディングブロックは、目的の官能基を有する単純で入手可能なキラル化合物であり、これを基質とすれば多様なキラル化合物を合成できます。
光学分割とは、ラセミ体からエナンチオ選択的に片方を分離する手法です。結晶法、HPLC光学分割法、速度論法などがあります。4) しかし、ラセミ体は1対の鏡像異性体が1:1の割合で混在する等量混合物であるため、最高収率は50%となります。
そして、目覚ましい発展を遂げたのが、キラルではない基質から目的のキラル化合物を選択的に合成する不斉合成です。代表的な例は、2001年にノーベル化学賞を受賞した野依良治氏によるBINAP触媒を用いた選択的なキラル化合物の合成です。3) この不斉合成と光学分割を使い分けることによって、純度の高いエナンチオマーが得られます。
不斉反応の種類
- 金属触媒による不斉反応
それ自身は変化せず、反応を促進する物質を触媒と呼びます。触媒に求められる条件は活性が高いこと、高い選択性を持つこと、また寿命が長いことです。これらの要件を満たすのが、金属錯体を不斉触媒として利用する方法でした。野依良治氏によるBINAP触媒は、ルテニウムイオンとの金属錯体であるBINAP-Ru (II)であり、ケトンやオレフィンの不斉水素化反応によってキラル化合物を得ることができます。特に遷移金属は、複数の酸化数を取り、他の原子と配位できる性質を持っているため、酸化的付加、還元的脱離、トランスメタレーションなどを含む触媒サイクルが成り立ちます。5) 不斉金属触媒の発達により、様々な医薬品が99%に近い光学純度で工業的に生産可能となりました。高い活性と選択性を有する不斉金属触媒ですが、金属が高価であるということや、環境負荷が高いという側面もあります。SDGsなど環境保護に対する世界全体の風向きも相まって、環境に優しい触媒が求められるようになってきました。 - 有機分子触媒による不斉反応
金属触媒と同様に不斉合成を達成するという観点で注目されているのが、安価で環境にも優しい有機分子触媒(organocatalyst)です。この有機分子触媒は、2000年にベンジャミン・リスト氏およびデヴィット・マクミラン氏それぞれによりその実用性が示されました。両氏はその功績により2021年のノーベル化学賞を受賞しています。
まずリスト氏は、人の生体を構成するアミノ酸の一つであるプロリンが不斉触媒として働くことを発見しました。リスト氏は、アルドラーゼという酵素によるアセトンとアルデヒドの直接的不斉アルドール反応において、クラスIアルドラーゼとクラスIIアルドラーゼの二種類の酵素のメカニズムの違いに注目しました。同じ不斉アルドール反応を促しながらも、クラスIIアルドラーゼが亜鉛イオンを補酵素とするのに対し、クラスIアルドラーゼはエナミン中間体を経由します。後者のクラスIIアルドラーゼによる反応については当時も詳しく説明されていましたが、前者についてはまだ発表されていませんでした。そこでリスト氏は、クラスIアルドラーゼによる直接的不斉アルドール反応について実験を重ね、酵素を構成するアミノ酸の一つであるプロリンのみでも、一定条件のもとで同様に反応が進むことを発見しました。さらに基質としてアセトンと4-ニトロベンズアルデヒドを用い、プロリン以外のアミノ酸や各種プロリン誘導体を触媒としましたが、興味深いことに、収率、光学純度共にプロリンを上回る誘導体はありませんでした。一例をあげると、イソブチルアルデヒドを基質とした場合、収率97%、96% eeという結果が示されています(Scheme 1)。6)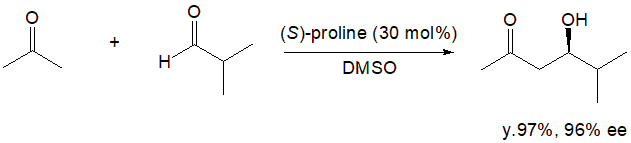
Scheme 1 prolineを触媒とする不斉アルドール反応の例
次にマクミラン氏の研究についてです。マクミラン氏はキラルアミンを有機分子触媒としたディールス・アルダー反応について研究しました。マクミラン氏は触媒が電子を失っている状態と電子を受け取っている状態の間で平衡状態が存在し、これにより基質の変換を可能とする LUMO activationに着目しました。そして、ルイス酸を触媒としたLUMO activationを応用して、キラルアミンを触媒としても同様の反応が起こると仮定して実験しました。基質にシンナムアルデヒドとシクロペンタジエンを用い、生成される生成物の収率と光学純度から様々なキラル二級アミンの不斉触媒能を調べたところ、イミダゾリジノン型の不斉有機分子触媒が高い収率と光学純度を示しました(Scheme 2)。7) 触媒だけではなく、基質の種類や置換基の違いによる立体的配置が収率と光学収率に影響を与える要素として重要と述べています。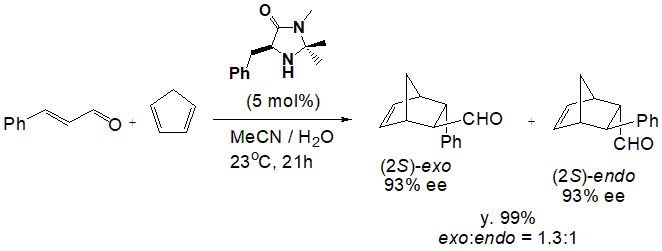
Scheme 2 イミダゾリジノン型有機触媒による不斉Diels-Aldar反応の例
両氏の研究が発表されて以降、有機分子触媒の機能を最大化する研究が進んでいます。天然に存在する分子を基盤とした有機分子触媒は、原料が安価というメリットがある一方で部分的にしか構造を改変できないデメリットもあるため、有機分子触媒を設計して目的の化合物を高収率かつエナンチオ選択的に得る不斉合成の達成が大きな流れとなっています。例えば、大松亨介氏は1,2,3-トリアゾールの特徴に着目し、キラル1,2,3-トリアゾリウム触媒を設計・開発しています。2) この触媒は2つの連続する不斉四級炭素を一挙に作るといった複雑な不斉反応も可能になるといいます。
今後の展開
クリーンな触媒というメリットがあり急速に発展している有機分子触媒ですが、一方で金属触媒の高活性や高選択性を活用したほうが有効なケースも多く、更なる開発が期待されています。将来展望として、触媒自身の合成の難しさの克服、そしてキラル化合物を安定して生産する触媒効率の向上、および触媒のリサイクル性の改善が求められます。Shao-Hua Xiang氏とBin Tan氏によると、キラルブレンステッド酸とキラルルイス酸をさらに追及していけば、水素結合への触媒作用を増強させることができる可能性があること、新たな合成アプローチとして、有機分子触媒を光触媒などの別の触媒と組み合わるという試みが紹介されています。8) このような課題を念頭に、金属触媒と並行しながら、より有用な有機分子触媒の開発が進められていくといえそうです。
参考文献
- Virágos M.: Organic chemistry for premedical student, 265-284 (2009).
- 大松亨介(2016). 有機分子触媒:分子の形が変われば機能が変わる.
化学と教育, 64, 492-495.https://www.jstage.jst.go.jp/article/kakyoshi/64/10/64_492/_pdf - 野依良治(1992). 触媒的不斉合成. 有機合成化学, 50, 1131-1139.
https://www.jstage.jst.go.jp/article/yukigoseikyokaishi1943/50/12/50_12_1131/_pdf - 五月女宜裕(2015). 光学分割-ラセミ体からエナンチオマーを分離する-. 化学と教育,63, 402-405.
https://www.jstage.jst.go.jp/article/kakyoshi/63/8/63_KJ00010095917/_pdf - 朝倉清高(2019).触媒の基礎知識3-金属錯体触媒-.イプロス, 1-10.
https://www.ipros.jp/technote/basic-catalyst3/ - List, B., Lerner, A. R., Barbas III, C. F.: J. Am. Chem. Soc.,122, 2395 (2000).
DOI: 10.1021/ja994280y - Ahrendt, K. A., Borths C. J., MacMillan D. W. C.: J. Am. Chem. Soc., 122, 4243-4244 (2000).
DOI: 10.1021/ja000092s - Xiang, S.-H., Tan, B.: Nat. Commun, 11, 3786 (2020).
DOI:10.1038/s41467-020-17580-z



