リアルタイムPCR試薬
学術コンテンツ
リアルタイムPCR (定量PCR, quantitative PCR/qPCR)とは?
リアルタイムPCRは、ポリメラーゼ連鎖反応 (PCR)を用いて、サンプルの中にある特定配列のDNA量を調べる方法です。この方法を用いれば、目的遺伝子の発現量やサンプル中のウイルス遺伝子の含有量などを調べることができます。一般的なqPCR法ではリアルタイムで測定が行われるため、「qPCR」と「リアルタイムPCR」は同義として扱われます。よく用いられるのは、サイバー・グリーン法(SYBR® Green※1)とタックマン・プローブ法(TaqMan® Probe※2)の2種類です。
通常のPCRでは、増幅反応後のDNAサンプルを遺伝子組換えに利用したり、定量に用いたりするため、反応後の生成物のみが興味の対象となるのに対し、リアルタイムPCRではDNAの増幅過程が重要となるため、「リアルタイムPCR」と呼ばれます。qPCRには、増幅後のDNAサンプルを電気泳動で分離して定量する、というリアルタイム測定ではない方法もあります。
(ちなみに、バイオ分野でよく目にする "RT-PCR" という手法は、多くの場合、リアルタイムPCR(real time PCR)でなく、逆転写PCR(reverse transcription PCR)のことを指すので注意。)
- 1 SYBR® は、Molecular Probes Inc.の登録商標です。
- 2 TaqMan® は、Roche Diagnostics K.K.の登録商標です。
SYBR® Green法(インターカレーション法)
インターカレーション法では、二本鎖DNAの間に挿入 (インターカレーション)する蛍光分子を用いてDNA増幅量を調べます。SYBR® Greenという蛍光分子がよく用いられています。
以下に、SYBR® Green法の流れを示します。
- PCRの反応溶液に、二本鎖DNAに挿入して発光する蛍光分子を混ぜておく。
- PCRによってDNAの増幅が起こると、合成されたDNAの間に蛍光分子が挿入し、発光が起こる。
- 溶液の発光をモニタリングすることで、DNAの増幅量を調べることができる。
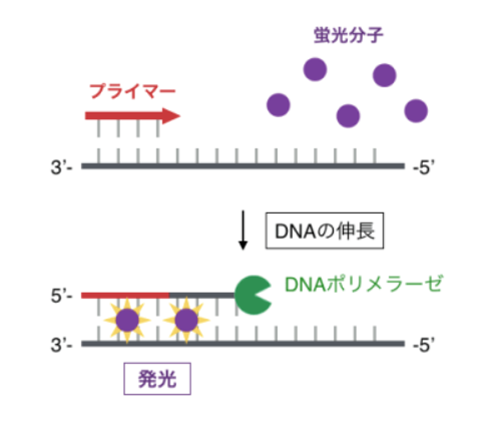
この手法では、目的以外のDNAが非特異的に増幅された場合でも、蛍光分子が発光してしまうという欠点があります。
以下に紹介するTaqMan® プローブ法では、目的のDNAに特異的に発光が起こるという利点があります。
TaqMan® Probe法(加水分解プローブ法)
TaqMan® Probe法では、FRET (蛍光共鳴エネルギー移動)を利用してDNA増幅の測定を行います。重要なのは、TaqMan® プローブとTaq DNAポリメラーゼの2つの要素です。
TaqMan® プローブ:
FRETを起こす蛍光分子ペアを結合した短い一本鎖DNA。定量したい遺伝子に結合するように、一本鎖DNAの配列は、目的遺伝子との相補的配列としてデザインします。TaqMan® プローブが加水分解されると、蛍光分子ペアが離れてバラバラになるため、FRETが起こらなくなる。つまり、クエンチされていた蛍光分子が発光できるようになります。
Taq DNAポリメラーゼ:
DNAを合成するためのポリメラーゼ活性に加え、DNAを5'→3'の方向へと加水分解する機能(5'→3'エキソヌクレアーゼ活性)を持ちます。この機能により、DNA増幅の際にTaqMan® プローブを分解することができます。

以下に、TaqMan® プローブ法の流れを示す。
- PCRの反応溶液に、TaqMan® プローブを加えて増幅を行う。DNAポリメラーゼは、通常のものではなくTaq DNAポリメラーゼを用いる。
- TaqMan® プローブが、鋳型DNAに結合する。
- Taq DNAポリメラーゼがDNAを伸長する際に、TaqMan® プローブを分解する。
- FRET蛍光分子ペアが互いに解離し、クエンチされていた蛍光分子が発光するようになる。
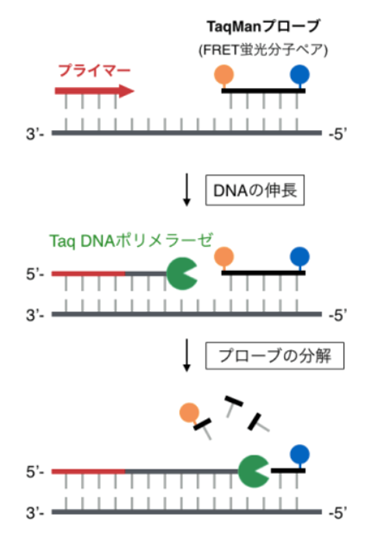
TaqMan® プローブ法は、前述のSYBR® Green法と異なり、目的遺伝子と特異的に結合するプローブを用いるため、より信頼性が高いデータが得られます。
リアルタイムPCRのデータ分析
リアルタイムPCRのデータは、以下のようなDNAの増幅曲線 (=蛍光強度)として得られます。段階希釈した既知量のDNAを標準サンプルとして用いることで、未知サンプルの定量ができます。
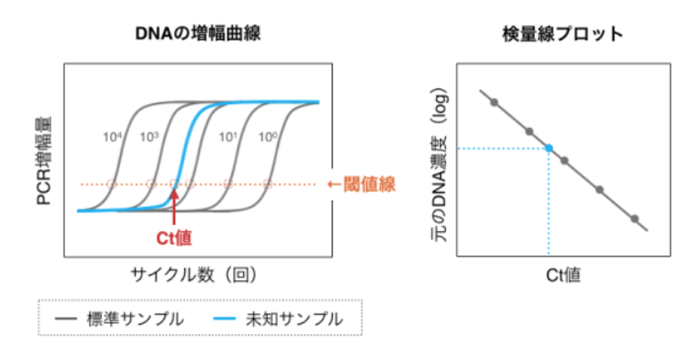
まず、増幅曲線において、一定の増幅量 (閾値)に達するまでにかかったサイクル数(threshold cycle/Ct値)を調べます。このCt値を横軸に、標準サンプルの元の濃度を縦軸に、検量線プロットを作成します。得られた検量線と未知サンプルのCt値を照らし合わせることで、未知サンプルの濃度を調べることができます。
本記事はWEBに混在する化学情報をまとめ、それを整理、提供する化学ポータルサイト Chem-Stationの協力のもと、ご提供しております。




