タンパク質質量分析試薬
質量分析 (MS) は、様々なタンパク質や代謝産物などの分析に広く使用されています。
当社では、質量分析用のタンパク質消化酵素、代謝・プロテオミクス研究向けに安定同位体標識したアミノ酸およびアミノ酸誘導体、MALDI-MS用キャリブラントなどをラインアップしています。
特に、リシン残基のカルボキシル基側のペプチド結合(Lys-X)を特異的に切断する「Lysyl Endopeptidase」は累計2,500以上の論文で使用されています。
製品ラインアップ
学術コンテンツ
質量分析の用途
質量分析 (MS) は分析対象物質(固体、液体、気体)中の構成成分(化合物や原子)を様々なイオン化法によってイオン化し、生成したイオンの質量(分子量や原子量)およびイオン量を測定することにより、分析対象物質中にどのような成分がどの程度含まれているかを把握する分析法です。分析対象も広く、無機物質から低・中質量有機物質、さらには、核酸、糖、ペプチドやタンパク質などの生体高分子まで分析が可能です。用途範囲も多種多様であり、化学や生化学、医科学などの研究分野から、食品分析、医薬品分析、生体試料分析、材料分析、環境分析など、幅広い分野で利用されています。このような質量分析の特性を踏まえ、近年盛んに研究が行われていますオミクス分野にも質量分析は威力を発揮しており、網羅的なタンパク質分析であるプロテオミクス、網羅的な代謝物分析であるメタボロミクス、その中でも脂質を中心に分析するリピドミクスなど、今や質量分析はオミクスには欠かせない分析手法となっています。
質量分析の原理
質量分析技術は大きく 3 つの構成要素から成り立っています。まず第 1 は分析対象物質をイオン化する部分です。現在までに、主に低分子量化合物や揮発性物質を分析対象とした EI、CI 法、難揮発性物質や生体高分子化合物などを主対象としたESI、APCI、MALDI 法など様々なイオン化法が開発されています。第 2 は生成したイオンを質量で分離する(厳密には質量電荷比で分離する)質量分離部です。ここで利用される分離方法としては、四重極を用いた分離、Time-of-Flightを用いた分離、イオンサイクロトロン共鳴を用いた分離など、分解能や感度などのニーズに応じて選択できるようになっています。第 3 は分離されたイオンを検出する部分です。また、質量分析法は他の分析法を連結したハイフネーテッド技術とも相性がよく、GC や LC、ICP などの分析手法と組み合わせ、お互いの分析能力の相乗効果も得られる分析法です。
分析対象物質の前処理技術
このように、質量分析では測定物質の質量で検出を行うため、予め分析対象物質に様々な前処理技術を施すことによって、測定対象物質の質量分離を容易にし、検出効果を高めることが可能です。また、タンパク質などの高分子化合物はそのままの形で測定を行いますと検出感度が低下する場合や、多価イオンが生成し質量スペクトルの解析が複雑になるといった問題が起こります。この問題を解決する方法として、予め酵素を用いてタンパク質をペプチド断片に分解させ、得られたペプチド混合物の質量分析結果とタンパク質(ペプチド)データベースを照合することにより、タンパク質の同定を高効率に実施するという手法がとられています。以下に質量分析測定対象物質に予め実施される前処理技術のいくつかを紹介します。
1. 消化酵素によるタンパク質の消化
上述のように、分析対象物質がタンパク質の場合、質量分析に供する前に測定タンパク質に適した消化酵素によってタンパク質を消化し、得られたペプチドを検体として質量分析を行います。その際に、測定対象タンパク質の消化効率が低い場合は得られたペプチド種や量も少ないことから、良好な質量スペクトルを得ることができません。通常、タンパク質を測定対象とする質量分析に使用される酵素としてトリプシンが挙げられます。トリプシンはタンパク質の切断部位を特異的かつ効率的に切断することから、第一選択酵素となっていますが、それでもタンパク質種によっては切断が不十分であることがあります。そこで、トリプシンと同様にタンパク質の切断部位を特異的かつ効率的に切断することが可能なリシルエンドペプチダーゼをトリプシンと併用することにより、トリプシン単独で使用するよりもリシン残基における切断の確実性が増し、得られるペプチド数が増加するため、ペプチドの種および量共に良好な検出結果を得ることができます。そして、良好な質量分析結果は、タンパク質(ペプチド)データベース検索も容易となり、その結果確度の高いタンパク質同定が可能となります。
2. 安定同位体標識化合物を併用した定量解析
安定同位体標識低分子化合物とそれらの非標識低分子化合物を予め混合し、この混合物を質量分析に供することによって、両者の質量に標識体分の質量差異が生じるため、各々の化合物の質量分析検出量比から測定対象化合物の定量解析が可能となります。また、濃度既知の安定同位体標識低分子化合物を分析対象非標識低分子化合物と予め混合し、この混合物を検体とした LC/MS を実施した場合、両者から得られるイオンは LC/MS ではほぼ同時刻に溶出・検出されるため、両イオンにおいて測定条件(環境)が同一となり、その結果測定環境に左右されることのない定量性の高い相対定量、絶対定量解析が可能となります。この手法は複数の測定対象化合物が混合した検体に適したSRM (MRM) 法による定量解析にも有用です。
3. SILAC 法
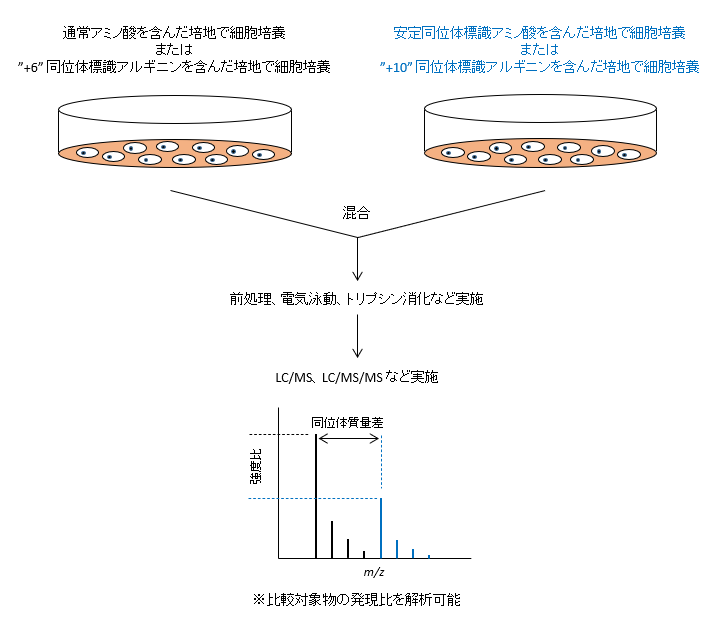
- SILAC (Stable Isotope Labeling by Amino Acids in Cell Culture) 法1) は、タンパク質の定量を行う際の前処理実験として用いられる方法です。比較する片方の系の細胞培養培地中のみに安定同位体(13C や 15N など)で標識されたアミノ酸を用い、他方には非標識のアミノ酸(通常のアミノ酸)を用います。そして、一定期間培養後、両培地からタンパク質を抽出し混合します。そして、酵素消化後のペプチドを質量分析で測定し、タンパク質の同定と両者の発現量の比較定量を行います。この手法により、様々な培養条件下での細胞内のタンパク質発現量の比較研究が可能となり、何千種類ものタンパク質の網羅的な定量解析が可能となりました。また、Imami らは、比較対象の両培地共に通常アミノ酸を混入させ、さらに両培地それぞれに質量の異なる安定同位体標識アルギニン(アルギニン"+6" とアルギニン"+10")を混入する手法を報告しています2)。
質量分析における質量校正
このように、質量分析では様々な物質の質量を測定することにより、その物質の同定および存在量を解析することができますが、信頼のあるデータを取得するためには、検出データの質量が正確であることが担保されていなければなりません。そのため、質量分析を実施する際には質量が既知であるキャリブラントと呼ばれる標準化合物を用いて、測定前に予め質量分析装置の質量校正(マスキャリブレーション)を行う必要があります。
おわりに
本稿では、質量分析を用いた生体試料の分析、及び質量校正の必要性について説明してきました。低分子化合物から近年ではタンパク質などの高分子化合物まで、質量分析の分析対象は飛躍的に拡がっており、質量分析の果たす役割は非常に大きなものとなっています。今後も定性分析、定量分析の両面においてますますの発展が期待されます。
参考文献
1) Ong, S.-E. et al.: Mol. Cell. Proteomics, 1(5), 376 (2002).
2) Imami, K. et al.,: Mol. Biosyst., 6(3), 594 (2010).