LAMP法用DNA増幅試薬/検出機器
耐熱性鎖置換型DNA Polymeraseを用いた遺伝子増幅法(Loop-mediated Isothermal Amplification:LAMP法)はPCRとは全く異なる遺伝子増幅技術の1つです。サーマルサイクラーのような専用な機器を必要とせず、ヒートブロックや恒温槽を用いてDNAの増幅を行うことができます。
当社は幅広いラインナップのポリメラーゼをはじめとするLAMP法試薬、検出機器を安価な価格設定で提供しています。価格一覧は製品ラインナップページをご覧ください。
学術コンテンツ
DNA増幅法について

DNA増幅法ではPCR法が最もよく使用されています。PCRは標的とするDNAが存在するかどうかを調べる場合や、2n倍にDNAが増幅する特長を利用して、標的DNAの存在量を調べる場合に用いられます。一方で、正確な温度の上げ下げをするため、特別な装置(サーマルサイクラー)が必要となることや、GC含有量が多い配列の場合、DNAの二次構造による合成阻害を受ける可能性があります。
そこで、耐熱性鎖置換型DNA Polymeraseを用いた遺伝子増幅法(Loop-mediated Isothermal Amplification、LAMP法*)が開発されました。
LAMP法とPCR法の比較
| LAMP法 | PCR法 | |
|---|---|---|
| 温度 | 一定(60~65℃) | 高温(95℃)での熱変性が必要 |
| 時間 | 15 min ~ 60 min | 2 ~ 3 hour |
| 産物量 | 1010倍 | 107倍 |
| 特異性 | 極めて高い 6領域 4プライマー |
高い 2領域 2プライマー |
| 検出 | 増幅副産物の有無 | 検出工程が別途必要 |
LAMP法について
LAMP法は、目的のDNA配列の有無を濁度、蛍光、発色や色調変化によって判別可能です。DNA増幅を等温で行えることや、電気泳動などの分析を必要とせず、目視によって確認も可能であることから、研究室外や発展途上国での遺伝子の検査への応用が期待されています。
原理
LAMP法では、目的のDNA配列の両側に6つの領域(F側、B側に3か所ずつ)を設定し、4種類のプライマー(F3、FIP、B3、BIP)を使用します。耐熱性鎖置換型DNA Polymeraseによって、目的配列の両端にループ状の構造を形成し、目的配列を連結することで、この繰り返し構造を短時間で大量に増やすことができます。
また、耐熱性鎖置換型DNA Polymeraseは酵素自身が二本鎖DNAの水素結合を解離しつつ、新しいDNA鎖を合成するため、一定の温度で核酸の増幅が進行します。
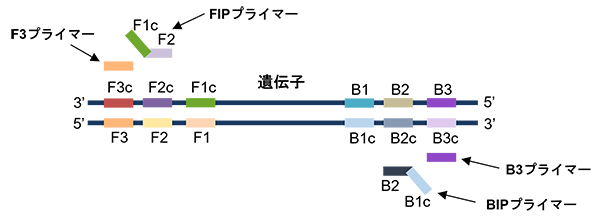
(M. Soroka, B. Wasowicz, A. Rymaszewska(2021)を参考に改変)
増幅のメカニズム

上述の耐熱性鎖置換型DNA Polymeraseを含む反応試薬、プライマー、およびDNAサンプルを60℃から65℃の一定温度で反応させると、以下の流れで増幅反応が進行します。
60℃から65℃の温度条件下では、二本鎖DNAは動的な状態となり、一本鎖DNA領域が生じます。その一本鎖領域にプライマーがアニーリングし、伸長することで二本鎖DNAを解離させ、一本鎖DNAにすることができます。まず、この一本鎖からLAMP法の増幅サイクルにおける起点となる構造が形成されます【1)~4)】。
- 一本鎖DNAにFIPプライマーがアニーリングし、鋳型DNAと相補的なDNA配列を合成する。
- FIPプライマーの外側に設計したF3プライマーが、1)で合成したDNAにアニーリングし、二本鎖DNAを剥がしながら増幅する。この時解離した一本鎖DNAは、5’末端側に相補的な2つの領域(F1c、F1)を持っており、自己アニーリングすることによりループ構造を形成する。
- 5’末端側にループ構造を形成した一本鎖DNAの3’末端側に、BIPプライマーがアニーリングし、DNA合成が行われる。
- BIPプライマーの外側に設計したB3プライマーが、3)で合成したDNAにアニーリングし、二本鎖DNAを剥がしながら増幅する。この時解離した一本鎖DNAは、5’末端および3’末端にそれぞれF1c、F1およびB1c、B1を持つため、両端が自己アニーリングしてループ構造を形成する。
この構造がLAMP法の増幅サイクルにおける起点となる。

(M. Soroka, B. Wasowicz, A. Rymaszewska(2021)を参考に改変)
起点構造が形成された後の反応は以下のようになります。
両端に相補的な配列を持つことで、同一鎖上で互いに相補的なDNAが合成され、増幅効率を高めることができます。
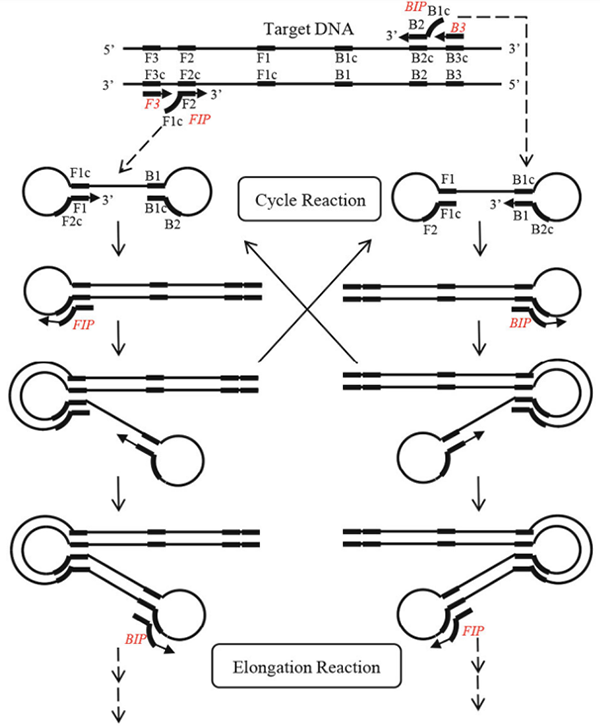
(T. Notomi, Y. Mori, N. Tomita, H. Kanda(2015)より転載)
特長
・特異性が高い
6つの遺伝子領域および4つのプライマーが必要であるため、PCRと比較して特異性に優れています。増幅の有無によって、標的遺伝子が存在したかどうかの判定ができます。
・増幅効率が高い
熱変性(二本鎖DNAの解離)を必要としないため、DNAの二次構造による合成阻害を受けにくいという特長があります。また、その増幅原理から、1時間以内の検出が可能です。
・簡易検出が可能
増幅産物の量が多いため、二本鎖DNAに結合する蛍光色素の存在下で増幅すると、紫外線ランプ下で目視で増幅産物を確認できます。また、DNA合成の副産物として生じるピロリン酸は、反応液中のマグネシウムイオンと結合することが知られています。増幅反応により大量に生成されたピロリン酸マグネシウムは、溶解度積を超えることにより白濁します。これを増幅の指標として用いることができ、肉眼検出または濁度測定装置やリアルタイムPCRによる検出が可能です。
当社ではニッポンジーンのLAMP法用核酸増幅試薬LAMP MASTERシリーズを取り扱っております。
基本手順
1. 装置、試薬の準備
装置
現在流通している検出機器は主に2種類です。
濁度測定装置:ピロリン酸マグネシウムの濁度を測定する
蛍光検出装置:二本鎖DNAに結合する蛍光分子を測定する
当社では、蛍光を検出するGENEMALを取り扱っています。
試薬
基本的な試薬は以下になります。
- 耐熱性鎖置換型DNAポリメラーゼ
- dNTPs
- 反応バッファー
- プライマー4種
ただし、現在は上記の反応試薬を含むキットや、プライマーがセットとなっているキットも販売されています。
当社では、耐熱性鎖置換型 DNA ポリメラーゼ、 Mg2+、dNTPs、至適化されたバッファーなどを含む核酸増幅試薬2 x LAMP MASTERを取り扱っています。
2. プライマーの準備
LAMP法プライマーは、配列特異的に設計されたプライマーセットを使用する場合と、カスタマイズする場合があります。

プライマー設計は以下のように行います。
- 標的遺伝子の上流にB1、B2、B3、下流にF1c、F2c、F3cの6つの領域を規定する
- 6つの領域に対して、FIP、F3、BIP、B3の4つのプライマーを設計する
FIP(Forward Inner Primer):5’末端側にF1c領域と同じ配列、3’末端側にF2c領域と相補的な配列(F2)を含むように設計する
F3:F3c領域と相補的な配列を含むように設計する
BIP(Backward Inner Primer):5’末端側にB1c領域と同じ配列、3’末端側にB2c領域と相補的な配列(B2)を含むように設計する
B3:B3c領域と相補的な配列を含むように設計する
当社では、ニッポンジーン独自のパラメータでプライマーの設計と合成を行う、LAMPプライマー設計&合成サービスを提供しています。
3. LAMP反応の実施、検出
DNA増幅の検出方法としては、濁度検出、蛍光検出、目視判別が可能です。
濁度検出:増幅反応により生成されたピロリン酸マグネシウムの濁度を測定
蛍光検出:DNAに蛍光色素をインターカレートさせ、リアルタイムPCR装置等の蛍光検出装置により検出
目視判別:蛍光目視試薬を添加することで、DNA増幅を目視で判別
当社では、検出方法に合わせてLAMP MASTER for Turbidity、LAMP MASTER for Fluorescence、LAMP MASTER for Turbidity(Visible Dye)を取り扱っています。
濁度検出用:LAMP MASTER for Turbidity
蛍光検出用:LAMP MASTER for Fluorescence
目視判別:LAMP MASTER for Turbidity(Visible Dye)
LAMP法に使用できる酵素について
当社では、LAMP法に使用可能なニッポンジーンの耐熱性鎖置換型DNA Polymeraseを3種類ラインアップしています。その中で、Bst DNA PolymeraseはLAMP法で最もよく使われている酵素です。また、反応温度と失活温度が異なるCsa DNA Polymerase、96-7 DNA Polymeraseを販売しており、実験系に最適な酵素をご選択頂けます。さらに、ニッポンジーン独自のパラメータでプライマーの設計と合成を行う、LAMPプライマー設計&合成サービスを提供しています。
表 3種類の鎖置換型酵素の比較
| 酵素名 | Bst DNA Polymerase | Csa DNA Polymerase | 96-7 DNA Polymerase |
|---|---|---|---|
| 反応温度 | 60~65℃ | 60~70℃ | 50~55℃ |
| 失活温度 | 80℃ 5分 | 85℃ 5分 | 70℃ 5分 |
| 備考 | LAMP法で最もよく使用されている | ニッポンジーン独自の酵素 | ニッポンジーン独自の酵素 |
参考文献
- T.Notomi, H.Okayama, H.Masubuchi, T.Yonekawa, K.Watanabe, N.Amino, T.Hase: Nucleic Acids Res., 28, e63(2000).
* LAMP(Loop-mediated Isothermal Amplification)法は栄研化学株式会社が特許を保有しています。 - M. Soroka, B. Wasowicz, A. Rymaszewska: Cells, 10(2021)
- T. Notomi, Y. Mori, N. Tomita, H. Kanda: Journal of Microbiology, 53, 1–5 (2015)
- 牛久保 宏: ウイルス 54(1), 107-112(2004)
- Eiken GENOME SITE, よくわかるLAMP法




