【テクニカルレポート】次世代の発熱性物質試験用試薬 ~LumiMAT™の開発~
本記事は、和光純薬時報 Vol.92 No.4(2024年10月号)において、富士フイルム和光純薬株式会社 バイオ技術センター 七尾 友久様に執筆いただいたものです。
1.発熱性物質試験について
発熱性物質試験は非経口医薬品や医療器具中の発熱性物質の有無を検定する試験である。発熱性物質(細菌の膜成分、ウイルスDNA・RNA等)が血中に取り込まれると、それらを認識した単球やマクロファージによって免疫応答が起こる。その結果体温の上昇やショック症状・多臓器不全が惹起され、最悪の場合死に至ることが知られている1)。そのため世界各国の薬局方には発熱性物質試験法が収載されており、非経口医薬品・医療器具の製造時には安全性評価や品質管理のために収載法に基づいた試験を実施することが求められている。
2.試験法とその変遷
発熱性物質試験の方法の一つとして、ウサギに検体を静脈注射し体温上昇の有無を検査する、ウサギ発熱性物質試験(RPT:Rabbit Pyrogen Test)が古くから用いられている2)。しかし、RPTは感度が低く、かつウサギの個体差の影響による試験再現性にも課題があることが知られている。一方で、カブトガニの血液凝固系のリムルス反応によるライセート試薬(LAL試薬:Limulus amebocyte lysate)がRPTと反応性に相関があることが報告されて以来、現在は多くの製剤や医療器具にLAL試薬を用いた方法が採用されている3)。ただし、LAL試薬は発熱性物質の中でもエンドトキシン(グラム陰性菌の膜成分)しか検出することができない。
近年、医薬品のモダリティが多様化(遺伝子治療、RNAワクチン、細胞治療等)し、エンドトキシンだけでなく様々な発熱性物質に対する管理の必要性が注目されているが、RPTには前述のような課題があることが広く認知され、さらに動物愛護の観点から、2026年までに欧州薬局方から削除されることが決定しているため4)、RPTに代わる代替法の開発が進められている。尚、欧州薬局方にはRPTの代替法として単球活性化試験 (MAT:Monocyte Activation Test)が収載されており、欧州の製薬企業や発熱性物質試験を受託するCROを中心にRPTからの移行準備が活発に進められている5)。
3.MATについて
MATは、ヒト全血、末梢血単核細胞(PBMC:Peripheral Blood Mononuclear Cells)もしくは単球系細胞株を用いて、エンドトキシンだけでなく細胞の免疫応答を惹起する発熱性物質を検出するin-vitro試験法である6)。
発熱性物質が細胞に発現するToll様受容体(TLR:Toll-like receptor)によって認識されると、細胞内シグナル伝達経路を経て情報伝達物質であるサイトカインが細胞から放出される(図1)。現在販売されている多くのMAT試薬は、この細胞から培養液中に放出されるサイトカインであるインターロイキン(IL)-6をELISA法によって定量するシステムを採用している。MATはRPTと比較して高感度に発熱性物質を検出することができ、試験期間や費用についても改善しているが、依然として既存のMAT試薬にも改良の余地が残っている。例えば、ELISA法による検出可能なサイトカイン量を放出させるには検体処理後の細胞を長時間培養(~24時間)する必要がある。また、その後のELISA法においても煩雑かつ数時間に及ぶ作業が求められ、手技の習熟度の差に起因する作業者間差が結果に生じるケースがある。また、細胞は主にPBMCが用いられており、ヒト末梢血から直接分離して調達するため、供給安定性、ドナー個体差に基づく反応性のLot差、及びドナー情報等の倫理面について課題があることが指摘されている。
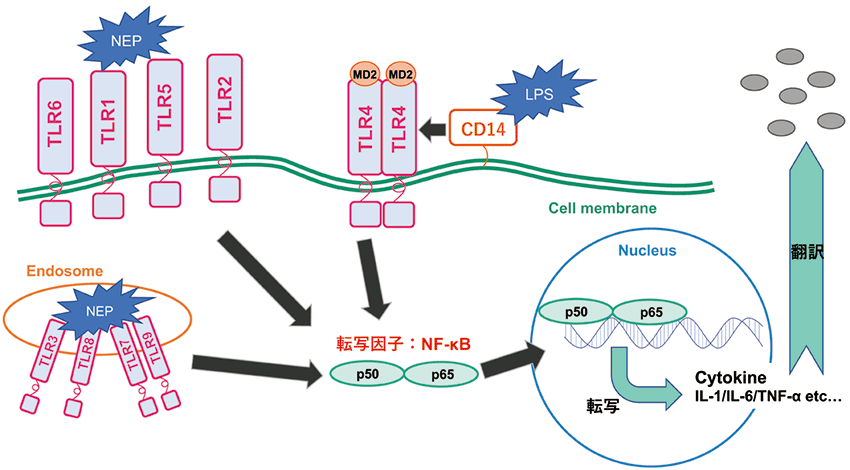
図1. 発熱性物質とTLR シグナル経路について
4.新規MAT試薬の開発
我々は、前述の課題を克服した新規MAT試薬LumiMAT™ Pyrogen Detection Kit(以下、本キット)を開発した。
本キットの最大の特長としては、検出系をELISA法からレポーターアッセイ法に切り替えたことにより、ELISA法における煩雑かつ長時間に及ぶ作業から解放されることが挙げられる。IL-6等の炎症性サイトカインの発現を誘導する転写因子としてNF-κBが広く知られており、発熱性物質によって誘導されるTLRを介するシグナル経路がNF-κBを活性化することが報告7)(図1)されている。そこで、我々はNF-κBの活性化によってルシフェラーゼ発現が誘導されるレポーター遺伝子を導入した安定発現細胞株を作製した。
また本キットには、細胞バンクに登録済みの血球系細胞を中心とした約30の細胞株の中から、様々な発熱性物質への応答能が高く、かつ測定値の試験間差が小さい株をスクリーニングすることにより選定した単球様細胞株:NOMO-1細胞を採用している。株化細胞を用いることで倫理的な課題を解消し、また安定発現細胞株を作製したことにより安定した生産・供給を行うことが可能となった。さらにレポーターアッセイ法は、高感度かつS/N比の高い結果を生み出し、安定発現細胞株化により高いデータ再現性を得ることができた。本キットを用いることにより、"3時間"という非常に短い反応時間で既存のMAT製品と同等以上の感度(検出限界LOD<0.0125 EU/mL)で発熱性物質を検出することが可能となり、さらには、検出工程では基質溶液を添加するのみ(10分未満)という非常に簡便な操作でアッセイが完了するため、作業者の負担及び作業者間差の大きな軽減を実現できた(図2)。
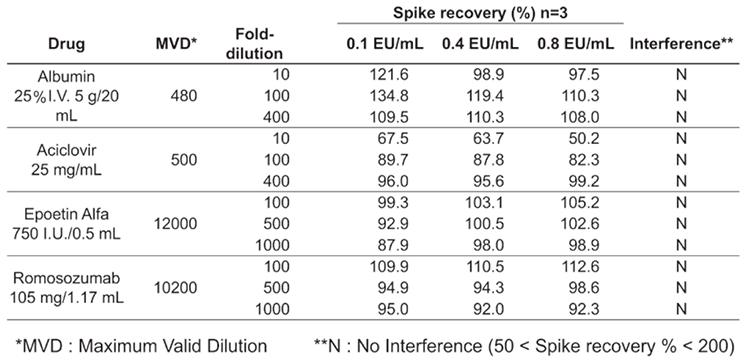
実際に、市販医薬品に対して本キットを用いたMAT試験の結果を表1に示した。試験に用いた4つの医薬品全てにおいて、干渉を起こさず添加したエンドトキシンを測定可能(50%<回収率<200%)である結果が得られている。
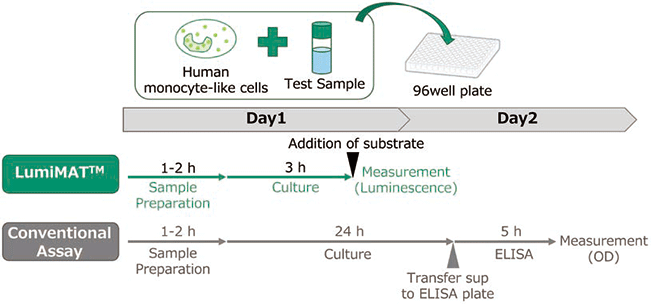
図2. 従来法とLumiMAT の比較
表1.市販医薬品を用いた添加回収試験
5.最後に
新たな創薬モダリティに伴う医薬品製造工程の多様化や、動物実験の代替を推し進める世界的な動きに伴って、多種多様な発熱性物質を検出することができるMAT試薬の需要は今後伸びていくことが予想される。現在直面している課題を克服した本キットの開発によって、医薬品・医療器具品質管理分野の進展に貢献できることを期待したい。
参考文献
- Dinarello, CA. : Agents Actions., 13 (5-6), 470 (1983).
- GRANT, R., HIRSCH, JD. : Am J Physiol., 161 (3), 528 (1950).
- LEVIN, J., BANG, F. B. : Bull Johns Hopkins Hosp., 115, 265 (1964).
- European Directorate for the Quality of Medicines & HealthCare.
https://www.edqm.eu/en/-/european-pharmacopoeia-to-put-an-end-to-the-rabbit-pyrogen-test - Cirefice, G. et al. : Biologicals., 84, 101702 (2023).
- Hoffmann, S. et al. : J Immunol Methods., 298 (1-2), 161 (2005).
- Kawai, T., Akira, S. : Trends Mol Med., 13 (11), 460 (2007).




