核酸合成
学術コンテンツ
核酸医薬とは
核酸は、デオキシリボ核酸(DNA)とリボ核酸(RNA)の総称で、塩基・糖・りん酸がホスホジエステル結合で連なった構造であるオリゴヌクレオチド(図1)を構成分子とします。近年注目される「核酸医薬」は、生物の遺伝情報の実体であるDNA及びRNA分子を医薬品として利用するもので、従来の低分子医薬や抗体医薬では標的にすることができない生体内の分子に対して作用できるため、次世代の医薬品として大いに期待されています1)。「核酸医薬」の主成分であるオリゴヌクレオチドの合成は、自動合成機を用いた有機合成(主に固相合成)で製造できることも特徴です。
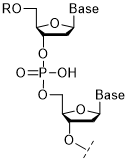
図1.オリゴヌクレオチドの構造
核酸医薬品の種類
核酸医薬品は、生体内のDNAやRNAなどを標的にする医薬品のことで、アンチセンスやsiRNA、アプタマーなどの種類があります。これらの核酸医薬品は標的遺伝子の発現を制御したり、特定のタンパク質の発現を抑制することによって薬効を示します。
表1. 主な核酸医薬品の種類
| アンチセンス | siRNA | アプタマー | デコイ | CpGオリゴ | |
|---|---|---|---|---|---|
| 構造 | 1本鎖 DNA/RNA |
2本鎖 RNA |
1本鎖 DNA/RNA |
2本鎖 DNA |
1本鎖 DNA |
| 塩基長 | 12-30 | 20-25 | 26-45 | 20前後 | 20前後 |
| 標的 | mRNA Pre-mRNA |
mRNA | 細胞外タンパク質 | 転写因子 | タンパク質 |
| 作用機序 | mRNA分解 スプライシング制御 |
mRNA切断 | 機能阻害 | 転写阻害 | 自然免疫の活性化 |
核酸医薬品はこれまでに18種類が承認され、そのうち日本では7種類が承認されています(2023年10月4日時点)。承認された核酸医薬品はこちら(日米欧のいずれかで承認された核酸医薬品)から確認することができます。
(出典:国立医薬品食品衛生研究所 遺伝子医薬部 HP)
核酸合成法
核酸(オリゴヌクレオチド)の古典的な合成法は、ホスホロアミダイト法による固相合成です。この手法は、亜リン酸ジエステルのモノアミド体であるホスホロアミダイトモノマーを固相担体上で付加させる方法です。
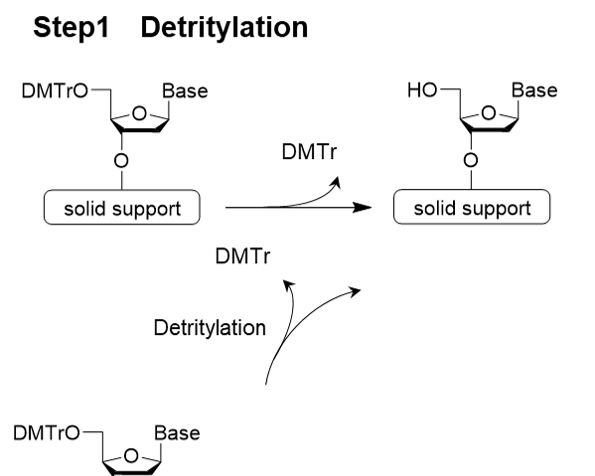
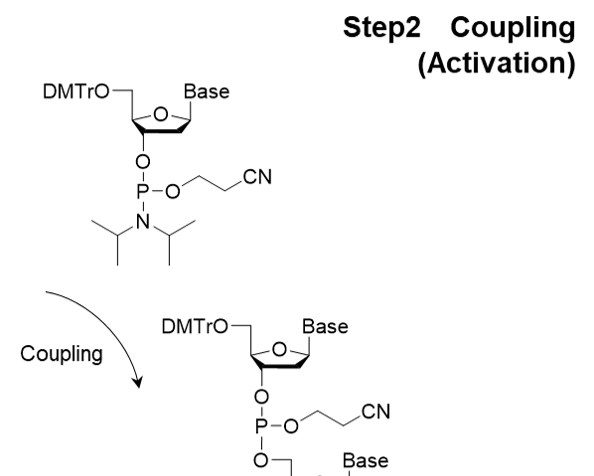
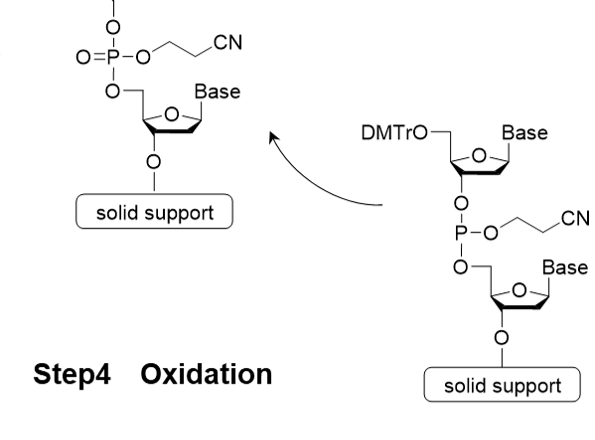
核酸モノマーであるアミダイト体を結合させる基本反応は、Step 1 脱トリチル化(脱保護) → Step 2 アミダイト体のカップリング反応 → Step 3 キャッピング反応 → Step 4 酸化または硫化反応の4ステップからなり、4ステップを 1サイクルとして、目的の鎖長になるまで繰り返します(図2)。この反応は自動合成機により行われます2)。
 |
 |
 |
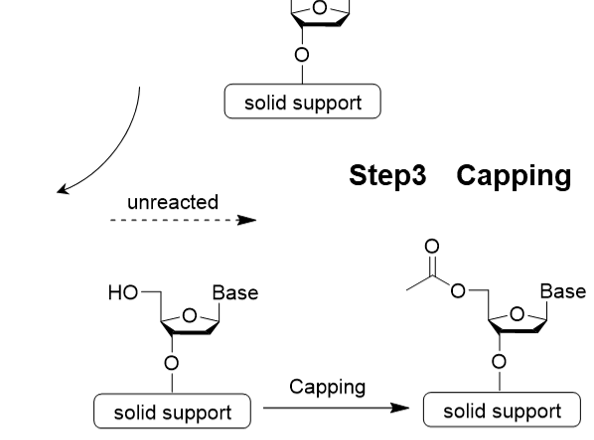 |
図2.ホスホロアミダイト法の反応機構
ホスホロアミダイト法の反応と試薬3)
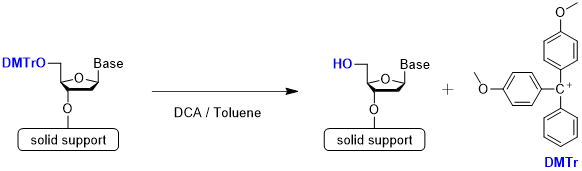
Step 1 脱トリチル化(脱保護)
Step 1は脱トリチル化です。5’位ヒドロキシ基の保護には、多くの場合、4,4’-ジメトキシトリチル基(DMTr 基)が用いられます。2つのメトキシ基によってトリチルカチオンが安定化されているため、弱酸処理によって容易に切断できます。酸にはジクロロ酢酸やトリクロロ酢酸が用いられます。
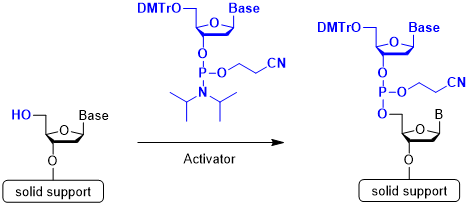
Step 2 カップリング反応 (アクチベーション)
Step 2はカップリング反応です。結合させるヌクレオチドユニットと固相担体上のヌクレオシドまたは合成中のオリゴヌクレオチドとの間で縮合します。ホスホロアミダイトの活性化には、一般的に、5-ベンジルチオ-1H-テトラゾール(BTT)や5-エチルチオ-1H-テトラゾール(ETT)、4,5-ジシアノイミダゾール(DCI)が用いられます。
Step 3 キャッピング反応
Step 3はキャッピング反応です。ホスホロアミダイト法では、カップリング反応が完全に進行せず、未反応のヒドロキシ基が残ったまま次のステップに反応が進むと、目的とするオリゴヌクレオチドから一塩基だけ抜けた不完全長オリゴが生成されてしまうことがあります。そこで、未反応鎖5’-OH基をアセチル化することで伸長反応を防ぎます。
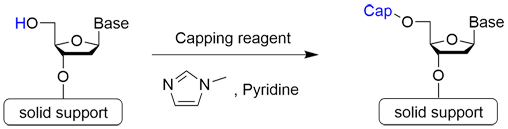
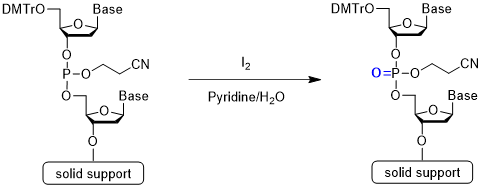
Step 4 酸化反応 / 硫化反応
Step 4は酸化反応または硫化反応です。ホスホロアミダイト法によるカップリングでは、亜リン酸エステル結合が生成されます。これは安定性がやや低く、さらなる伸長反応の際に副反応を起こす危険があります。これを防ぐため、安定なリン酸エステルまたはチオリン酸エステルに変換します。酸化剤にはヨウ素(I2)が、硫化剤には((ジメチルアミノメチリデン)アミノ)-3H-1, 2, 4-ジチアゾリン-3-チオン(DDTT)最もよく用いられます。
参考文献
- 「2016 年版 世界の核酸医薬品開発の現状と将来展望」(株式会社シード・プランニング) (2016).
- 和田猛監修:核酸医薬の創製と応用展開 (株式会社シーエムシー出版) (2016).
- 「バイオテクノロジー試薬」(株式会社化学工業日報社) (1989).
製品ラインアップ
-
溶媒
-
各種核酸合成試薬(固相/液相合成)
-
-
- Spacer修飾用試薬 (CPG担体、アミダイト)
- DNAアミダイト
- RNAアミダイト (2'-O-TBDMS)
- RNAアミダイト (2'-O-TOM)
- 修飾核酸 4'-チオホスホロアミダイト
- 修飾核酸 (2'-OMe) アミダイト
- 修飾核酸 (2'-MOE) アミダイト
- 修飾核酸 (2'-F) アミダイト
- 修飾核酸(シュードウリジン)アミダイト
- 架橋型核酸アミダイト
- Xeno Nucleic Acids (XNA) アミダイト
- 安定同位体標識 アミダイト
- Hongene Biotech社 核酸関連試薬 (アミダイト、mRNA合成用酵素)
- GalNAc修飾用試薬 (CPG担体、アミダイト)
- 取扱いメーカー
-
-
核酸合成用前処理試薬
-
核酸合成用後工程試薬
-
受託サービス










