エクソソームフローサイトメトリーキット
エクソソームのサイズは30 - 100 nmと非常に小さく、通常のフローサイトメトリー解析は困難とされています。当社ではエクソソームをはじめとする細胞外小胞の表面に存在するホスファチジルセリンへ特異的に結合するTim4タンパク質と磁気ビーズを組み合わせたエクソソーム解析用のフローサイトメトリーキットを開発しました。本キットによりエクソソームを精製することなく簡便かつ高感度にエクソソームのフローサイトメトリー解析が可能になりました。
学術コンテンツ
フローサイトメトリーでエクソソームの解析は可能?
フローサイトメトリー(FCM: Flow Cytometry)は、細胞を細い流路に整列させながら流し、順にレーザーを照射して、生じた散乱光や蛍光を検知する技術です。個々の細胞の特性を高速で測定することができるため、不均一な細胞集団の解析などで広く用いられています。
エクソソームを含む細胞外小胞(EV: Extracellular Vesicle)も不均一な集団であることが分かっており、フローサイトメトリー解析はエクソソームの性状や構成を解析するのに非常に有用な手法であると期待されています。しかしながらエクソソームの粒子径は100 nm前後であり、一般的な細胞サイズ(μmスケール)を想定した測定条件では解析が困難です。一方で、これまでに検出限界などのパラメーターをはじめ、エクソソームの濃度調製、比較となるコントロール、エクソソームを標識する染色法など様々な要素を最適化することでエクソソームのフローサイトメトリー解析を行った例が報告されています。
エクソソームのフローサイトメトリーは可能とされているものの、研究者によってその条件は様々であったことが、実験の再現性や結果の解釈において問題となっていました。そのような状況で、2020年にJoshuaらは、細胞外小胞のフローサイトメトリー解析におけるポジションペーパー「MIFlowCyt-EV」を発表しました1)。この論文ではサンプルの前処理やコントロールの設定、フローサイトメーターの補正など各条件についての最適化のフレームワークが記載されているため、細胞外小胞のフローサイトメトリー解析を検討されている方は参照することをおすすめします。
PSアフィニティー法のフローサイトメトリーへの応用
当社ではエクソソームの表面に存在するホスファチジルセリン(PS: Phosphatidylserine)へ特異的に結合するTim4タンパク質を利用した新規エクソソーム単離・精製手法「PSアフィニティー法」を金沢大学医学系免疫学の華山教授と共同で開発しました2)。本手法は、PS-Tim4の結合を介してエクソソームを捕捉する手法であり、原理的にはフローサイトメトリーにも応用が可能と考えられます。しかしながら、単離・精製キットに使用している磁気ビーズは粒径が小さく、フローサイトメトリーで検出できる粒径の下限を下回ってしまうという課題がありました。
この課題に対して当社は磁気ビーズの粒径や洗浄バッファーの組成を見直し、フローサイトメトリー解析に最適化した「PS Capture™ エクソソームフローサイトメトリーキット」(コードNo. 297-79701)を開発・製品化しました。本キットは磁気ビーズによってエクソソームを単離し、任意の蛍光標識抗エクソソームマーカー抗体(例: 抗CD9抗体、抗CD63抗体、抗CD81抗体など)で標識して使用します(図1)。磁気ビースにエクソソームを結合させたまま流すことで、フローサイトメトリーを用いてエクソソーム表面抗原の検出が可能になりました※。
※ 本キットではビーズ1粒子あたりに複数のTim4が結合しており、その数について保証できないため、定量解析を行うことは推奨しておりません。
① エクソソームの単離
Exosome Capture Beadsにより、
エクソソームをサンプル中から単離する。
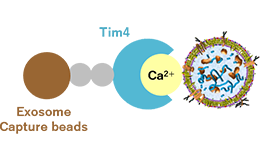
② エクソソームの染色
蛍光標識 抗エクソソームマーカー抗体により、
エクソソームを染色する。

③ フローサイトメトリー解析
磁気ビーズにエクソソームを結合させたまま、
フローサイトメトリー解析を行う。
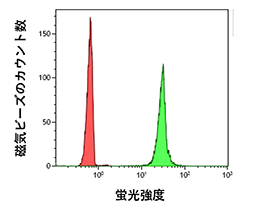
図1 PS Capture™ エクソソームフローサイトメトリーキットの原理
参考文献
- Welsh, J. A. et al.: J. Extracell. Vesicles, 9(1), 1713526(2020).
MIFlowCyt‐EV: A framework for standardized reporting of extracellular vesicle flow cytometry experiments - Nakai, W. et al.: Sci. Rep., 6(1), 33935(2016).
A novel affinity-based method for the isolation of highly purified extracellular vesicles





