【連載】エンドトキシン便り「第9話 米国薬局方(USP)における脱パイロジェン規定」
本記事は、和光純薬工業 試薬化成品事業部開発第一本部 ライフサイエンス研究所 高岡 文が執筆したものです。
はじめに
従来、USP では、脱パイロジェンに関して <797> Pharmaceutical Compounding -Sterile Preparations や、<1221> Sterilization and Sterility Assurance の中で簡単に取り上げられているのみでした。しかし、USP は脱パイロジェンに関する記載を大幅に見直し、2016 年 2 月発行の USP39 1st Supplement では、独立した記載として <1228> Depyrogenation の章が設けられ、さらに順次、脱パイロジェンに関係した技術の解説が収載されているところです(表 1 参照)。
表 1. USP40 <1228.X> 記載内容(収載予定も含む)
<1228.1> Dry heat Depyrogenation
<1228.2> Depyrogenation by Chemical Inactivation
<1228.3> Depyrogenation by Filtration
<1228.4> Depyrogenation by Physical Means
<1228.5> Endotoxin Indicators for Depyrogenation
<1228.6> Endotoxin and Monitoring
<1228.7> Other Endotoxin Reduction Methods
(赤字は既収載)
USP はこのように脱パイロジェンの項目を独立させることで、
- 脱パイロジェンの定義を明確化する
- 種々の具体的な脱パイロジェン方法についての情報を提供する
- 脱パイロジェンのバリデーション方法の基本的な考え方を示す
を意図していると思われます。
本稿では、USP40(2016 年 11 月発行)中の <1228> 脱パイロジェン、<1228.1> 乾熱による脱パイロジェン、<1228.3> ろ過による脱パイロジェン、および <1228.5> エンドトキシンインジケーターの記載内容について解説します。
USP40 <1229> Depyrogenation について
この <1228> は総論であり、各論 <1228.X> での記述と重複している部分が多くあります。
まず、Introduction(序言)で、USP で扱う脱パイロジェンという言葉を、『細菌エンドトキシンの破壊または除去』と明確に定義しました。
さらに、Bacterial endotoxin and lipopolysaccharide(細菌エンドトキシンとリポ多糖)の章で、製品に混入してくる天然のエンドトキシンとリポ多糖(LPS)は等しいとは言えないこと、天然のエンドトキシン(Naturally Occurring Endotoxin, NOE)は、精製 LPS よりも凝集や吸着が少ないため、測定時に問題になる活性の変化が起こりにくく1)、脱パイロジェンされる材質や組成によっては、精製 LPS よりも、脱パイロジェン効果をより正しく反映する場合があると述べています。
ちなみに、USP では従来の BET(細菌エンドトキシン試験)用のエンドトキシン標準品に追加する形で、NOE Control Standard の頒布を計画しています2)。これは、グラム陰性菌の細胞壁の抽出物から調製された液体であり、脱パイロジェン効果の確認等に用いられるもので、EU/mL で換算されたものになる予定です。
続いて、Measuring Endotoxin Pre- and Post-Processing(処理前後でのエンドトキシンの測定)の章で、脱パイロジェン効果を調べる上での注意事項が列挙されています。この部分は、後述の <1228.5> Endotoxin Indicators for Depyrogenation における記載内容と重複する部分が多くあります。以下に抜粋して示します。
①負荷する物質
エンドトキシンの起源(精製または天然)を考慮すること。精製 LPS を使用する場合は、賦形剤を含まないものを選ぶこと。
②脱パイロジェンされる物質の特徴
- プラスチックへの LPS の吸着の可能性。→同じプラスチックでも、表面処理、表面面積や形態が抽出効果に影響する可能性あり。
- 溶液では、製剤の pH、塩濃度、キレート剤、界面活性剤、2 価イオンが精製 LPS の凝集に影響し、回収率に影響。→天然エンドトキシンの使用により改善する可能性あり。
- もともとエンドトキシンが低いか、検出されない材料については、LPS/エンドトキシンの負荷試験を使用した脱パイロジェン検討は必須ではない。
③必要な活性レベル
処理前にどの程度の活性が必要か?
- 従来の 1,000 EU に限定されない。
- エンドトキシンの過去レベル、脱パイロジェン工程の効果、負荷物質の回収方法、安全レベルの許容目標を考慮して設定する。
- 製造工程での減少検証には、予想される最大量(ワーストケース)の天然エンドトキシンを負荷した方がより適切である。
- 高レベルのエンドトキシンが含まれている原料などは、さらにエンドトキシンを負荷する必要はない。
④試験サンプルの調製
- エンドトキシンを固体表面に負荷する方法が、その除去や回収に影響する。風乾、凍乾、真空乾燥等が用いられる。
- 最も脱パイロジェンが困難な部分、あるいは天然の汚染の状況により近い状態で負荷する。
⑤回収方法
- 固体表面で乾燥されたエンドトキシンの標準的な回収方法は決められていない。
- <161> Medical Devices や ANSI/AAMI ST72 : 2011 記載の標準抽出法が便利。
- 陽性対照の回収率が 100% 未満であえれうことは稀ではない。
- 100% 回収率より、同じ材料のロット間と脱パイロジェン実験間の一貫性のある回収率が重要。
⑥試験方法
浸出物やキレート、塩など影響の受け方はライセート試薬によって異なる。→別の方法や銘柄の異なる試薬を試してみる。
⑦脱パイロジェンの方法
- 従来重視されてきた一律の 3log 減少よりも、材料のエンドトキシン規格値を参照して決めた安全レベルが実用的な指標である。
- 投入原料、エンドトキシンのレベル、脱パイロジェンの効果、出力(製品や処理物)で求められるエンドトキシンレベルなどを考える。
以下も、記載内容の抜粋です。
Control of Encotoxin in Parenteral Products(注射薬におけるエンドトキシンの管理)
原料、装置、工程の流れ、製造環境、作業者における細菌の管理が最も効果的であること、および、管理を以下の 3 つのカテゴリーに分けて解説しています。
間接管理
予防的管理。成分や包材、環境由来のエンドトキシン汚染、バイオバーデンの管理。
天然物由来や水分活性の高い原料のエンドトキシン汚染、バイオフィルムによる水の汚染に特に注意。
プロセス管理
CCP(Clinical Control Point, 重要管理点)を決め、エンドトキシンの増加がないかモニターする。
直接管理
製品の流れ、装置、一次包材において、エンドトキシンを破壊、または除去する。処理のバリデーションが必要。
Selection of an appropriate depyrogenation method (適切な脱パイロジェン方法の選択)
- 製造工程を評価し、材料とプロセス構成物を同定する。
- 材料や残存エンドトキシンレベル、最終製品のエンドトキシン上限に適した、脱パイロジェン工程の開発
- 適切なバリデーション法の検討
- 継続的なモニタリングによる、脱パイロジェン工程の効果の確認
- 脱パイロジェン工程に変更があれば、文書化しておく。
Validation of a Depyrogenation Method(脱パイロジェン方法のバリデーション)
- 開発段階では、脱パイロジェン処理に使用される制御機器を規定する操作パラメーターを検討し、確立する。
- IQ(据え付け時適格性確認)段階では、制御装置や処理結果の測定装置が適切に設計され、校正されていること。
- OQ(可動性能適合性確認)段階では、規定された脱パイロジェンパラメーターの範囲内で、装置や他のプロセス構成要素を確認する。
- PQ(稼動時適格性確認)段階では、材料あるいは品目の脱パイロジェンを直接評価する。
USP40 <1228.1> Dry Heat Depyrogenation について
<1228.1> は、最も頻用されているパイロジェン不活化法である、乾熱滅菌についての解説です。主な記述を抜粋して紹介します。
◆脱パイロジェンのプロセス管理
- 脱パイロジェン効果は、時間と温度に依存する。
D 値:パイロジェンを 1/10 にする時間
Z 値:D 値を 10 倍変化させる温度変化
と定義されており、乾熱脱パイロジェンの Z 値として 50℃を使用すると、次式で、250℃以外の温度での脱パイロジェン効果が求められる。
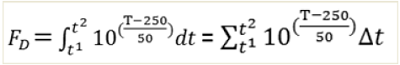
FD = 累積破壊量, t1 = プロセス開始時間, t2 = プロセス終了時間, T = 各時間増加における温度
(FD = 1 は、250℃で 1 分間の加熱による脱パイロジェン効果)
◆バリデーション
- 乾熱は高い安全マージンが取れるが、その温度と時間では、処理対象も破壊することがある。
- 処理対象にもともとあるエンドトキシン量と、患者の安全の保証に必要なレベルまでの減少を考慮した脱パイロジェン処理について、開発段階から注意を払う。
- 装置(オーブンやトンネル方式)に合わせた、温度分布の調査や、ロードマッピングを実施する。
脱パイロジェンの確認
- 脱パイロジェンされる物質については、バリデーション検討に先立って元々のエンドトキシン量を調べること。
- 温度と時間が脱パイロジェン条件に適合していることを一貫して示すのであれば、負荷物質(エンドトキシンや LPS)の添加は、3log 減少の提示も含めて、必要ないかもしれない。温度モニタリングを同時に実施する。
- 日常の処理条件よりも時間・温度を減じた、マッピングで得られた"ワーストケース"での確認とする。
(オーブン)
少なくとも 5 つのサンプルを、少なくとも 10 ヵ所の温度モニタリング位置(コールドスポットを含む)の近くに入れる。
その処理後のエンドトキシン含量が、0.1 EU/サンプル以下であること。
(トンネル方式)
少なくとも 5 つのサンプルを、トンネル内の温度モニタリング位置(コールドスポットを含む)の近くに入れる。
その処理後のエンドトキシン含量が、0.1 EU/サンプル以下であること。
USP40 <1228.3> Depyrogenation by Filtration について
<1228.3> では、ろ過によるパイロジェン除去法(吸着と大きさによる排除)について、様々な種類の膜ごとに解説されています。多くの参考文献も記載されており、規定というよりは、実施する際の情報提供の役割が大きいようです。バリデーションに関しては <1228> depyrogenation を参照するようにと記載されているのみです。
以下に、内容を抄録します。
1. 微細孔膜ろ過
細菌細胞壁のかけらであるエンドトキシンは、多くは <0.025µm であり、生菌の除去に有効な 1.0~0.1µm 孔径の微細孔膜ろ過では通過する。
陽性荷電膜(陰性に荷電したエンドトキシンが吸着)や疎水性の膜(Lipid A と膜の間で生じる疎水的相互作用で吸着)によるろ過では、エンドトキシンの除去が可能。
エンドトキシンの除去効果は、流速、pH、濃度、および溶液や膜表面の性質に依存。膜の結合能が飽和状態に近づくと、残存するエンドトキシンは膜を通り抜ける。
2. 逆浸透
RO 膜は最も孔径の小さな膜であり、パイロジェンやその他の実質的にはすべてのものを水から大きさによって排除する。RO システムは、高圧(200 - 1,000 psi)で、最も効果的に運転される。RO システムは細菌をすべて排除できるようになっていないため、室温で運転すると微生物による汚染が懸念される。UV 灯をシステムの下流に設置することで微生物汚染を制御できる可能性がある。
3. 限外ろ過
限外ろ過(UF)は、加圧下で公称孔径が約 1~100 nm の膜でろ過するプロセス。UF 膜は通常、分画分子量(MWCO)によって分類される。
LPS の基本的なサブユニットは、10~20 kDa であり、6~10 kDa の分画分子量の膜が、脱パイロジェンにしばしば用いられる。しかし、LPS は通常、ベシクルといった分子量 300~1,000 kDa の凝集体で存在しており、MWCO 30~100 kDa の高流量膜で除くことができる。
大きさによる排除に加えて、吸着も UF 膜による除去効果に影響する。膜の疎水性が高い方が除去には効果的。
4. 荷電デプスフィルター
大きさによる排除(ふるいまたは捕捉作用)と吸着、動電学的(陽性ゼータ電位)あるいは疎水性相互作用により除去効果を示す。
一般に。荷電デプスフィルターでは、荷電メンブレンフィルターと比較して、電荷が消耗しつくした後に通過するエンドトキシン濃度はゆっくりと増大する。
また、セルロース製のデプスフィルターからは、ライセート試薬の G 因子と反応し、偽陽性の原因になる β-1,3-グルカンの溶出がある。その場合は、β-1,3-グルカンに反応しないライセート試薬を使用するとよい。
5. 活性炭デプスフィルター
エンドトキシンを効果的に減少させる(4log から 5log 減少)が、様々な物質に対して高い吸着性を示すので、必要な物質まで吸着してしまわないかどうかに注意を払うこと。
6. 膜吸着剤
膜表面に機能化されたイオン交換担体を持った、荷電膜吸着剤を使用する脱パイロジェン法。通常 2 つの方法がある。
①目的のタンパク質の等電点(pI)より低い pH の緩衝液下で、4 級アミン(Q)タイプの強力な塩基性陰イオン交換体を用いる→エンドトキシンは荷電膜に吸着し、蛋白質は膜を通過する。
②目的のタンパク質の pI より低い pH の緩衝液下で強酸性陽イオン交換体を用いる→エンドトキシンは荷電膜を通過し、タンパク質は吸着する。タンパク質は、次の段階で適切な緩衝液を用いて溶出できる。
以上に加えて、陰イオン結合性と疎水性の両方の性質をもつ混合様式の膜吸着剤も用いられる。エンドトキシンは膜に強固に結合する。塩濃度や pH を適切に調節すれば、タンパク質は荷電反発で膜を通り抜ける。
USP40 <1228.5> Endotoxin Indicators for Depyrogenation について
1. Introduction
エンドトキシンインジケーターとは、『脱パイロジェンプロセスに負荷するのに用いられる、エンドトキシンまたは LPS を接種したすべての担体』と定義され、洗浄、すすぎ、クリーニング、ろ過やクロマトグラフィー等の分離技術によるエンドトキシン除去の効果を調べるのに用いられる。
2. Endotoxin and LPS
(略)
3. Application of Endotoxin Indicators
限外ろ過、アフィニティクロマト、荷電膜やカラムによる脱エンドトキシン評価には、精製 LPS より、グラム陰性菌の培養液からとったエンドトキシンを用いた方が適切。
4. Preparation and use of Endotoxin Indicators
- 実験室でエンドトキシン標品を調製する場合、菌株の一貫性を維持するよう、USP <1117> Microbiological Best Laboratory Practices に準じて、継代法、培養法を確立、管理する。
- エンドトキシン標品のバッチ間の一貫性を維持できるように、菌株維持方法と調製方法は詳細に文書化し、それを実行する。
- エンドトキシン標品はライセートのロット毎に、RSE や CSE と対比して活性を決定するとよい。安定性の評価も重要であり、有効期限を決めること。接種するエンドトキシンや LPS は、担体あたり 1,000 EU 以上とする。それ以外の負荷量でも、対象物質の過去のエンドトキシン量のデータに基づいて正当化される可能性がある。
- 高濃度の LPS またはエンドトキシンを担体に少量添加して、固定化、あるいは乾燥する。
- 液状の物質には、ワーストケースの濃度(工程の知識と、過去のエンドトキシン量に依拠した値)で負荷する。
- 未処理のインジケーター(対照)と脱パイロジェン処理したインジケーターから、エンドトキシンまたは LPS を回収し、定量する。
- インジケーターが固体である時は、抽出法として <161> Medical Devices-Bacterial Endotoxin and Pyrogen Tests が参考にできる(37 ± 1℃で 1 時間以上抽出)。
- 対照インジケーターからの回収率はしばしば 100% ではない。
- エンドトキシン/LPS の選択と'固定化'プロセスは、一貫性が検証されるべきである。BET 試験方法も研究中同じ方法を用いることを勧める。
5. Analysis of Results of Depyrogenation Studies
(計算例)
■未処理インジケーターのエンドトキシン活性 1,286、1,000(最小値)、1,532 EU/mL
■処理済みインジケーターのエンドトキシン活性 0.634(最大値)、0.512、0.496 EU/mL
log10(1000) - log10(0.634) = 3 - (-0.198) = 3.198 log 減少
ここで、対象物によっては、脱パイロジェン規格値は 3log 減少以上にならないという考え方が示されている。
- ほとんどエンドトキシンが検出されない清浄なバイアルの場合
- 107 EU/mL 以上の醗酵プロセスの遠心培養上清の場合
- 複数の脱パイロジェンプロセスが加わる場合 など。
まとめ
これまで、USP の脱パイロジェンの規定としては、初期値からの 1,000 分の 1 以下の減少が要求されているのみであった。今回の USP 改訂により、製品の安全レベルの許容目標を考慮した規定が示された。これは、USP がより一層、科学的な合理性に基づいた製品のエンドトキシン管理を求めているということを意味するものである。
参考文献
- Bolden J. et al. Stimuli to revision process Pharmacopeial Forum 41(5).
- http://www.uspnf.com/notices/early-input-sought-proposed-naturally-occurring-endoxtoxin-noe-reference-standard
関連記事