組織固定液
製品ラインアップ
学術コンテンツ
固定に使用される試薬とその原理
固定液の多くは生体組織の主要構成要素であるタンパク質の官能基に作用し、分子内や分子間に架橋を生じさせます。そのため少なからず組織の形態や目的物質の構造・活性に影響を及ぼします。そのため目的に応じて適切な固定液を選択することが必要です。当社では光学顕微鏡用固定液と電子顕微鏡用固定液を幅広くラインアップしております。
一般的に、光学顕微鏡レベルの観察であればホルムアルデヒド、電子顕微鏡レベルであればグルタルアルデヒドやオスミウム酸(四酸化オスミウム)などが使用されます。代表的な固定液の原理を以下に示します。
ホルムアルデヒド
ホルムアルデヒドはまずタンパク質の側鎖官能基(アミノ基、イミノ基、アミド基、水酸基、カルボキシル基、SH基、芳香環族など)と反応し、ヒドロキシメチル基を生じさせます。さらにこのヒドロキシメチル基と別のタンパク質の活性水素が反応し、分子内もしくは分子間にメチレン架橋構造(-CH2-)が形成されます(図1)。これによりタンパク質は不動化し固定されます。
① R-H + CH2O → R-CH2(OH) ② R-CH2(OH) + H-R' → R-CH2-R'
図1 ホルムアルデヒドとタンパク質官能基の反応
ホルムアルデヒドは加水分解酵素(アルカリフォスファターゼやエステラーゼ)の活性は保存しますが、酸化還元酵素(デヒドロゲナーゼなど)や転移酵素(ホスホリラーゼ)の活性は阻害します。なお核酸や脂質、多糖とは反応しませんが、周囲のタンパク質が架橋されゲル状になることでこれらの分子も保存されると言われています。
ホルマリン
ホルムアルデヒドの約37w/w%水溶液を「ホルマリン」と呼びます。当社の商品名である「10%ホルマリン液」はホルマリンを希釈した10w/w%ホルマリン水溶液(ホルムアルデヒド含量3.7-4.1%)です。ホルマリン液にはホルムアルデヒドの重合を防ぐためにメタノールが加えられています。
当社では10%, 15%, 20%のホルマリンをラインアップしています。一般的には10%ホルマリン液が用いられますが、早く固定したい場合には浸透力の高い 高濃度のホルマリンを選択する場合もあります。しかしその分試料にダメージを与える恐れがありますので実験目的によって選択することが必要です。
ホルマリンは日光や空気にさらすと自ら酸化してぎ酸を生じます。組織によってはぎ酸の影響を受けるものがあり、ぎ酸の影響を避けたい場合には、ホルマリン液にりん酸ナトリウムを加えた中性緩衝ホルマリン液を使用します。
またホルマリンは刺激臭や不快臭を放ちますが、マイルド剤(ワインエキス)を添加することでホルマリン臭を抑えたマイルドホルムという製品もラインアップしております。
グルタルアルデヒド
グルタルアルデヒドもタンパク質の側鎖官能基(アミノ基、SH基など)と反応し、分子内もしくは分子間に架橋を生じさせます(図2)。
組織への浸透性はホルムアルデヒドと比べて弱く、光学顕微鏡レベルの大きな試料の固定には向きませんが、形態の保存性に優れているので、電子顕微鏡用の固定に使用されます。ただし脂質の固定はできないため、脱水処理によって細胞の膜構造などが失われます。そのため電子顕微鏡観察では後述のオスミウム酸と組み合わせた二段階の固定を行います。
R-NH2 + R'-NH2 + CHO[CH2]3CHO → R-NH-CHOH[CH2]3CHOH-NH-R'
図2 グルタルアルデヒドとタンパク質官能基の反応
オスミウム酸 (四酸化オスミウム)
酸化オスミウム(VIII)の1%水溶液をオスミウム酸と呼びます。オスミウム酸は不飽和脂質のエチレン基やタンパク質のアミノ基、SH基、水酸基などを酸化して生じた過酸化物により、分子内もしくは分子間に架橋を生じさせます(図3)。
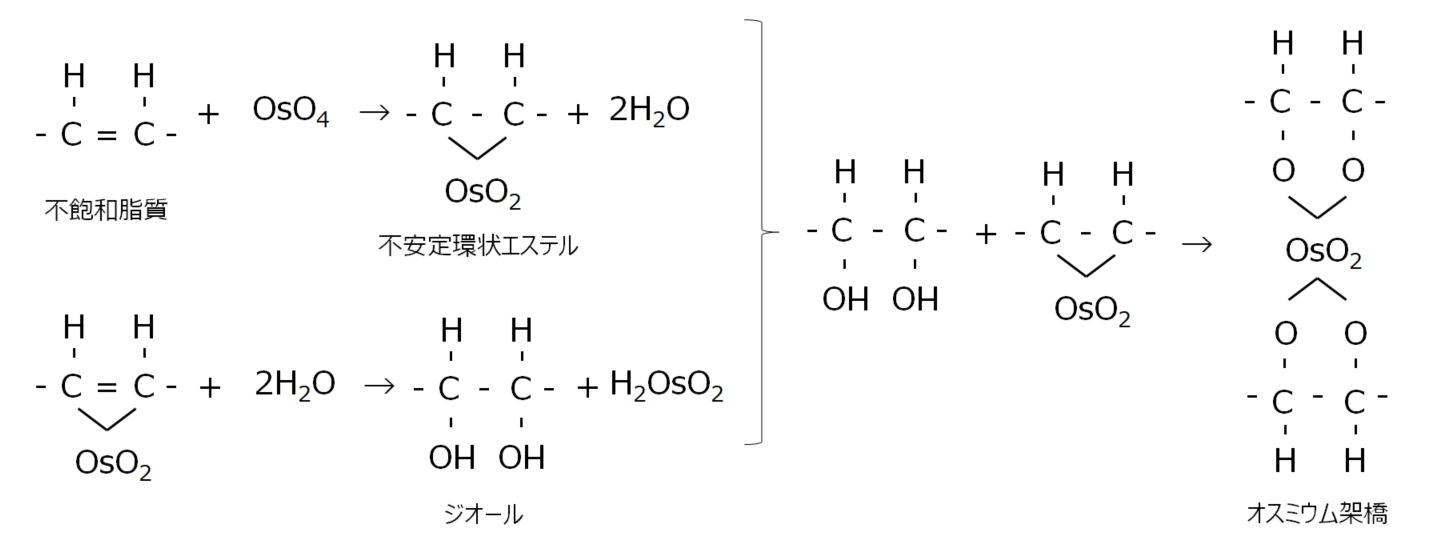
図3 オスミウム酸と不飽和脂質の反応
参考文献
山田和順 著, 組織化学 初学者のための基礎と実際, 南江堂, 1987
高田邦昭, 斎藤尚亮, 川上速人 編, 第5版 実験医学別冊 染色・バイオイメージング実験ハンドブック, 羊土社, 2012
高橋英機 監修, 大久保和央 著, 細胞・組織染色の達人, 羊土社, 2018




