in situ ハイブリダイゼーション用試薬
in situ ハイブリダイゼーション(ISH)法は、スライドガラスに固着させた組織切片上で核酸-核酸ハイブリダイゼーションにより、特定の核酸の局在性部位を決定する方法です。特にRNAプローブを用いたISH法は、シグナル/ノイズ比の改良に有用です。しかし、RNAプローブを用いる場合は、操作中での混入や試料中に存在するRNaseにより組織切片のmRNAやRNAプローブ自体が分解され易いため、注意深い実験操作のみならず適切な試薬の選定が必要です。当社はin situ ハイブリダイゼーションに有用な試薬を取り扱っています。
学術コンテンツ
in situハイブリダイゼーション法とは?
in situ ハイブリダイゼーション (ISH) 法とは、組織中のRNAまたはDNAが存在する"原位置 (in situ) "をRNA-RNA、RNA-DNA、DNA-DNA ハイブリダイゼーションにより検出する方法です。組織切片を用いて特定遺伝子を検出することができ、特に発生分化、形態形成の研究においては、必要不可欠な方法となっています。
in situ ハイブリダイゼーション法の工程
組織の固定 -mRNA を細胞内で保存する-
各細胞には様々な種類のmRNAが存在していますが、寿命は比較的短いと考えられています。タンパク質が必要な時に必要な量だけmRNA は合成され、目的が達成されるとRNA 分解酵素により速やかに分解されます。細胞が死んでしまうと、mRNA の合成は当然止まってしまいますが、mRNA の分解は継続されると考えられ、死んだ細胞内のmRNA は急速に分解され消失してしまいます。
そのため、ISH 法を行う場合は、細胞内や組織などをなるべく自然の状態に保存することが非常に重要で、この操作を固定と呼んでいます。細胞や組織の形態を観察するための固定法は、目的などに応じて様々な方法が開発されています。
前処理
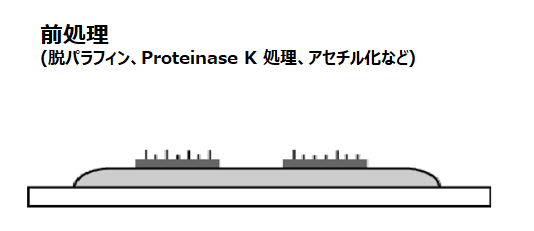
ハイブリダイゼーションを行う前に、固定した組織の前処理を行います。主な目的は、タンパク質分解酵素などを用いて結合組織などを分解しプローブの浸透性をよくするためと、プローブの非特異的な吸着を防ぐための処理です。特にタンパク質分解酵素の処理時間は、組織の種類、固定法とも関連し、ISH 法の結果を左右する重要な因子です。
標識プローブの調製
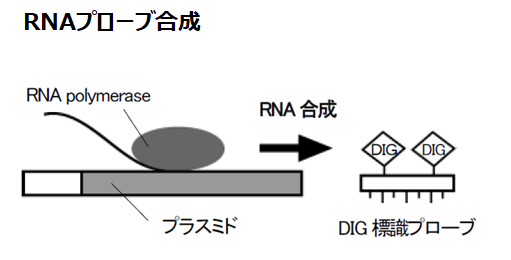
目的のmRNA を検出するためにはそのmRNA と特異的にハイブリダイズする、つまり、目的のmRNA と相補的な配列を持ったRNA またはDNA プローブが必要です。
プローブとしてよく用いられるのは下記の3種類です。
①化学合成したDNA を用いるオリゴヌクレオチドプローブ
②DNA 合成酵素によりin vitroで合成したDNA プローブ
③RNA 合成酵素によりin vitro で合成したRNA プローブ
プローブの存在を可視化するためにプローブに必要なラベルを結合させます。可視化には主に次の2つの方法があります。
①酵素抗体法または蛍光抗体法
適当な抗原の結合した核酸を用いてプローブを標識し、その抗原に対する抗体を用いて発色または蛍光により可視化する。
②放射性同位元素(RI)を用いる方法
放射性同位元素(RI)を用いてプローブを標識し、オートラジオグラフィー法により可視化する。
ハイブリダイゼーション
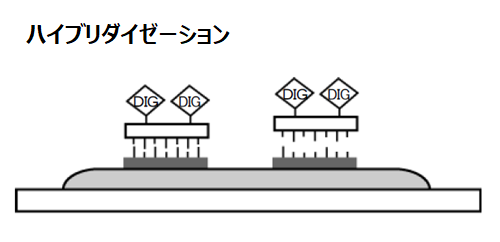
サンプルの前処理とプローブの調製が終わったら、目的のmRNA とそのmRNA と特異的なプローブをハイブリダイズさせます。どの程度の塩基対のマッチまで許容するかをstringency といい、高いstringency の条件では相補的な配列を持つDNA あるいはRNA プローブに特異的に結合することを利用して、多くのDNA あるいはRNA の中から、目的のDNA あるいはRNAを識別し、検出することができます。
融解温度(Tm)※ では全体の50%ほど二重らせんが形成されていることになります。ハイブリダイゼーションの温度 (Th) は、Tmから5~10℃低い温度で行います。(Tm -5)℃でハイブリダイズさせると、stringency が高くなり、完全マッチしていないとハイブリッドを形成しません。しかし、ハイブリダイズする温度を (Tm -20)℃と低くするとstringency が低くなり、ミスマッチを持ったハイブリッドも形成されます。
ISH 法では、RNA プローブを使用する場合、50%ホルムアミド中50℃で12~14 時間ハイブリダイゼ-ションを行うとほぼ良い結果が得られます。
もし、プローブとして50 塩基以下のDNA を用いる場合などは、低stringency の条件でハイブリダイゼーションを行います。
※ 融解温度 (Tm)
DNA の二重らせん構造は、塩基対A=T に形成される2つの水素結合と塩基対G≡C に形成される3つの水素結合により安定に保たれています。この二本鎖を一本鎖にする方法の一つとして熱変性があり、二重らせんDNA 溶液の温度を高くしながらDNA 溶液の260 nm の吸光度A260を測定すると、次第にA260は高くなります。これはDNA の二重らせんが壊れ一本鎖になるためで、この曲線をDNA の融解曲線と呼んでいます。
この現象は、らせんが消失し塩基間の相互作用が少なくなるため、塩基の光吸収の効率が変化 (深色効果) し、各塩基の分子吸光係数が高くなるために生じます。温度が低い時のDNAをヘリックス100%とし、高温での吸光度が一定になる状態をヘリックス0%と仮定すると、ヘリックス50%になる温度、融解温度 (Tm) を決定することができます。
Tm は二重らせんの安定度の目安になります。非常に安定ならせんであればTm は80~90℃になります。逆に不安定であれば30~40℃になります。Tm はDNA 溶液のイオン強度 (塩濃度) や組成にも依存し、また、GC 塩基対の含量、DNA の長さ、DNAの塩基対のミスマッチなどにより変化します。
洗浄
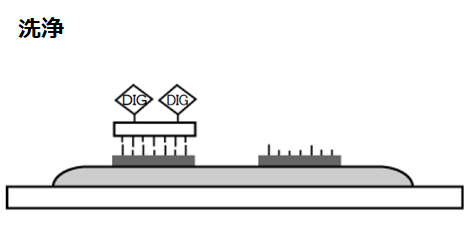
非特異的に結合したプローブを除去するために組織切片を洗浄します。洗浄の条件を厳しくするとバックグラウンドが低下しますが、同時にシグナルも弱くなります。
RNA プローブを用いた場合は、RNase 処理によりバックグラウンドを低下させることができますが、同時にシグナルも弱くなるので、いずれにしても最適な条件を検討する必要があります。
プローブの検出
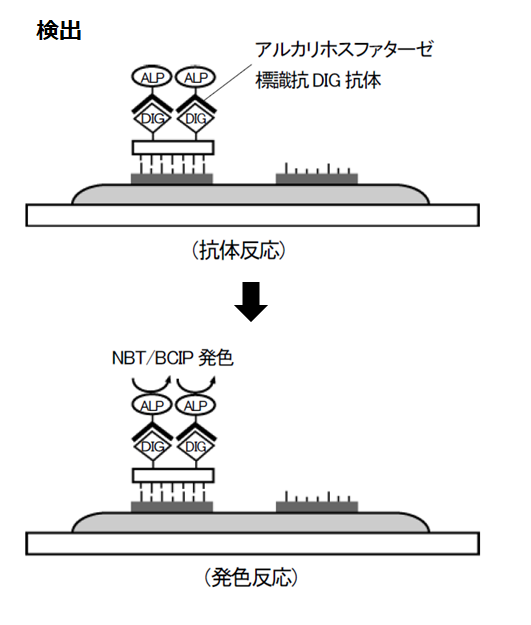
① 酵素抗体法
標識プローブ単独では発色することができないため、プローブの中に取り込まれている抗原に対する抗体を用いて検出を行います。検出に用いる一次抗体には、通常の抗体とは異なりアルカリホスファターゼ (ALP) などの酵素が結合 しています。一次抗体にALP が結合している場合、X-りん酸 (5-Bromo-4-chloro-3-indolyl-phosphatase : BCIP) などを用いると、ALP がX-りん酸の結合を切断することによりX が遊離し、発色がおこります。蛍光色素の場合には、蛍光顕微鏡で検出することが可能です。
② 放射性同位元素 (RI) を用いる方法
ISH 法においてはRI として35S (または33P) 標識された核酸を用いてプローブを合成します。RI はβ 線を放射しているので、オートラジオグラフィー用の乳剤を用いて検出することができます。
観察と記録
組織の細胞を色素で染色することにより、形態学的な観察ができます。結果を顕微鏡で観察し、さらに写真として記録します。
RNAプローブによるin situ ハイブリダイゼーション法のメリット
・RNA-RNA ハイブリッドはRNA-DNA ハイブリッドに比べ、Tm 値が高く安定である。このため洗浄を十分に行うことができる。
・RNA 分解酵素 (RNase A) は二本鎖RNA (RNA-RNA ハイブリッド) を切断しない。
このため過剰プローブや非特異的に吸着したプローブを分解することにより、バックグラウンドを低下させることができる。
・ハイブリダイゼーションにはアンチセンスRNA を使うが、ネガティブコントロールとしてセンスRNA を用いることができるので、結果の判定が容易である。
・プローブの長さをアルカリ加水分解により短くできる。
・放射比活性の高いプローブの調製が可能である。このため検出感度が高い。
参考文献
ニッポンジーン ISHR Starting Kit & ISHR マニュアル 第12版




