うつ病研究試薬
うつ病 (大うつ病)は憂うつな状態が長期に渡って続く気分障害の一種です。発症のメカニズムについてはモノアミン仮説やBDNF仮説などいくつかの仮説が提唱されていますが未だ議論が続いています。当社ではBDNFの成熟体 (Mature BDNF)を特異的に測定可能なELISAキットをはじめ、うつ病の発症メカニズム解明や診断および治療薬の研究開発に貢献する製品をラインアップしております。
学術コンテンツ
うつ病とは
うつ病(Depression)は大うつ病(大うつ病性障害)とも呼ばれ、いわゆる憂うつな状態が⻑期に渡って続くという気分障害の⼀種です。躁状態とうつ状態を繰り返す双極性障害(躁うつ病)も気分障害ですが、⼤うつ病とは区別されています。
うつ病の主な症状は抑うつ気分(憂うつ、気分が重い)や何をしても楽しくない、何にも興味がわかない(喜び・興味の消失)であり、同時に疲れやすい(易疲労感)や眠れない・常に眠い(睡眠障害)、⾃分を責める(罪責感)などの症状も現れます。⼈⼝の⼀割程度が⼀⽣に⼀度発症する病気でありながら1)、⻑期休職や⾃殺に追い込まれるケースもあり、早期診断や治療法の確⽴に向けて様々な研究がなされています。
うつ病はストレスを始めとする様々な要因によって発症する病気です。うつ病の発症に関する分⼦メカニズムにはモノアミン仮説やHPA 系障害説、脳内炎症説、BDNF 仮説など様々な仮説が存在し、未だ議論が続いています。以下の記事では、うつ病発症の分⼦メカニズムについて現在提唱されている仮説をご紹介します。
うつ病の分子メカニズム
モノアミン仮説
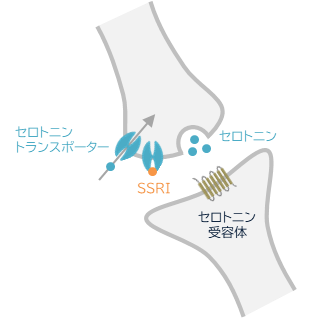
SSRI の作⽤機序
SSRI はセロトニントランスポーターによるセロトニンの再取り込みを阻害し、シナプス間のセロトニン濃度を増加させる。
モノアミン仮説は、脳内のモノアミン(セロトニン、ノルアドレナリン、ドーパミン)濃度の低下がうつ病の原因であるという仮説です。結核薬のイプロニアジドや抗ヒスタミン剤のイミプラミンに抗うつ作⽤があることが判明し、イプロニアジドはモノアミン酸化酵素(MAO)を、イミプラミンはセロトニンやノルアドレナリンのトランスポーターを阻害する作⽤があることから、モノアミン仮説が提唱されるようになりました。
うつ病の分⼦メカニズムにおいて、モノアミン仮説は中⼼的な役割を担っており、現在使⽤される抗うつ薬の多くがモノアミン仮説を根拠に開発されてきました。副作用の比較的少ない選択的セロトニン再取り込み阻害薬(SSRI)や選択的セロトニン- ノルアドレナリン再取り込み阻害薬(SNRI)は⽇本において抗うつ薬の第⼀選択となっています。
しかしながら、抗うつ薬の投与後にモノアミンレベルは急激に上昇するにも関わらず、治療効果が得られるのは数週間後になる2)など単純なモノアミン仮説では説明のつかないところも存在し、さらに詳細なメカニズムの解明が待たれています。
HPA 系障害説
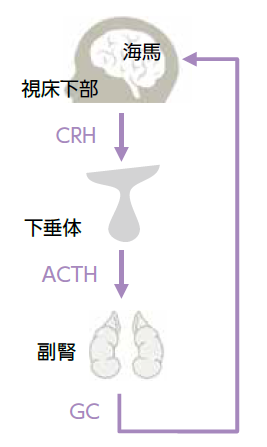
視床下部–下垂体–副腎⽪質系
ストレスに対する反応には視床下部- 下垂体- 副腎⽪質系(Hypothalamo-Putuitary-Adrenal axis: HPA系)が関与しており、強いストレスにさらされることでHPA 系のシグナルが過剰になり、その結果海⾺を始めとした脳内に悪影響を及ぼし、結果としてうつ病が引き起こされるという仮説です。
ストレスがかかると、視床下部よりコルチコトロピン放出ホルモン(CRH/CRF)が放出され、CRH によって下垂体から副腎⽪質刺激ホルモン(ACTH)の分泌が促進されます。さらに副腎からグルココルチコイド(GC)が分泌され、これが海⾺に作⽤します。 海⾺からはCRH の放出を抑制する経路が存在し、HPA 系と合わせてネガティブフィードバックループを形成しています。しかしながら、強いストレスに⻑期間さらされると海⾺の神経細胞はダメージを受けます。通常、⼈⼯コルチゾール(グルココルチコイドの1 種)であるデキサメタゾンを投与すると、コルチゾールの分泌が抑制されますが、うつ病患者はこの分泌抑制試験において抑制を⽰さないことが知られています1)。このことから、うつ病ではコルチゾール抑制のネガティブフィードバックループがうまく機能していない可能性が⽰唆されています。
HPA 系シグナルの抑制によってうつ病の症状が改善されるかは未だ明らかではありませんが、今後抗うつ薬のターゲットになりうると考えられています。
脳内炎症説
近年、脳における免疫反応(炎症)がうつ病に関与することが明らかになってきました。これは免疫系の疾患を抱え、サイトカインによって治療を受けている患者に⾼頻度でうつ病が⾒られる3)ことや、うつ病患者では炎症マーカーのレベルが⾼い4)という報告から注目されるようになりました。脳内炎症説は、ストレスによって誘導された炎症が、IL-6 やTNF-αなどのサイトカインを誘導し、神経新⽣の低下やHPA系の障害を引き起こすことでうつ病が発症あるいは増悪するというものです。またこれらのサイトカインはトリプトファンからキヌレニンを合成する経路を活性化させるため、同じくトリプトファンから合成されるセロトニンの減少を引き起こすのではないかとも考えられています5)。
BDNF 仮説
脳由来神経栄養因⼦(Brain-Derived Neurotrophic Factor: BDNF)は神経成⻑因⼦であるニューロトロフィンファミリーの1 種 であり、脳内において神経保護・神経発⽣・シナプスの可塑性に関与していることが分かっています。
うつ病の原因の1つであるストレスによって海⾺のBDNFが減少すること6)や、抗うつ薬を⻑期間投与したラットはストレスによるBDNF の減少が軽減されること7)から、BDNF とうつ病の関与が指摘されるようになりました。また抗うつ薬によるBDNFの発現増加が投与直後ではなく、約3 週間後に確認されたこと7)から、抗うつ薬の治療効果が投与から遅れて⽣じることの説明になると考えられています。このような報告から、ストレスにより脳内のBDNF が減少し、神経細胞の萎縮やシナプス可塑性の低下などが引き起こされ、うつ病の病態が生じるというBDNF 仮説が提唱されています。またうつ病患者では⾎清中のBDNF 濃度が健常者に⽐べて有意に低値であること8)、またうつ病の重症度と⾎清BDNF 濃度に相関があること、抗うつ薬により⾎清BDNF 濃度が増加すること9)が報告されており、BDNF はうつ病の疾患マーカーとしても期待されています。
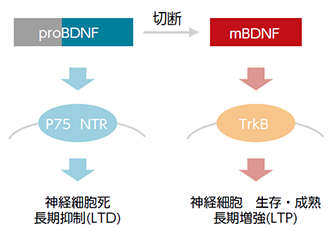
proBDNF とmBDNF
BDNF は他の神経栄養因⼦と同様に、前駆体(proBDNF)が切断を受けて、成熟体(mature BDNF / mBDNF)となります。proBDNF はp75NTR、mBDNFはTrkB と呼ばれる受容体にそれぞれ結合します。proBDNF とmBDNF の作⽤は相反するものであり、proBDNF は神経細胞死やシナプス伝達の⻑期抑制(LTD)、⼀⽅mBDNF は神経細胞の⽣存維持や成熟促進、シナプス伝達の⻑期増強(LTP)などにはたらきます10)。
proBDNF とmBDNF どちらがうつ病の疾患マーカーとして有効であるかは未だに結論は出ていませんが、Yoshida らはうつ病患者では⾎清中におけるmBDNF が減少する⼀⽅で、proBDNF は減少しなかったと報告しています11)。うつ病の治療対象あるいは疾患マーカーとしてBDNF を理解するためには、今後、proBDNF とmBDNF を区別して測定することが必要になると考えられます。
オキシトシンとうつ病
オキシトシン(Oxytocin)は9 アミノ酸の神経ペプチドです。視床下部で産⽣されており、出産や授乳をきっかけに主に下垂体後葉から放出され、⼦宮の収縮や⺟乳の分泌を促進します。その他にも⺟性⾏動の形成や抗ストレス作⽤などに関与することから、通称「幸せホルモン」、「愛情ホルモン」などと呼ばれています。
うつ病とオキシトシンの関連については、強制⽔泳試験によるマウスの不動時間(うつ状態のモデル)がオキシトシンの投与によって短縮されたこと、さらにその効果が抗うつ薬として知られるイミプラミンと同程度のものだったことが知られています12)。このような動物実験の結果を受けてオキシトシンをうつ病の治療薬に利⽤しようとする試みもあります。
またオキシトシンをうつ病のバイオマーカーとして利⽤するため、うつ病患者と健常者の間でオキシトシンレベルを⽐較した研究も存在しますが、男⼥間で結果が異なっていたり、健常者との⽐較で⼀貫した結果が得られていなかったりと今後さらなる研究が求められます13)。
参考文献
- 真鍋俊也,森寿,渡辺雅彦,岡野栄之,宮川剛編: 「改訂第3版 脳神経科学イラストレイテッド」 (⽺⼟社) (2013).
- Jeon, S. W., and Kim, Y. K.: Int. J. Mol. Sci., 17(3),381(2016).
Molecular Neurobiology and Promising New Treatment in Depression - Trojan, E., Chwastek, J., and Basta-Kaim, A.: Curr. Neuropharmacol., 14(7),705(2016).
A Potential Contribution of Chemokine Network Dysfunction to the Depressive Disorders - Uddin, M., et al.: Psychol. Med., 41(5),997(2011).
Epigenetic and inflammatory marker profiles associated with depression in a community-based epidemiologic sample - Myint, A. M., and Kim, Y. K.: Med. Hypotheses, 61(5-6),519(2003).
Cytokine-serotonin interaction through IDO: a neurodegeneration hypothesis of depression - Smith, M. A., et al.: J. Neurosci., 15(3),1768(1995).
Stress and glucocorticoids affect the expression of brain-derived neurotrophic factor and neurotrophin-3 mRNAs in the hippocampus - Nibuya, M., Morinobu, S., and Duman, R. S.: J. Neurosci., 15(11),7539(1995).
Regulation of BDNF and trkB mRNA in rat brain by chronic electroconvulsive seizure and antidepressant drug treatments - Karege, F., et al.: Psychiatry Res., 109(2),143(2002).
Decreased serum brain-derived neurotrophic factor levels in major depressed patients - Shimizu, E., et al.: Biol. Psychiatry, 54(1),70(2003).
Alterations of serum levels of brain-derived neurotrophic factor (BDNF) in depressed patients with or without antidepressants - Castrén, E., and Kojima, M.: Neurobiol. Dis., 97, 119(2017).
Brain-derived neurotrophic factor in mood disorders and antidepressant treatments - Yoshida, T., et al.: PLOS ONE, 7(8),e42676(2012).
Decreased serum levels of mature brain-derived neurotrophic factor (BDNF), but not its precursor proBDNF, in patients with major depressive disorder. - Arletti, R., and Bertolini, A.: Life Sci., 41(14),1725(1987).
Oxytocin acts as an antidepressant in two animal models of depression - Massey, S. H., Backes, K. A., and Schuette, S. A.: Depress. Anxiety, 33(4),316(2016)
PLASMA OXYTOCIN CONCENTRATION AND DEPRESSIVE SYMPTOMS: A REVIEW OF CURRENT EVIDENCE AND DIRECTIONS FOR FUTURE RESEARCH




