mRNA
mRNAは、タンパク質に翻訳される遺伝情報を有する成分であり、遺伝子発現において重要な役割を担っています。分子生物学・細胞生物学分野においては、mRNAを細胞に導入することによる遺伝子発現実験も盛んに行われています。一方、mRNAは非常に不安定であり、また個体への導入においては免疫原となる場合もあることから、mRNAの安定化や免疫反応を回避するための技術も開発されています。当社は、mRNAの合成をはじめ、安定化や免疫反応の回避を可能にした技術を提供しています。
【キャップ化剤】
【ヌクレオシド三りん酸】
【RNAポリメラーゼ】
【DNA除去/RNA精製】
【その他関連試薬】
【IVT合成キット】
- TriLink社 高収量mRNA IVT合成キット
- TriLink社 CleanCap® AG (3' OMe) CleanScript™ IVT Kit
- ニッポンジーン CUGA® in vitro Transcription Kit
【Cap-mRNA】
【ドラッグデリバリーシステム(DDS)】
【受託サービス】
製品ラインアップ
学術コンテンツ
メッセンジャーRNA (messenger RNA/mRNA) はRNAポリメラーゼによって遺伝子 (DNA) から 転写された、タンパク質の配列情報をコードするRNAです。
原核生物のmRNAは転写が始まるとすぐにリボソームが結合してタンパク質の翻訳を開始します。一方、真核生物のmRNAは核内で転写されると、RNAキャップ形成やポリアデニル化、スプライシングなどのRNAプロセシングを受けます。プロセシングを受けた成熟mRNAは核外に輸送されタンパク質に翻訳されます。
後述のようにmRNAはタンパク質のアミノ酸配列をコードするORFの他、5'Cap、5'-UTR、3'-UTR、polyAなどの要素があり、それぞれが翻訳効率や安定性、細胞に導入した際の免疫原性などに影響を与えます。
mRNAの構成要素
プロセシングを受けた成熟mRNAは一般的に以下のような配列で構成されています。

5'Cap
5'CapとはmRNAの5'末端に付加される化学修飾であり、多くの真核生物ではメチル基をもつグアニンがmRNAと5'-5'結合をしています。5'Capにはリボソームを呼び寄せ、翻訳を促進させる機能やmRNAを安定化させる機能などがあると言われており、in vivoにおける翻訳では5'Capの有無によって翻訳の効率が大きく異なります。
5'Capは転写開始後すぐに付加され、転写が完了する前には終了します。in vitroでmRNAを合成する場合は転写合成の反応液に、キャップ化に必要な修飾塩基 (キャップアナログ) を添加することで、5'Capが形成されます。またウイルス由来のキャップ化酵素を利用してmRNAに5'Capを付加することも可能ですが、酵素を使用する場合はコストが高くなります。
またmRNAの先頭にある塩基のリボースの2'-ヒドロキシル基 (下図の赤丸部分) がメチル化されていない構造をCap0と呼び、メチル化された構造をCap1と呼びます。Cap1はCap0と比較してin vivoにおける翻訳効率が向上しており、また宿主による免疫応答も回避することができます。当社ではCap1構造をもつTriLink社独自のキャップアナログである CleanCap®と、 CleanCap®でキャッピングされた各種mRNA (CleanCap® mRNA) を取り扱っております。
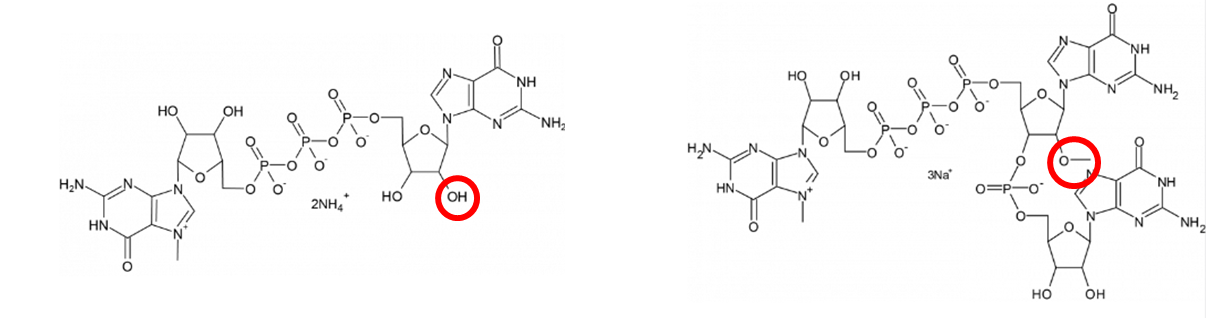
Cap0とCap1の構造
左:mCap (Cap0) 右:CleanCap (Cap1)
5'-UTR
5'-非翻訳領域 (5'-Untranslated region/5'-UTR) はmRNAの翻訳領域の上流にあるタンパク質のアミノ酸配列をコードしていない (=翻訳されない) 領域です。真核生物では5'Capに呼び寄せられたリボソームやその他翻訳開始因子が5'-UTR上を移動しながら開始コドンを探すと言われており、この領域は翻訳の制御に関与していると考えられています。
ORF
オープンリーディングフレーム (Open Reading Frame/ORF) はmRNAの内、開始コドンから終始コドンまでのタンパク質に翻訳される領域を指します。
3'-UTR
3'-非翻訳領域 (3'-Untranslated region/3'-UTR) はmRNAの翻訳領域の下流にある非翻訳領域です。この領域はmRNAの安定性に関わるとされており、タンパク質合成量を決定する要因の1つです。
polyA
polyAとは転写されたmRNAの3'末端に付加されるアデニン(A)の反復配列です。polyAは翻訳領域の下流に存在しますが、翻訳開始因子を集める役割があります (真核生物のmRNAは5'末端と3'末端が近接した環状構造をとります)。また5'Capと同様、mRNAの安定性を高める役割もあります。通常、polyAの長さは数百bp程度と言われています。
mRNAの医薬・ワクチンへの応用
mRNAは細胞質でタンパク質に翻訳されるため、核への送達する必要がなく、ゲノムに挿入されるリスクも少なく比較的安全な核酸医薬と考えられています。さらにmRNAはin vitro転写合成により生産できるため、細胞を使わないこともメリットです。
医薬だけでなくウイルスの抗原タンパク質をコードしたmRNAをワクチンとして使用する研究開発も活発になっています。特に自己増殖性RNA (self-amplifying RNA)のよるワクチンは、文字通り自己増殖できるため、発現期間が長く、効果的に自然免疫を刺激できます。当社では自己増殖性mRNAに最適化されたTriLink社のキャップ化試薬 CleanCap® AUを取り扱っております。
一方で、RNAはDNAに比べると不安定な物質であり、生体内に投与しても多くは標的部位まで送達する前に分解されてしまうという課題があります。投与後の安定性を高めるためにmRNAへ修飾塩基を組み込んだり、脂質ナノ粒子 (LNP) などの薬物送達システム (Drug Delivery Systems/DDS) と一緒に投与するなどといった試みがなされています。
当社ではTriLink社のmRNA受託合成サービスも取り扱っております。CleanCap®によるキャッピングや、ご指定の修飾塩基を組み込んだmRNAの合成が可能です。GMPに対応した製造設備も有しており、医薬品やワクチンを見据えた研究開発にも対応することができます。
mRNA医薬・mRNAワクチンの課題とRNA修飾
mRNA医薬・mRNAワクチンとは、生体内で目的とするタンパク質や抗原を発現させ、疾患の治療や予防に用いられるmRNAのことをいいます。発現したタンパク質が疾患の治療・予防効果を示すという点においては、DNAを用いた遺伝子治療やDNAワクチンと同じです。異なる点としては、mRNAは細胞核への輸送が不要であることからゲノムへの挿入変異リスクが少ない点、また、翻訳のみが行われることからmRNAの投与からタンパク質発現までの時間が短いといった点があり、これらはmRNA医薬・mRNAワクチンの大きな利点といえます。一方mRNA医薬・mRNAワクチンの課題として、mRNAが不安定で分解を受けやすいこと、そして、mRNA自体が免疫原性を持つことが挙げられます。そのために、mRNA医薬の実用化には高いハードルがあるとされてきました。
生体内に投与されたmRNAは、細菌やウイルス由来の外来由来の核酸分子を認識するToll様受容体 (TLR) を刺激し、それによって炎症反応を惹起します。mRNAの免疫原性を低減させるための手段のひとつに修飾ヌクレオシドの利用があります。真核生物においては、RNAの一部のリボースや塩基が修飾を受けていることはすでに知られており、これまでに100種類以上ものRNA修飾が報告されています。RNA修飾の役割については、RNAの立体構造の安定化や細胞内局在などに寄与しているとされていますが、未解明な部分もあります。
こうしたなか、2005年にKarikóらのグループはmRNAを構成する塩基を5-メチルシチジンやN6-メチルアデノシン、シュードウリジンなどの修飾ヌクレオシドに置換することで、TLRを介した免疫反応が低減することを見出しました 4)。さらに2008年には、シュードウリジンに置換したmRNAにおいて、タンパク質への翻訳効率が大幅に向上することを報告しました 5)。その後も様々な修飾ヌクレオシドの探索が行われており、COVID-19に対する一部のmRNAワクチンでは、シュードウリジンに置換したmRNAよりもさらに翻訳効率が向上した1-メチルシュードウリジンが使用されています 6)。
当社では化学合成したシュードウリジンおよび1-メチルシュードウリジンを取り扱っております。
mRNAの合成法
mRNA医薬・mRNAワクチンのような長鎖RNAを合成するためには、酵素反応を利用したin vitro転写合成という手法が一般的に用いられます。直鎖の二本鎖DNAを鋳型として、mRNAの構成要素であるヌクレオシド三りん酸とRNAポリメラーゼという酵素を用いてmRNAに転写していきます。RNAポリメラーゼはDNA上のプロモーター領域と呼ばれる部分に結合し、5’側から3’側へ向かいながら、DNAの片側の鎖を鋳型として相補的なヌクレオシド三りん酸を次々につなげていき、mRNAを合成します (図1)。
in vitro転写反応で合成したmRNAにはキャップ構造がないため、合成過程でキャップ構造を付加する必要があります。キャップ構造を付加する方法としては、転写後にキャッピング酵素を用いて付加する方法と、転写反応段階でARCA (anti-reverse cap analog) などのキャッピングアナログを加える方法があります。ARCAを用いる方法では転写とキャッピングの両方を一段階で行うことが可能であり、簡便にキャップ構造を付加することができますが、キャッピング効率が低いことが課題として挙げられています。こうした課題に対して、キャッピング効率が向上した新たなキャッピングアナログが開発されています。当社で取り扱っているTriLink社のClean Cap® Reagentは、対象のmRNAにキャッピング (Cap 1構造) を付加する試薬で、高いキャッピング効率でより高活性のmRNAを合成することが可能です。
参考文献
- Bruce Alberts他 著, 中村桂子 松原謙一 監訳, Essential細胞生物学 原書第2版, 南江堂, 2005
- James D, Watson他 著, 中村桂子 監訳, ワトソン遺伝子の分子生物学 第7版, 東京電機大学出版局, 2017
- 横田隆徳 編: 「実験医学 核酸医薬 本領を発揮する創薬モダリティ」, (羊土社) (2021)
- Karikó. K et al. : Immunity , 23, 165 (2005).
- Karikó. K et al. : Mol Ther ., 16 (11): 1833 (2008).
- Corbett, KS. et al. : Nature, 586 (7830), 567 (2020).





