【総説】再生研究における細胞単離用抗 CPM 抗体の活用
本記事は、和光純薬時報 Vol.87 No.1(2019年1月号)において、京都大学大学院 医学研究科 呼吸器疾患創薬講座 後藤 慎平様に執筆いただいたものです。
はじめに
ヒト多能性幹細胞(ES および iPS細胞)が誕生して以来、様々な臓器細胞に分化させる技術が確立され、再生医療もようやく現実的なものになりつつある。特にヒト iPS 細胞を用いた網膜色素変性症の細胞移植治療に加え、重症虚血性心筋症やパーキンソン病に対する臨床研究・治験も始まろうとしており、呼吸器を含むその他の臓器の再生医療についても期待が高まっている。
まだ基礎的な研究の域ではあるが、人工気管の研究 1)や、脱細胞化肺を用いた肺の臓器再生研究 2)は臨床工学的な視点も組み合わせて研究が進められており、一定の成果を収めてきている。これらの研究においては近い将来、臨床応用に向けてヒト由来の細胞が必要となる。
再生医療において細胞の供給方法が重要なことは言うまでもないが、特にヒト多能性幹細胞を用いた再生医療では、安全性、機能性、確実性が求められ、優れた分化誘導法はこれらすべてに関わる必須技術と言える。ヒト多能性幹細胞は培養皿内での分化誘導を基本とするが、多くの臓器細胞において発生学の知見が大いに参考となってきた。
肺は内胚葉臓器であるが、ヒト多能性幹細胞から内胚葉系臓器細胞への分化誘導において最初のマイルストーンは、2006 年にさかのぼり、ヒト ES 細胞から膵臓β細胞への分化誘導について、発生の段階を培養皿内で再現することが有効と報告されたことに始まる 3)。以降は、肝臓 4)や腸管細胞 5)など他の内胚葉系臓器細胞の分化誘導においても発生学的な段階を再現して分化を促進することが合理的と報告されたが、肺への分化誘導法の研究成果の報告は遅れ、2011 年になってようやく内胚葉から肺に向かう第一歩となる前方前腸への分化誘導法が初めて報告された 6)。
呼吸器細胞の分化誘導法の開発経緯
肺は一見複雑に見える構造をしているが、規則正しく分岐する精細な気管支の枝で構成された気道領域と末梢に位置し数億個の肺胞からなる肺胞領域に大きく分けることができる。前者は異物や病原体の除去、後者はバレーコートの半面分ともされる十分な表面積を確保してガス交換の役割を担っている。
肺を構成する細胞には上皮細胞のほかにも線維芽細胞や免疫細胞、血管内皮細胞などの多種類の細胞が挙げられるが、外界と接する上皮細胞が、その他の細胞との相互作用を通じて、発生過程や様々な呼吸器疾患の病態において重要な役割を果たすことが示唆され、気道および肺胞上皮細胞を用いた病態モデリングが期待されてきた。
これまでこういった研究には遺伝子改変マウスを用いた病態モデルが中心的役割を果たしてきたが、ゲノム背景の違いなどから必ずしもヒトの病態を反映しない可能性も明らかとなってきている。特に近年は細胞に立体構造を形成させて培養する「ミニ臓器」とも表現されるオルガノイド培養の研究が進み、生体組織から得られるデータとの整合性も検討されつつあることから、ヒト由来細胞とオルガノイド培養を組み合わせた疾患モデリングが期待されるようになっている 7)。
従来の呼吸器分野では、上述の臓器再生や疾患モデリングの検討に使えるヒト由来細胞が限られており、がん細胞を由来とする細胞株は依然重要なツールではあったものの、本来の細胞機能の多くが失われており、本来の細胞機能を再現するには組織から回収できる初代細胞を入手してオルガノイド培養を行なう必要があった。初代細胞の入手のためには、本邦では倫理的な問題を避けるため、肺がんのため一定の術式に沿った肺切除がやむを得ない場合に、診断に影響しないレベルで臨床検体から、わずかな健常細胞を得るよりほかは難しく、肺胞上皮細胞については未だに長期培養する技術も確立されていなかったことから、研究を進めることは容易ではなかった。
ヒト多能性幹細胞はこうした細胞供給の問題を解決できる可能性が期待されている 8)。また、末梢血があればヒト iPS 細胞の樹立が可能なため、稀少疾患であっても採血さえ協力を得ることができれば、iPS 細胞を樹立することができ、そこから肺に分化させ疾患病態を再現できる可能性がある。こういった背景のもと、ヒト多能性幹細胞から呼吸器細胞への分化誘導法が期待されてきた 9)。
分化誘導におけるCPM抗体の有用性
次に分化誘導法について述べる。肺は発生学的に内胚葉、前方前腸と分化した後、前方前腸の一部に「腹側化」が起こり、将来の肺を構成する芽となる細胞成分が出現したところから発生する。この時に肺の代表的な分化マーカーの1つである NKX2.1(TTF1)が発現することが目印となる 10)。
培養皿内でヒト多能性幹細胞から分化誘導した前方前腸をいかに効率よく「腹側化」させるかが重要となり、多くの研究者によって試みられてきたが、筆者らはトレチノイン(ATRA)、BMP4、CHIR99021 の濃度の組み合わせによって「腹側化」の条件を整えることに成功した 11)。この ABC 三因子によって「腹側化」の条件を最適化すると細胞株によっては 80% 程度のNKX2.1 陽性率を得ることができた。
しかし、分化効率は細胞株によって一定なものではなく、せいぜい 50% 程度しか NKX2.1 が陽性にならない細胞株もあり、その後の分化誘導を安定したものにするためには NKX2.1 陽性細胞だけを単離する方法が必要になった。
筆者らは当初、NKX2.1 が陽性になると蛍光を発するレポーター細胞を作ろうとしたが、特異的な表面抗原を見つけた方が細胞株ごとにレポーター細胞を樹立しなくても済むため、方針を変えて表面抗原の同定に取りかかった。
そこで筆者らはヒト iPS 細胞から分化させた前方前腸と効率よく「腹側化」させた後の細胞からそれぞれRNA を抽出し、網羅的遺伝子発現解析で比較し、複数の候補となる表面蛋白質を同定した。NKX2.1 陽性細胞における発現を免疫染色で順番に調べていったところ、GPI アンカー型蛋白質として細胞表面に存在すると報告されていた Carboxypeptidase M(CPM)が、NKX2.1 とよく共発現することが分かり、CPM 抗体で標識すればNKX2.1 陽性細胞を単離できることを見出した。単離した細胞は、細胞外基質(マトリゲル)のなかで培養すると三次元構造を形成し、培養条件を変えることで気道上皮細胞にも肺胞上皮細胞にも分化促進できることが分かった (図 A)。
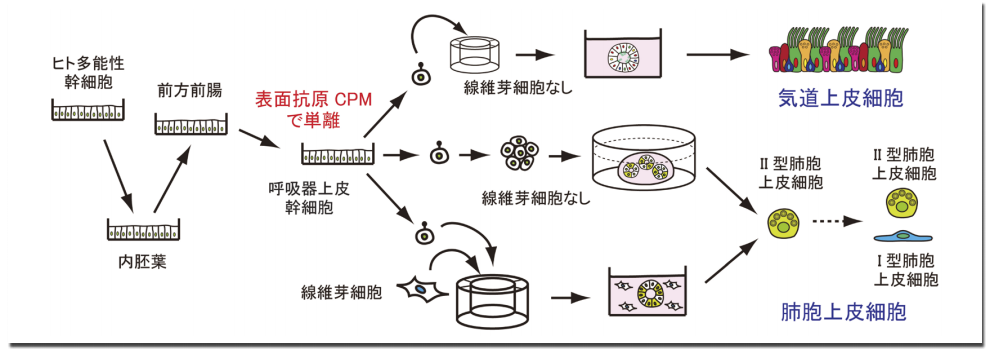
図 A.ヒト多能性幹細胞から呼吸器細胞への段階的分化誘導
気道上皮細胞に分化させたい場合は FGF10 や古典的 Wntシグナル経路を刺激するGSK3β阻害剤である CHIR99021 などを含む培地で培養し、オルガノイドがある程度育ってから初代細胞用の市販培地に切り替える 12)。すると繊毛細胞だけでなく粘液産生細胞、クラブ細胞、基底細胞、神経内分泌細胞など代表的な気道上皮細胞成分が含まれる気道上皮細胞に効率よく分化し、繊毛運動が観察され主たる機能である粘液繊毛輸送能を有することも証明された 12)。
次に、肺胞上皮細胞に分化させたい場合は、研究用に市販されている胎児肺由来の線維芽細胞と共培養を行ないながら、肺胞への分化促進作用があるDexamethasone や KGF(FGF7)などを含む培地で培養する 11)。当初、肺胞の組織幹細胞であるⅡ型肺胞上皮細胞への分化効率は 10 - 15%と低かったが、「腹側化」のあと、CHIR99021、FGF10、KGF(FGF7)、Notch シグナル経路を阻害するγセクレターゼ阻害剤 DAPT を含む培地で1 週間培養する段階を加えた 13)。
その後、NKX2.1 陽性細胞を単離し胎児肺線維芽細胞との三次元共培養を行なうと、Ⅱ型肺胞上皮細胞への分化効率は50%程度にまで上昇することを見出した。また、Ⅱ型肺胞上皮細胞は肺サーファクタントの主成分であるリン脂質を細胞外から取り込む機能を持つが、蛍光標識したリン脂質を培地に加えるとⅡ型肺胞上皮細胞のラメラ体に集積することから機能的なⅡ型肺胞上皮細胞に分化できていることを確認した 13)。
さらに NKX2.1 陽性細胞を単離したあと、胎児肺線維芽細胞との共培養をしなくても CHIR99021、SB431542 などの組成を含んだ培地で三次元培養をすると一定の割合でⅡ型肺胞上皮細胞に分化することが証明できた 13)。
今後の展望
以上より、NKX2.1 陽性細胞を表面抗原 CPM で単離することにより、ヒト多能性幹細胞から機能的に成熟した気道や肺胞上皮細胞に安定的に効率よく分化誘導できる方法が確立できたと筆者らは考えている。海外からも気道や肺胞上皮細胞を分化誘導できたとする報告が蓄積されつつあるが、肺に分化する NKX2.1 陽性細胞を表面抗原を用いて単離する方法として報告されてきたのは CPM 以外には、最近報告された CD47highCD26low で単離する手法のみである 14)。
様々な分化誘導法が報告されてきたが、今後真価が問われるのはいかに応用が可能かであり、異なる細胞株であっても目的の細胞まで安定的に分化誘導できる表面抗原を利用した筆者らの分化誘導技術は必ず役立つと確信している。今後展開が予想されるのは、これまで実験動物では実現の難しかった疾患病態モデルの開発であり、特に稀少な難治性呼吸器疾患についてヒト iPS 細胞を用いた研究が活発になるであろう。
また、ヒト多能性幹細胞を用いた細胞移植、人工気管、脱細胞化肺などの臓器再生の技術開発、薬剤や喫煙や環境汚染物質への曝露に対する肺毒性試験といった多岐にわたる応用が予想される。
謝辞
最後に述べておきたいこととして、NKX2.1 陽性細胞の表面抗原として筆者らが CPM を同定してまもなく、当時某社で市販され細胞単離に使えていた唯一の抗 CPM モノクローナル抗体は一斉に販売中止となってしまった。残っていた抗体でしのぎながら当初独自で CPM 抗体の開発に着手したがなかなかうまくいかず、当時の和光純薬工業株式会社(現 富士フイルム和光純薬㈱)が細胞単離に使える抗 CPM抗体の開発を快諾していただいたことで、結果的に筆者らの研究は滞りなく前進することができた。
筆者らは現在、以前と同等の細胞単離ができるように開発された抗 CPM モノクローナル抗体(WK)を用いて肺の分化誘導研究を続けることができている(図 B)。この場を借りて御礼申し上げたい。
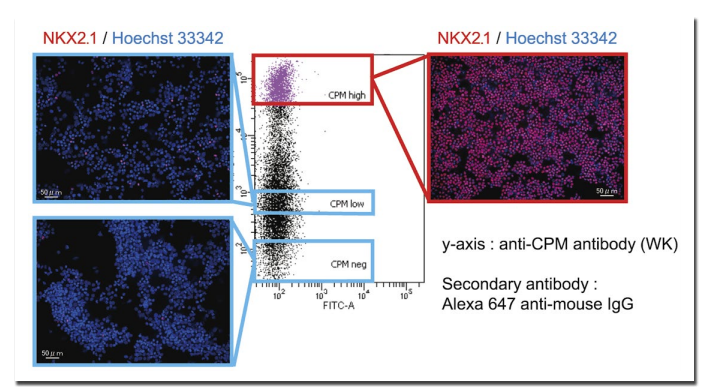
図 B.CPM 抗体(WK)を用いた呼吸器上皮幹細胞の単離
キーワード
多能性幹細胞
三胚葉すべての体細胞に分化できる能力があり、ES 細胞や iPS 細胞の総称。
GPI アンカー型蛋白質
翻訳後の蛋白質C末端に糖脂質であるGPI 基の修飾を受けて細胞膜表面に結合した蛋白質。ヒトには150種類程度のGPI アンカー型蛋白質が存在し、様々な役割を果たしている。
ES 細胞
胚盤胞の内部細胞塊から樹立される細胞株。1981 年に Evans 博士らによって初めて報告された。
iPS 細胞
体細胞に複数種類の遺伝子を発現させることで分化多能性と自己複製能を獲得した細胞。2006年に山中博士らによって初めて報告された。
参考文献
- Sakaguchi, Y. et al. : J. Thorac. Cardiovasc. Surg., 156, 1264 (2018). DOI: 10.1016/j.jtcvs.2018.04.073
- Nichols, J. E. et al. : Sci. Transl. Med., 10, eaao3926 (2018). DOI: 10.1126/scitranslmed.aao3926
- D'Amour, K. A. et al. : Nat. Biotechnol., 24, 1392 (2006). DOI: 10.1038/nbt1259
- Sullivan, G. J. et al. : Hepatology, 51, 329 (2010). DOI: 10.1002/hep.23335
- Spence, J. R. et al. : Nature, 470, 105 (2011). DOI: 10.1038/nature09691
- Green, M. D. et al. : Nat. Biotechnol., 29, 267 (2011). DOI: 10.1038/nbt.1788
- Nikolić, M. Z. et al. : Development, 145 (2018). DOI: 10.1242/dev.163485
- Yiangou, L. et al. : Cell Stem Cell, 22, 485 (2018). DOI: 10.1016/j.stem.2018.03.016
- Somers, A. et al. : Stem Cells, 28, 1728 (2010). DOI: 10.1002/stem.495
- Kimura, S. et al. : Genes & Dev., 10, 60 (1996). doi: 10.1101/gad.10.1.60
- Gotoh, S. et al. : Stem Cell Reports, 3, 394 (2014). DOI: 10.1016/j.stemcr.2014.07.005
- Konishi, S. et al. : Stem Cell Reports, 6, 18 (2016). DOI: 10.1016/j.stemcr.2015.11.010
- Yamamoto, Y. et al. : Nat. Methods, 14, 1097 (2017). DOI: 10.1038/nmeth.4448
- Hawkins, F. et al. : J. Clin. Invest., 127, 2277 (2017). DOI: 10.1172/JCI89950





