【総説】新しい抗体希釈・反応用溶液AbScale-Gを用いた3次元免疫染色
本記事は、和光純薬時報 Vol.93 No.2(2025年4月号)において、国立研究開発法人理化学研究所・脳神経科学研究センター・細胞機能探索技術研究チーム 濱 裕様、宮脇 敦史様に執筆いただいたものです。
この度、筆者らは3次元免疫染色技術であるAbScale法(Hama et al., 2015)における抗体希釈・染色用溶液の改良を行い、新たにAbScale-G液を開発した。これにより抗体の固定組織内部への浸透性を向上させることが可能になった。
本稿ではその特徴を概説し、蛍光ラベルされた抗体を用いた免疫染色(以下、単に免疫染色と表現する)の例を紹介する。
多くの生体組織は自然な状態では色がついていない。免疫染色は、組織内の特定の生体分子や細胞種の空間分布を知るための強力な手段である。これまで、免疫染色の多くは薄い組織切片を用いて行われ、2次元の画像として描出されてきた。2次元という限られた情報から想像力を膨らませ、組織構造や生体分子の配置について3次元画像を構成することで理解する努力を払ってきた。
こうした免疫染色をリアルな3次元に拡張することで、血管の網目構造や、その裏側に隠れた構造物を、多角的に捉えることができると考えられる。
AbScale法による3次元免疫染色技術は、数mmの厚さのマウス大脳スライスなど、厚みがある組織標本に蛍光標識抗体を浸透させ、さらにScale法により透明化して、共焦点レーザー顕微鏡などを使って蛍光シグナルを3次元的に再構成する方法である。光軸方向に沿って、数ミクロン厚の2次元画像情報をおよそ数百~数千枚分積み上げることに相当する。
染色の際に問題になるのが、抗体の標本内部への浸透である。そのパフォーマンスは抗体ごとにかなり異なる。AbScale-G液は、そうした抗体ごとの浸透性の違いをできるだけ抑え、固定組織内部に抗体を均質に浸透させるための成分を組み合わせた水溶液である。以下にAbScale-G液による3次元染色例を挙げる。
AbScale-G液を用いたアダルトマウス(C57BL6/J)由来大脳スライス皮質部の3次元免疫染色(二重染色)の正立型共焦点レーザー顕微鏡による観察例を図1に示す。免疫染色は、いずれも、蛍光標識1次抗体を用いる直接法を採用した。まず、ミクログリアマーカーの抗Iba1抗体(RF635標識ウサギポリクローナル抗体、富士フイルム和光純薬 013-26471)(図中、緑)は、スライスの断面画像(図1の左右の抗Iba1抗体染色画像)からわかるように、約2.5 mmの厚みに関わらず、標本内部への浸透性が良好であることが解る。アストロサイトマーカーの抗GFAP抗体(Cy3標識)(図中、赤)についても、同様の均一染色が確認されている。抗GFAP抗体(Cy3標識)については、初期型の抗体希釈·染色用溶液(AbScale-O)を用いた実験を併せて行ってみたが、スライス断端での抗体の濃縮(スタック)が顕著で組織内部の染色性が不均一であると結論された。
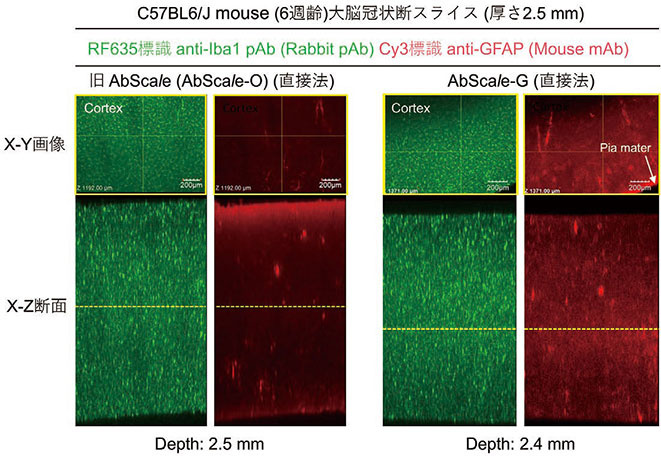
図 1.脳スライス免疫染色における旧AbScale(AbScale-O)solutionとAbScale-G solutionとの比較
図2に、脳スライス(厚さ1〜2 mm)を用いた場合の標準的な染色手順を示す。Step 1.からStep 6.までは、固定された組織構造を柔らかくほぐす過程である。蛍光標識抗体が組織内部に侵入する隙間を作るための前処理である。
本染色法は大脳半球などを対象にすることが可能である。しかしながら、実際には、ⅰ)基本的に観察に多くの時間あるいは特別な顕微鏡が必要であること、ⅱ)観察で得られるデータ量の大きさから解析に多大な時間と労力を要すると予想されること(例えばマウス脳全体の観察を行った場合、観察の仕方によって異なるが、一種類の抗体染色についても、データ量は数十〜百GBを下らない)などの問題に直面することが想定される。さらに、またⅲ)脳スライスを対象にする電気整理実験で、実験後の免疫染色で構造を確認するような場合を考慮し、より現実的な労力で3次元画像を得ることが可能な厚み1〜2 mm程度のスライスを対象にしたいと考えている。

図2.厚さ1 〜2 mmの大脳スライスについてのAbScale-G の標準プロトコール(直接法)
図3はSaito et al. (2014) によって開発されたアルツハイマー病モデルマウスの系統の一つであるAppNL-F/NL-Fマウス(20か月齢)個体から調製した大脳スライス(厚さ2 mm)をAbScale-G液(間接法)を用いて観察した例である。正立型共焦点レーザー顕微鏡で得られた画像データからVolocity(Parkin Elmer)というsoftwareで3次元再構成を行なった大脳皮質―海馬領域の間接法による二重染色画像を示した。抗Amyloid-β抗体(図中、緑)と抗リン酸化MARCKS (PKC基質タンパク)抗体(図中、赤)のシグナルが描出されている。詳細は割愛するが、特に大脳皮質に多量のamyloid plaqueの存在が認められ、一部にphosphorylated MARCKSシグナルの共局在を立体的に確認することができる。このように、数mmのスライスの3次元免疫染色からでもかなり大ボリュームの組織情報を得ることができる。
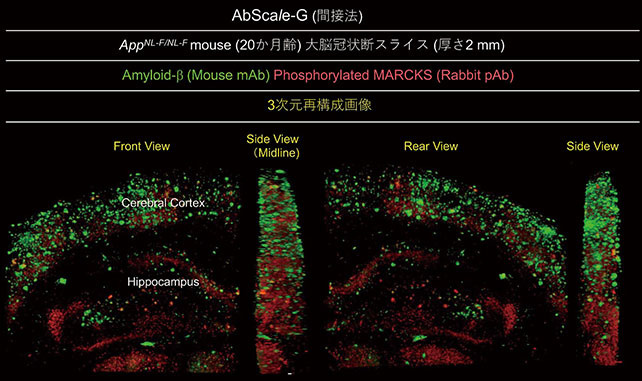
図3.アルツハイマー病モデルマウスにおける脳スライスのAbScale-G solution を用いた免疫染色3次元画像
(スライスを水平⽅向に回転させた)
また、より簡便な3次元免疫染色として図4にAppNL-F/NL-Fマウス(87週齢)由来大脳凍結切片(厚さ60μm)の皮質部血管周囲のamyloid plaqueについて染色(間接法による三重染色)し、倒立型共焦点レーザー顕微鏡で観察を行った例(間接法)を示す。
アストロサイトのendfeetに発現するwater channel Aquaporin-4 (図中、緑)で縁取られた脳微小血管が縁取られる様子、それに近接するペリサイト(CD13)(図中、青)にamyloid plaque(図中、赤)が取り付いている様子が確認される。常用される切片の免疫染色では抗体の浸透が切片表面から十数μm程度にとどまる場合がほとんどであるが、ここでは3つの1次抗体および3つの2次抗体のすべてが組織内部に浸透し染色が実現されていることがわかる。こうした50〜100μmの厚みの凍結切片の染色をわれわれはSemi-AbScaleと呼称している。
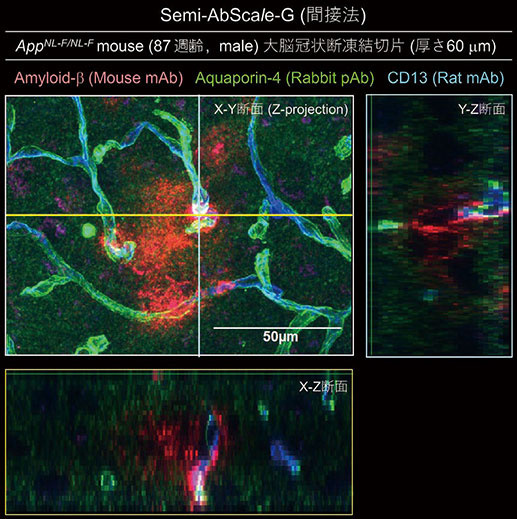
図4.アルツハイマー病モデルマウス凍結切片のSemi-AbScale-G による染色画像
図5に脳組織についての標準的なSemi-AbScaleの手順を示した。この方法で染色を行った組織は広く使用されている倒立型共焦点レーザー顕微鏡で比較的手軽に観察することが可能である。

図5.厚さ50 〜100 μm の凍結切片のSemi-AbScale-G の標準プロトコール(直接法による浮遊染色)
今回は脳組織についての使用例を示したが、他の臓器組織にも応用が可能である。特に心・腎などの比較的硬い組織のスライスの場合は前処理の過程にある図2 Step 3.〜Step 5. のSCALEVIEW-A2とScale B4(0)による処理時間を2倍にするなど、前処理の時間については組織の性質に応じた条件調整を行うことで対応することが可能である。
近年様々な組織透明化法が報告されている(Gómez-Gaviro et al., 2020)。本法は基本的にScale法という組織透明化法にリンクした方法であるが、他の組織透明化法との組み合わせも十分可能であると考える。本法を使われた研究者の方々からそうした事例に関するフィードバックをいただけたら幸甚である。
参考文献
- Gómez-Gaviro, MV. et al. : iScience, 23(8), 101432(2020).
- Hama, H. et al. : Nat. Neurosci., 18(10), 1518(2015).
- Saito, T. et al. : Nat. Neurosci., 17(5), 661(2014).




