【特別講座】CTX-ELISA 1Bの開発物語
本記事は、ChemGrowing Vol.07 (2018年12月号)において、東北大学名誉教授・(株)アクロスケール 平間正博 様に執筆いただいたものです。
はじめに
科学研究の中でも特に化学は、「興味あるもの」を「創りたい・発見したい」、という「好奇心・志」から始まり、「時・地の利・人の和(輪)」がうまく協働した時に、大きく進展すると思います。私がシガトキシンの抗体を作ってシガトキシンを検出するキットを作りたいと考えたのは、ほぼ30年前です。ちょうど研究室を担当して、新しい全合成研究、しかも人々の役に立つ技術開発につながるような研究をやりたい、と考えた時でした。それが沢山の研究者のおかげで、CTX-ELISA 1Bとして結実するまでの経緯を振り返ってみます。
サンゴ礁海域で起こる海産物中毒(シガテラ)の毒素シガトキシン(図1)の毒性は、フグ毒テトロドトキシンの約百倍。少なく見積もっても世界で毎年5万人以上が中毒しています1-3。日本でも沖縄を中心にして発生しますが、最近では関東付近でも起きています。
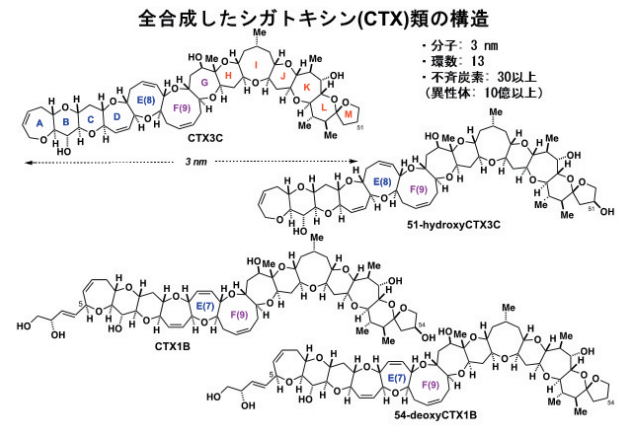
図1. シガトキシン類

図2. シガテラ中毒を起こす代表的な魚
安元 健(元)東北大学農学部教授がタヒチの研究者と協力して、4トンのウツボからシガトキシンCTX1Bを0.35 mg単離しNMRを駆使して1989年に分子構造を決定しました4。そして、シガトキシンを作るのは、魚ではなくプランクトンの一種の渦鞭毛藻であり、食物連鎖で肉食魚(図2)に蓄積されることも明らかにしました1。
シガトキシンは多種類の魚に含まれ、肝臓以外の筋肉にも蓄積します。したがって、魚肉を食べても中毒します。無味無臭で、煮ても焼いても壊れません。しかし、1匹の魚に含まれる毒の総量が少ないので、幸い致死量には至らないのです。
症状的には下痢や嘔吐から始まり、心拍数や血圧の低下、しびれ、めまいや極度の倦怠感、温度感覚もおかしくなります。水に触ってもドライアイスに触ったような痛さ、電気ショックを受けたような衝撃をうけると言います。人によっては、このドライアイスセンセーションが数か月から1年以上も続きますので患者さんにとっては深刻です。しかし、効果的なシガトキシンの簡易検出法や治療法はありませんでした2-5。
シガトキシン全合成研究の開始と抗体作製の試み
まだシガトキシンの分子構造が分からなかった1989年初め、最新のNMRを用いて構造研究をしていた安元研究室の村田道雄助手(現、大阪大学教授)から、「部分構造を確認したいのでシガトキシンの推定部分構造を合成してくれないか」という申し出を受けました。これが、私達がシガトキシンの合成研究を始めたきっかけです。
私はこの時初めてシガテラ中毒や村田博士を知ったように記憶しています。実は、村田博士は、私が米国留学後3年間勤めた(財)サントリー生物科学研究所で2年間働いていたのです。しかも研究所で私の隣の実験台にいた女性研究員が村田夫人になって仙台に来ていました。そんな縁で村田博士が私に声をかけてくれたのだと思います。
しかし、当時の私達の研究室の化学合成力は未熟でしたから全然役に立ちませんでした。安元・村田両博士は半年も経たないうちにシガトキシンの分子構造を決定しました(図1)4。その構造を見て興奮しました。13個の環がはしご状につながった長さ3 nm以上の巨大分子です。当時はこのように大きく複雑な分子を誰も合成したことがありませんでした。私達も全合成できる自信はありませんでしたが、とにかくやってみたい、誰もやっていないことに挑戦したい、という気持ちでいっぱいでした。
一方、ハワイ大学のHokama博士は、シガトキシンの分子構造が分かる前に天然のシガトキシンそのものを使って抗体を作る研究を進めていました。当時、博士達は、シガトキシンはカルボン酸だと考えていたので、シガトキシンとタンパク質を脱水縮合剤と混合すればコンジュゲートができると考えました。そして、その混合物をマウスに免疫させて抗体が得られたのです。
さらにその抗体を使ってCigua-Checkというシガトキシンを検出するキットを開発しました。しかし、そのキットは、特異性が低く、抗体自体に疑問が持たれるようになっていました3。
抗体は、抗原と結合する際、その全体を認識する訳ではなく抗原の比較的小さな一部分のみを認識して結合します。そこで私達は、猛毒のシガトキシンそのものを使わずに、一部分を合成してその部分を確実に認識する抗体を作ろう、その抗体は、同じ部分構造を持つシガトキシンにも結合するはずだからシガトキシン抗体になるのではないかと期待したのです。
マウスを使って低分子の抗体を作るためには、低分子を分子量が大きなタンパク質に結合させて抗原として認識されやすくしてやる必要があります。1992年には、CTX1Bの簡単なAB環モデルが合成できたので、牛血清アルブミンや卵白アルブミンに結合させました。
早速、安元先生の仲介で、タヒチのルイマラルデ医学研究所がマウスを使った免疫実験(抗体作製)の共同研究を開始してくれました。タヒチに送って半年後、マウスの血清中に抗体ができていることは分かりましたが、抗体産生率が低く、モノクローナル抗体を得ることはできませんでした。そして困ったことに、タヒチとは離れているので(まだ、電子メールは現在のようには普及していませんでした)、研究連絡、打ち合わせや実験結果の検討を迅速・緻密にできないのが悩みでした。
そうこうしているうちに、1993年5月に花王基礎科学研究所で抗体触媒の研究を開始した円谷 健博士から研究所で講演をしてくれるように頼まれたのです。それまで円谷博士とは面識がなかったのですが、私と同じように博士研究員として米国MITの正宗 悟研究室で研究して帰国したばかりで、正宗研の同門という縁です。
円谷博士は低分子の抗体作製のプロです。講演後、早速、シガトキシン抗体開発の協力をお願いし、共同研究が始まりました。しかし、当時は、まだシガトキシンの合成研究が余り進んでおらず、AB環モデルの抗原を使った免疫は良い結果を与えませんでした。そして、円谷博士から抗原のタンパク質は、KLHという貝の色素タンパク質に変えた方がよいと教えられました。
3環(ABC)モデルが合成できてマウス免疫を進めていたところ、円谷博士は花王基礎科学研究所から生物分子工学研究所への異動が決まり、円谷博士との共同研究は一時中断します。私は、シガトキシンの研究のほかに、石田名香雄東北大総長(当時)が発見した抗がん剤ネオカルチノスタチンの全合成研究をしていた縁で、石田総長主催の学部横断型研究会(TURNS)に参加していました。
石田総長から東北大学病院薬剤部長水柿道直教授を紹介されます。水柿教授も快く抗体開発に協力してくれましたが、合成抗原が悪いためなかなか良い抗体ができずに日が過ぎました6。
全合成完成と抗体作製の成功
そして、研究が飛躍的に進むきっかけが2000年にやってきます。12月末のハワイ・環太平洋国際化学会議のホテルの廊下で、会議室から喫煙のために出てきた生物分子工学研究所の藤井郁雄博士に偶然会ったのです。藤井博士とは以前、仙台のBarで会って一緒に酒を飲んだことがありましたが、円谷博士が参加した研究所のグループ長だったのです。
シガトキシン抗体の現状を話すと、円谷博士と一緒に抗体開発研究を手伝ってくれるというではありませんか。私達のシガトキシン全合成研究もこの頃にはどんどん進展し、2001年春にはCTX3Cの2環構築型収束的全合成が完成しました(図3)7。
この全合成法は、全合成中間体を無毒のハプテンとして用いることができる意味でも非常に優れた合成法になりました。
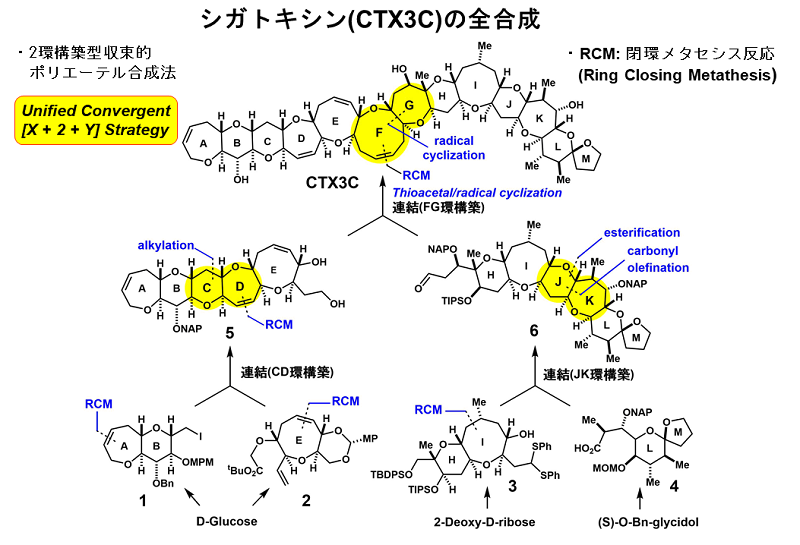
図3. シガトキシンCTX3Cの2環構築型収束的全合成
こうして、4環(ABCD)や5環(ABCDE)化合物・KLH人工抗原が速やかに合成できるようになると同時に、藤井・円谷両博士も2003年10月には大阪府立大学に教授・准教授として移り、より自由に共同研究できる環境になりました。研究費も文科省や科学技術振興事業団(JST)から十分に受けられることになり、抗体開発研究はどんどん進みました。
シガトキシンに高感度で特異的に結合する抗体を作るには、5環以上の部分構造(分子表面積>400Å2)をKLHに結合させたハプテン・コンジュゲートを抗原にすれば良いことも分かりました(図 4)。
図4. 合成ハプテンを用いたシガトキシンを特異的に認識する抗体の作製法
例えば、CTX3Cの左半分を特異的に認識するモノクローナル抗体10C9は、全合成中間体ABCDEフラグメント(図3,5) を合成ハプテンとしてKLHとコンジュゲートにしてマウスに免疫して得られました(図5)。
この10C9は、ABCDEフラグメント (図3,5) にはもちろん、シガトキシンCTX3Cにも非常に強く結合しました。そして、構造が異なる他のポリエーテル系海洋毒、ブレベトキシン、オカダ酸やマイトトキシンには全く結合しない特異性を示しました8。
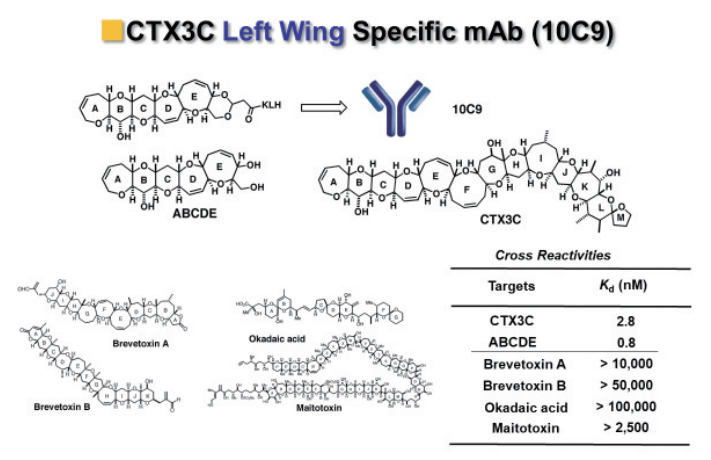
図5. 抗CTX3Cモノクローナル抗体10C9の結合特異性
同様にして、CTX3CやCTX1Bの右側を認識する特異的モノクローナル抗体3D11や8H4の作製にも成功しました(図6)8,9。
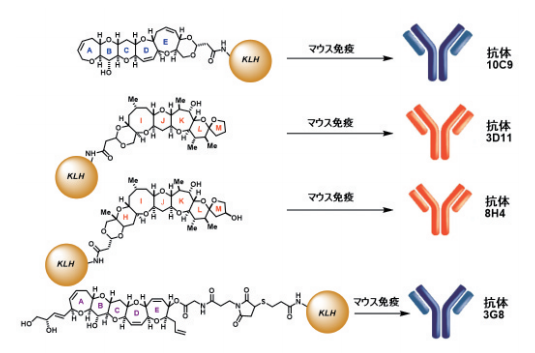
図6. 合成ハプテン・KLHコンジュゲートを抗原として得た4種の抗シガトキシン特異的モノクローナル抗体
しかし、沖縄を始め太平洋海域の中毒で一番の原因になっているCTX1B4,5の左側を認識する抗体3G8を作るには時間がかかりました。藤井・円谷両博士は、自己免疫疾患マウスを使ったりファージ提示法を試みたり、いろいろ工夫してくれましたが、うまく行きませんでした。
議論した結果、「CTX1B以外はうまくできているのだから、CTX1Bでうまく行かないのは、抗原、すなわち、ハプテンとタンパク質とのコンジュゲートが期待通りできていないのではないか?」という基本的な疑問に至りました。CTX1BとCTX3Cシリーズとの最大の構造の違いは、A環のジヒドロキシブテニル基の有無です。
この側鎖を持つABCD-あるいはABCDE-環モデル分子(ハプテン)を活性エステルにしてタンパク質のリジン残基と結合させる時に、求核性の高い側鎖の一級水酸基がもう一分子の活性エステルと反応してしまい、ハプテンがオリゴマー型に縮合してしまう結果、ハプテン価が低い、すなわちタンパク質表面に十分に拡散していないのではないか、と仮説を立てました(図7)。
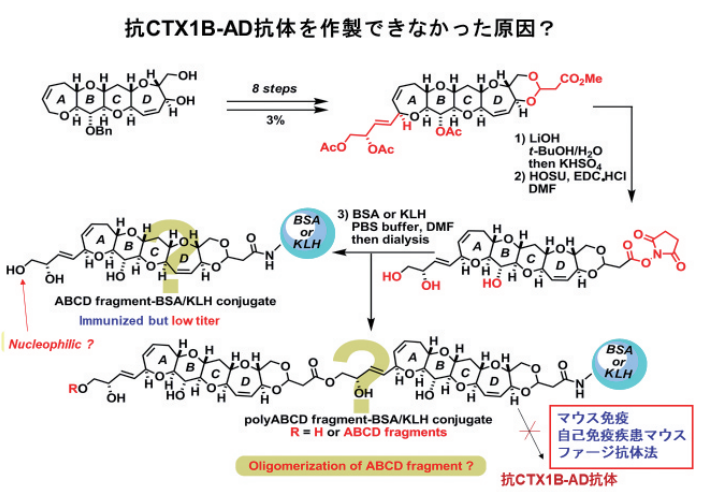
図7. 従来法で有効な抗原ができない理由(仮説)
そこで、一級水酸基より求核性が高いチオールとマイケルアクセプターを用いてコンジュゲートを作る方法を検討しました。最初は、ハプテン側にチオールを付け、リジン残基にマイケルアクセプターを付けましたが成功せず、逆にハプテンにマイケルアクセプターを付け、タンパク側をチオール修飾すると、各中間体の構造をNMRやMSで確認しながら、平均13個のハプテ ンをKLHに結合させた抗原を合成できました。
この抗原を円谷博士がマウスに免疫して、ついに2011年、CTX1Bの左側を高感度で認識する3G8を得ることに成功しました(図8)10,11
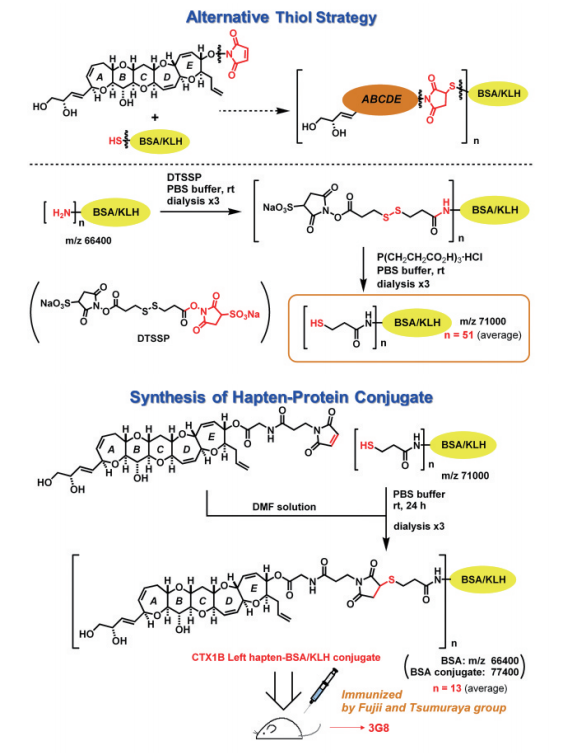
図8. チオールを用いたコンジュゲート作製法と抗CTX1Bモノクローナル抗体3G8
高感度サンドイッチ型ELISA検出法開発
円谷博士は、こうして得た4種の抗シガトキシンモノクローナル抗体を用いて、サンドイッチ型吸光ELISA検出法を開発し、シガトキシンを特異的に識別できることを確認しました(図9)8-11。
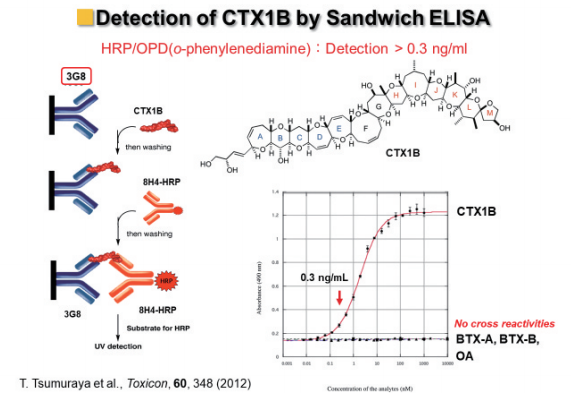
図9. HRPを用いたサンドイッチ吸光ELISA
しかし、この感度では実用のレベルではありません。例えば、米国のFDAは、食用魚中のCTX1Bの量は0.01 ppb以下が望ましいとしています(FDA guidance level in fish: 0.01 ppb CTX1B equivalent toxicity)12。1997年からJSTのCRESTに採用され、シガトキシンの全合成研究も進展しましたが、このCRESTには藤井・円谷両博士にも参加してもらい、上記のように抗体・ELISA研究もどんどん進展しました。
更に、2002年にCREST終了後のSORSTには、ELISA研究を実用化してくれそうな共同研究者を、また石田先生に教えてもらいました。それが、仙台市内の(株)細胞科学研究所(現、(株)セルサイエンス)の佐藤威社長でした。佐藤社長は、私の志に共鳴してくれて、会社の仕事とは直接関係ないのに、直ぐに協力を約束してくれました。
佐藤社長の共同研究の進展は迅速で、当時はまだ抗体3G8が開発できる前でしたが、CTX3C検出のため蛍光法や化学発光法を試みてELISAを高感度にしてくれたほか、金コロイドを用いた簡易検出キットの試作や、血液中のシガトキシン検出試験まで瞬く間に展開してくれました。
その後、円谷博士が、4種の抗体を使った、太平洋海域の主なシガトキシン類、CTX3C、51-ヒドロキシCTX3C、CTX1Bや54-デオキシCTX1Bを高感度で検出できるALP-蛍光サンドイッチELISA実験を精密に再検討し(図10、11)、魚中へのシガトキシンの添加検出実験や4種のシガトキシンを一度に検出できる10C9と3G8及び8H4-HRP抗体を使用したELISAシステムまで開発できました(図12)12。
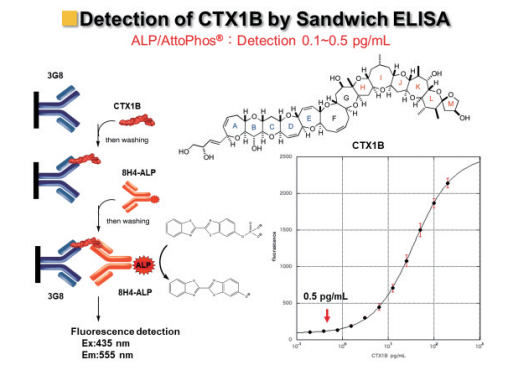
図10. ALPを用いた高感度サンドイッチ蛍光ELISA

図11. 4種のシガトキシンを検出できる高感度サンドイッチ蛍光ELISA
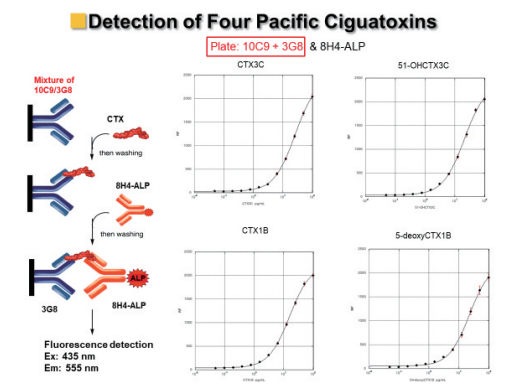
図12. 4種のシガトキシンを一度に検出できる高感度サンドイッチ蛍光ELISA
一方、(株)セルサイエンスの佐藤社長は、実用化のための条件を詳細に検討して、実用化キットの第一弾として、ついにCTX-ELISA 1Bを製造してくれました。これを富士フイルム和光純薬(株)が販売してくれることになり、30年来の夢が実現しました。
まとめ
シガトキシンの全合成を開始してから、5環性合成中間体をハプテンとした円谷博士による抗シガトキシンモノクローナル抗体作製の成功、サンドイッチ型ELISAの開発、(株)セルサイエンスの佐藤社長によるELISA実用キットの確立と製造、富士フイルム和光純薬(株)による販売へと30年来の山あり谷ありの経緯を振り返ってみました。ご協力いただいた皆様に深く感謝申し上げます。
今後は、CTX3Cを検出するELISAキットに加えて、佐藤社長が開発した簡易キットの実用化へとつなげたいと夢は膨らみます。一方、シガトキシンで中毒したマウスの解毒(治療)に私達のモノクローナル抗体が使えることも確認できました13。円谷・藤井両博士によるマウス抗体のヒト化抗体への遺伝子工学的変換も進んでいます。
これらのシガトキシン検出キットが世界中の研究者・公衆衛生担当者・漁業関係者に使っていただいて、世界中のシガテラ中毒の予防に役立つこと、そして更に、シガテラ中毒の治療にも役立つ日を夢見ています。
すべては全合成から始まりました。全合成・人工抗原合成に取り組んでくれた東北大学の共同研究者・学生の皆さんに改めて感謝申し上げます。
文献
- Yasumoto, T. and Murata, M. : Chem. Rev., 93, 1897 (1993). DOI: 10.1021/cr00021a011
- Lewis, R. J. : Toxicon, 39, 97 (2001). DOI: 10.1016/S0041-0101(00)00161-6
- Dickey, R. W. and Plakas, S. M. : Toxicon, 56, 123 (2010). DOI: 10.1016/j.toxicon.2009.09.008
- (a) Murata, M., Legrand, A. M., Ishibashi, Y. and Yasumoto, T. : J. Am. Chem. Soc., 111, 8929 (1989). DOI: 10.1021/ja00206a032 (b) Murata, M., Legrand, A.-M., Ishibashi, Y., Fukui, M. and Yasumoto, T. : J. Am. Chem. Soc., 112, 4380 (1990). DOI: 10.1021/ja00167a040 (c) Satake, M., Fukui, M., Legrand, A.-M., Cruchet, P. and Yasumoto, T. : Tetrahedron Lett., 39, 1197 (1998). DOI: 10.1016/S0040-4039(97)10808-5 (d) Yasumoto, T., Igarashi, T., Legrand, A.-M., Cruchet, P., Cinain, M., Fujita, T. and Naoki, H. : J. Am. Chem. Soc., 122, 4988 (2000). DOI: 10.1021/ja9944204
- (a) Yogi, K., Oshiro, N., Inafuku, Y., Hirama, M. and Yasumoto, T. : Anal. Chem., 83, 8886 (2011). DOI: 10.1021/ac200799j (b) Otero, P., Pérez, S., Alfonso, A., Vale, C., Rodríguez, P., Gouveia, N. N., Gouveia, N., Delgado, J., Vale, P., Hirama, M., Ishihara, Y., Molgó, J. and Botana, L. M. : Anal. Chem., 82, 6032 (2010). DOI: 10.1021/ac100516q
- (a) Oguri, H., Tanaka, S., Hishiyama, S., Oishi, T., Hirama, M., Tsumuraya, T., Tomioka, Y. and Mizugaki, M. : Synthesis(Special Issue), 1431 (1999). DOI: 10.1055/s-1999-3646 (b) Nagumo, Y., Oguri, H., Shindo, Y., Sasaki, S., Oishi, T., Hirama, M., Tomioka, Y., Mizugaki, M. and Tsumuraya, T. : Bioorg. Med. Chem. Lett., 11, 2037 (2001). DOI: 10.1016/s0960-894x(01)00358-4 (c) Nagumo, Y., Oguri, H., Tsumoto, K., Shindo, Y., Hirama, M., Tsumuraya, T., Fujii, I., Tomioka, Y., Mizugaki, M. and Kumagai, I. : J. Immunol. Methods, 289, 137 (2004). DOI: 10.1016/j.jim.2004.04.003
- (a) Hirama, M., Oishi, T., Uehara, H., Inoue, M., Maruyama, M., Oguri, H. and Satake, M. : Science, 294, 1904 (2001). DOI: 10.1126/science.1065757 (b) Inoue, M., Miyazaki, K., Uehara, H., Maruyama, M. and Hirama, M. : Proc. Natl. Acad. Sci. U. S. A., 101, 12013 (2004). DOI: 10.1073/pnas.0401684101 (c) Inoue, M., Miyazaki, K., Ishihara, Y., Tatami, A., Ohnuma, Y., Kawada, Y., Komano, K., Yamashita, S., Lee, N. and Hirama, M. : J. Am. Chem. Soc., 128, 9352 (2006). DOI: 10.1021/ja063041p (d) Yamashita, S., Ishihara, Y., Morita, H., Uchiyama, J., Takeuchi, K., Inoue, M. and Hirama, M. : J. Nat. Prod., 74, 357 (2011). DOI: 10.1021/np100729d (e) Yamashita, S., Takeuchi, K., Koyama, T., Inoue, M., Hayashi, Y. and Hirama, M. : Chem. Eur. J., 21, 2621 (2015). DOI: 10.1002/chem.201405629 (f) Inoue, M. and Hirama, M. : Acc. Chem. Res., 37, 961 (2004). DOI: 10.1021/ar0301577 (g) Inoue, M and Hirama, M. : Synlett, 577 (2004). DOI: 10.1055/s-2004-817767 (h) Hirama, M. : Chem. Rec., 5, 240 (2005). DOI: 10.1002/tcr.20049 (i) Hirama, M. : Proc. Jpn. Acad., Ser. B, 92, 290 (2016). DOI: 10.2183/pjab.92.290
- (a) Oguri, H., Hirama, M., Tsumuraya, T., Fujii, I., Maruyama, M., Uehara, H. and Nagumo, Y. : J. Am. Chem. Soc., 125, 7608 (2003). DOI: 10.1021/ja034990a (b) Tsumuraya, T., Fujii, I. and Hirama, M. : Toxicon, 56, 797 (2010). DOI: 10.1016/j.toxicon.2009.06.003
- Tsumuraya, T., Fujii, I., Inoue, M., Tatami, A., Miyazaki, K. and Hirama, M. : Toxicon, 48, 287 (2006). DOI: 10.1016/j.toxicon.2006.05.014
- Tsumuraya, T., Takeuchi, K., Yamashita, S., Fujii, I. and Hirama, M. : Toxicon, 60, 348 (2012). DOI: 10.1016/j.toxicon.2012.04.347
- Tsumuraya, T., Fujii, I. and Hirama, M. : J. AOAC Int., 97, 373 (2014). DOI: 10.5740/jaoacint.SGETsumuraya
- Tsumuraya, T., Sato, T., Hirama, M. and Fujii, I. : Anal. Chem., 90, 7318 (2018). DOI: 10.1021/acs.analchem.8b00519
- Inoue, M., Lee, N., Tsumuraya, T., Fujii, I. and Hirama, M. : Toxicon, 53, 802 (2009). DOI: 10.1016/j.toxicon.2009.02.017




