【特別講座】V 字型有機半導体の開発物語
本記事は、ChemGrowing Vol.05 (2018年6月号)において、東京大学大学院新領域創成科学研究科物質系専攻/JSTさきがけ 岡本 敏宏 様に執筆いただいたものです。
はじめに
有機半導体材料はシリコンに代表される無機半導体材料と比べて、安価、軽量、低環境負荷、機械的柔軟性の特長を持ち、トランジスタをはじめとする能動素子に応用する有機エレクトロニクスへの期待が益々高まってきています。
有機半導体材料は、大きく分けて低分子系と高分子系に分類されます。一般的に、低分子系有機半導体材料(以下、低分子系半導体と略す)は、有機合成技術により単一の化合物を得ることができ、再結晶や昇華精製などで比較的容易に高純度化できるため高いキャリア移動度(以下、移動度と略す)を与えますが、分子が凝集しやすいため塗布プロセスで再現性よく均質な薄膜を作製することは容易ではありません。
一方、高分子系有機半導体材料(以下、高分子系半導体と略す)は、粘性が高いためスピンコート法などの一般的な塗布法で薄膜を容易に製膜できますが、合成上の問題で通常用いられる金属触媒などの不純物を完全に取り除くことは容易ではないため高純度化が難しく、また、分子量のばらつきの影響を受け、低分子系と比べて結晶性が低く、結果として低分子系よりも約 1 桁低い移動度を与えます。
近い将来、実用的な有機エレクトロニクスデバイスを実現するためには、現在実用的に使われているアモルファスシリコン(0.5 - 1.0 cm2/Vs)を超える高い移動度に加えて、プロセス制約のない化学的および熱的な安定性、印刷プロセス可能な溶解性、環境、熱、バイアスなどに対するデバイスでのストレス耐久性が必要になります。そのためには、これまでの常識を覆す新奇な分子設計指針に基づく革新的な有機半導体分子システムの開発が求められていました。
分子設計戦略の開発物語:どのような分子骨格がよいか!?
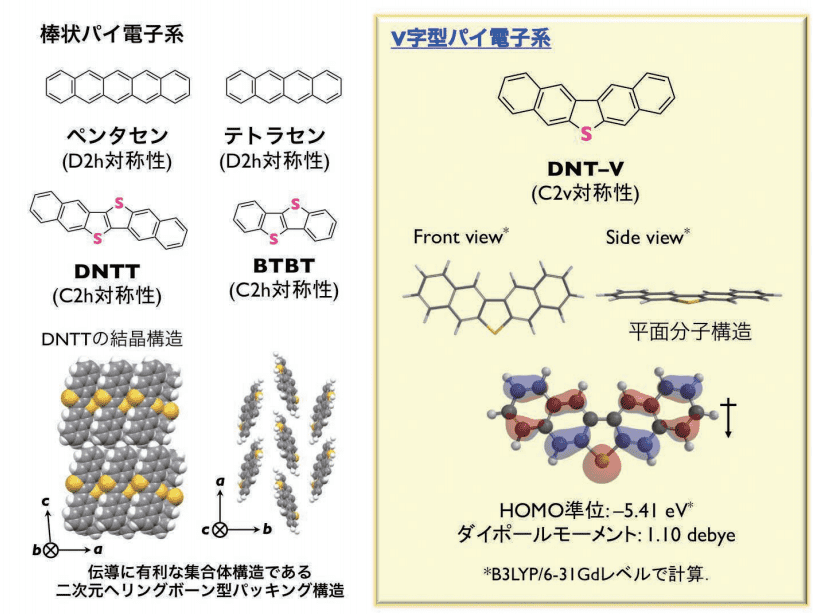
図1. 分子設計指針:棒状パイ電子系 vs. V字型パイ電子系
これまで報告されている低分子系半導体の分子骨格の多くは、ペンタセンやジナフト[2,3-b : 2',3'-f]チエノ[3,2-b]チオフェン(DNTT)をはじめとする棒状パイ電子系でした(図 1 左上)。これらの棒状パイ電子系は D2h もしくは C2h 分子対称性を有する化合物群であり、分子間の C-H···π 相互作用により伝導に有利な集合体構造である二次元ヘリングボーン型パッキング構造(以下、ヘリングボーン構造と略す)を形成します(図 1 左下)が、一般的な有機溶剤では溶解性が低く(10 -4 wt%以下)、印刷プロセスには適しませんでした。
そこで、筆者は、分子の形状に着目し、分子対称性を C2v に下げることで生じる分子内ダイポールによる溶解性の向上を狙いました。分子対称性を下げることによる懸念される点としては、集合体構造においてヘリングボーン構造を取りづらくなることやヘリングボーン構造を取ったとしても伝導の異方性が大きくなることなどがあり、これにより半導体性能が低下することが予想されました。
筆者が開発に取り組んでいた当時(2010 年頃)では、筆者を含めて世界の研究者はほとんど、C2v 対称の分子を有機半導体研究の対象としていませんでした。
筆者がまず設計した分子は、ビナフタレンを硫黄で連結したジナフト[2,3-b : 2',3'-d]チオフェン(DNT-V)という骨格です(図 1 右)。DNT-V 骨格は、DFT 計算から平面分子構造を有し、張り出した硫黄上での有効的な軌道係数、HOMO 準位が大気安定性に必要な -5.0 eV よりも深く1、通常用いられる金電極の仕事関数に近いため、p 型半導体材料として機能すると予想されました。
また、分子内ダイポールは 1.0 debye 程度であり、溶解性の向上にある程度寄与すると予想されました。DNT-V 骨格自身は 1983 年にすでに合成法のみ報告されていました2が、基礎物性、集合体構造解析および半導体特性について全く報告されていませんでした。
そこで、まず、分子設計の公算を検証すべく、DNT-V の合成を行いました。当時、筆者は阪大産研の特任准教授として赴任して間もない頃であり、一緒に検討するメンバーを探していたところ、D3 の学生だった山岸正和さん(現 富山高専助教)がちょうど博士論文を書き終え有機合成に興味を持っていたので、声をかけて 2 人で検討を始めました。
報告されていた合成法は 10 ステップで収率も低かったため、他の既存の反応を組み合わせることで原料から 3 ステップで DNT-V を合成しました。得られた化合物を再結晶や昇華などの精製作業を繰り返し、各種物性測定やデバイス評価が可能なサンプルを得ることができました。合成スタートからここまでほぼ 2 週間でできたことを今でも記憶に残っています。
得られた DNT-V について、まず、パイ共役系化合物に対する溶解性が高い有機溶媒であるトルエンに対する溶解性をテストしました。その結果、DNT-V は室温でペンタセンや DNTT より 2 桁以上高い 0.17 wt% の溶解性を有し、期待通りの溶解性の向上を達成しました。
つづいて、半導体として性能を検証するために、集合体構造解析およびトランジスタ評価を行いました。単結晶を物理気相輸送法3により育成し、単結晶構造解析および伝導に関する理論計算を行いました。単結晶中での分子構造は、理論計算で最適化された平面構造(図 1 右)とは異なり、すこし反った構造をとっていることがわかりました(図 2 左)。
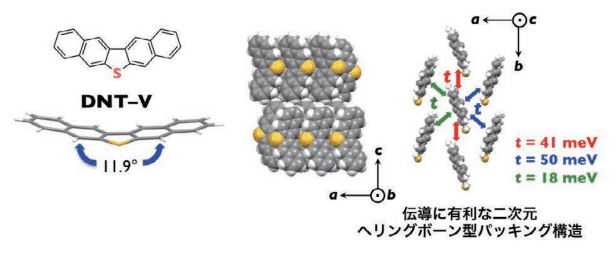
図2. DNT-Vの結晶構造とトンラスファー積分の結果
また、集合体構造は棒状パイ電子系と同様のヘリングボーン構造を形成し、分子内ダイポールによる大きな影響をうけることなく、二次元伝導に有利な集合体構造を維持できており、山岸さんと 2 人で大喜びしたことを鮮明に覚えています。
単結晶構造解析により得られた集合体構造に基づき、分子間の軌道の重なりを反映し、伝導を記述する上で重要なパラメータであるトランスファー積分(t)を算出しました(PBEPBE / 6-31 G(d) レベル)。伝導に大きく寄与する a - b 面内方向の 7 分子を抽出し、それぞれ 2 分子間の t は、各方向の値はそれぞれ、41、50、18 meV であり、一方向については他よりも小さな値でしたが、概ね良好な値を与えました。
後の研究で、反った分子構造により、分子間相互作用が向上し、分子の対称性低下による伝導の異方性への影響は低減されていることがわかりました。また、理論計算の結果を受けて、単結晶の貼り付けによるトランジスタ構造を用いたキャリア移動度評価したところ、1.5 cm2/Vs とアモルファスシリコンを超える移動度を示しました。
以上の初期検討から、DNT-V は有機半導体分子骨格として有望であることが明らかとなりました。
実用に耐えうる有機半導体材料への挑戦物語:如何に結晶安定性と印刷プロセス性の両立を達成するのか!?
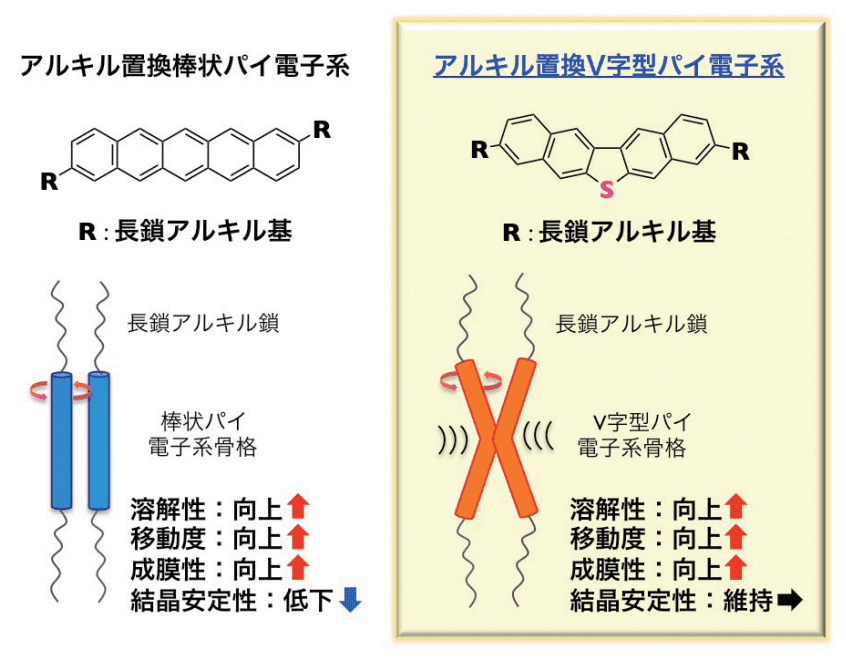
図3. アルキル置換棒状パイ電子系 vs. V字型パイ電子系
棒状パイ電子系の溶解性の問題は、柔軟性の高い長鎖アルキル基を導入することで解決されてきました(図 3 左)。また、アルキル鎖間の van der Waals 相互作用により分子の自己組織化が促進され、移動度や成膜性の向上も実現しています4-6。
しかしながら、一連の棒状パイ電子系分子群は、図 3 左下に示したように分子長軸まわりの回転運動が起こりやすく、デシル基を導入したペンタセン(C10-Pen)、[1]ベンゾチエノ[3, 2 -b][1]ベンゾチオフェン(BTBT)(C10-BTBT)や DNTT(C10-DNTT)は、それぞれ 89 ℃、109 ℃や 117 ℃で結晶相からの流動性の高い相への転移が報告されていました4, 7, 8。C10-BTBT や C10-DNTT を用いた薄膜トランジスタについては、それぞれの相転移温度以上での熱ストレスによる性能の低下が報告されており、デバイスにおける熱ストレス耐久性に大きな課題が残っていました9, 10。
ごく最近開発された非対称系デシル−フェニル置換 BTBT(C10-BTBT-Ph)では、結晶相に近い高次の液晶相により相転移温度が 150 ºCまで上昇し、熱ストレス耐性の向上を達成していますが11、依然として実デバイスの電極配線やパターニングに用いられている現在の高温プロセス(通常 150 ºCから 200 ºC)12や自動車の車内などの高温下において性能が劣化しないデバイス熱耐久性も兼ね揃えた実用的な有機半導体材料の開発が求められています。
筆者は、V 字型の形状を有する DNT-V 骨格が棒状パイ電子系の問題点である分子長軸まわりの回転運動を抑制し、結晶相の安定性に寄与できる骨格だと考え、アルキル置換 DNT-V の検討に取り組みました。開発当時は、無置換 DNT-V 以外の誘導体の報告例がなく、まずは一連の誘導体の合成のための合成法の開発が必要でした。
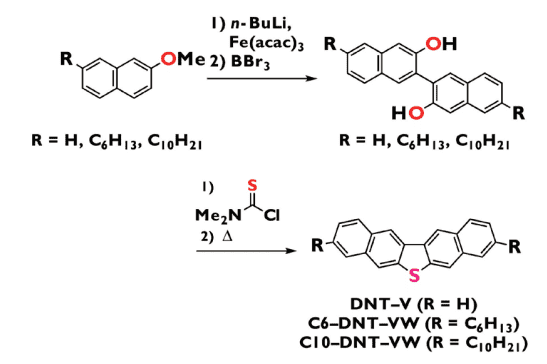
筆者は有機合成屋として、短ステップで、安価な試薬で、スケールアップできる合成法の開発にこだわって取り組んだ結果、スキームに示したように、安価なメトキシナフタレン誘導体を出発原料に用い、酸化的ホモカップリング反応13、脱メチル化、Newman-Kwart 転移14を経由する環化反応を鍵反応として、無置換 DNT-V およびアルキル置換 DNT-V(C6-DNT-VW および C10-DNT-VW)を合成することができました15。
スキーム.硫黄架橋V字型分子の簡便な合成法
まず、得られたアルキル置換 DNT-V 誘導体の C6-DNT-VW と C10-DNT-VW について、無置換 DNT-V との比較実験を行いました。溶解性は長鎖アルキル基の導入により室温トルエン中で C10-DNT-VW で 0.38 wt%、C6-DNT-VW で約 1.0 wt% を示し、無置換体に比べて溶解性の向上が見られました。これにより、スピンコート法、インクジェット法やドロップキャスト法などの様々な印刷プロセスに適用可能な材料であることがわかりました。
得られた誘導体について、紫外可視光吸収スペクトルの大気下での経時により化学的安定性を評価したところ、いずれの分子においてもスペクトルに変化は全く見られず、特別な操作なしに大気下で取り扱うことが可能であることがわかりました。
また、熱安定性および結晶安定性を評価するため、窒素気流下で熱重量測定(Thermogravimetry, TG)と示差熱分析(Differential Thermal Analysis, DTA)の同時測定(TG-DTA 測定)を行いました。TG 測定からすべての分子は分解することなく、昇華もしくは蒸発することがわかり、熱的にも安定であることがわかりました。
半導体特性を無置換 DNT-V と比較、検証するために、集合体構造解析と得られた構造情報を用いた伝道に関する理論計算を行いました。単結晶育成は、アルキル置換 DNT-V 誘導体は良溶媒と貧溶媒を用いる二層拡散法もしくは蒸気による結晶化法により行いました。
図 4 に単結晶中での C10-DNT-VW の分子構造およびパッキング構造を示しました。結晶中において分子は無置換 DNT-V と同様に、ナフタレン間が屈曲した構造を形成していることが明らかとなりました(図 4 左)。また、パッキング構造は c 軸方向にラメラ構造、a - b 面内方向については伝導に有利な二次元ヘリングボーン構造を形成していることがわかりました(図 4 右)。
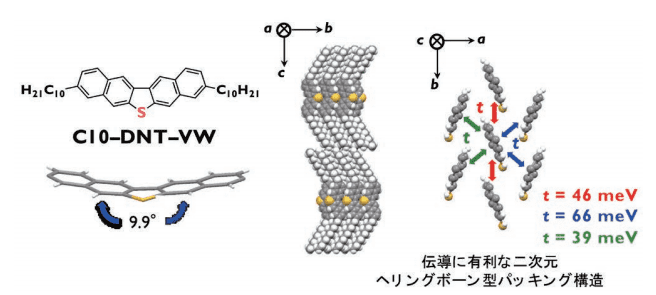
図4. C10-DNT-VWの結晶構造とトランスファー積分の結果
また、アルキル置換 DNT-V 誘導体は、興味深いことに、長鎖のアルキル鎖の導入により、無置換体で見られた分子長軸方向のずれが解消され、また、重心間距離が減少していました。その結果、3 成分すべての t が増加して46、66、39 meV となり、有効的な軌道の重なりが実現しました。したがって、無置換体に比べて、アルキル置換 DNT-V の移動度が高くなることが期待されました。
得られた一連の化合物の単結晶薄膜について、薄膜構造解析、表面観察薄膜解析およびイオン化ポテンシャルの評価を行いました。単結晶薄膜のX線回折では、単結晶構造解析で得られた構造を仮定しラウエスポットを帰属できたことで、薄膜中で分子長軸方向が基板垂直方向、伝導に有利な方向が結晶成長方向とほぼ一致していることがわかりました。
光電子収量分光法(Photoelectron Yield Spectroscopy, PYS)によって、DNT-V と C10-DNT-VW のイオン化ポテンシャルがそれぞれ 5.72 と 5.46 eV であることがわかりました。いずれの分子も大気中で安定な電極として用いられる金電極の仕事関数(~5 eV)と同程度のイオン化ポテンシャルを有しており、p 型有機半導体として動作します。
<トランジスタ構造は、SiO2 / doped Si ウェハ上に上記の単結晶薄膜を成膜した後、メタルマスクを通して 2,3,5,6-テトラフルオロ-7,7,8,8-テトラシアノキノジメタン(F4-TCNQ)(2 nm)と金(50 nm)を蒸着することで作製しました(図 5)。
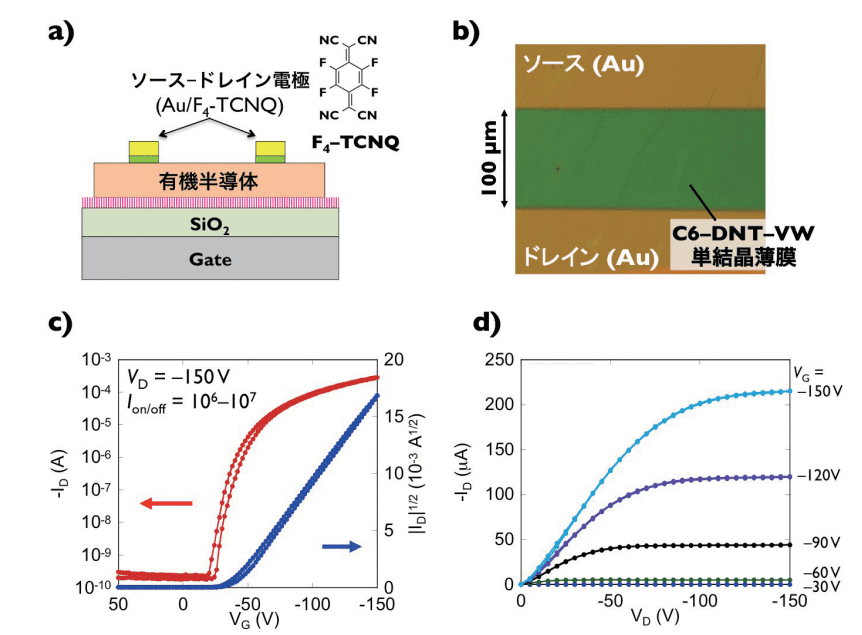
図5. a) ボトムゲート-トップコンタクト構造と、b) エッジキャスト法で作製したC6-DNT-VW単結晶デバイスの光学顕微鏡像、典型的なC6-DNT-VW単結晶トランジスタのc) 伝達特性とd) 出力特性
有機半導体溶液の濡れ性を向上させる目的で、予め SiO2 表面に自己組織化単分子膜によって化学修飾を行っています。また、F4-TCNQ は電子求引性分子で p 型有機半導体-金属間の接触抵抗を低減する働きがあります。
電流飽和が検出できた電圧領域での伝達特性から移動度を求めたところ、単結晶構造に基づいて計算したトランスファー積分とよい一致を示し、DNT-V よりも C10-DNT-VW の方が高い移動度を示しました。得られた DNT-V 誘導体のうち、C6-DNT-VW では 10 cm2/Vs を超える世界最高水準の移動度を示しました。
高い移動度が得られた C6-DNT-VW をもちいたトランジスタについて、素子の熱ストレス耐久試験を行いました。加熱試験には、有機半導体と同程度の熱収縮率を持つポリカーボネートを基板とするトランジスタを用いました。その結果、C6-DNT-VW トランジスタでは、150 ºC まで著しい特性の劣化が見られませんでした。
C6-DNT-VWの液晶相転移温度(200 ºC)よりも低い温度での特性の劣化は、常圧下でも徐々に分子が昇華したためであることを光学顕微鏡観察によって確認しました。さらに、ストレージ試験とバイアスストレス試験を行いましたが、いずれも著しい特性の劣化は観測されませんでした。以上のように、C6-DNT-VW は使用環境ストレスに強い有機半導体であることが明らかになりました。
ごく最近、DNT-V 骨格への直接の置換基導入は選択性に乏しい問題を解決すべく、第 2 世代の V 字型パイ電子系骨格であるビナフタレンの両末端のベンゼン環をチオフェン環に置き換えたチエノ[3,2-f : 4,5-f ']ビス[1]ベンゾチオフェン(TBBT-V)骨格に着目して研究を行いました(図 6)16。
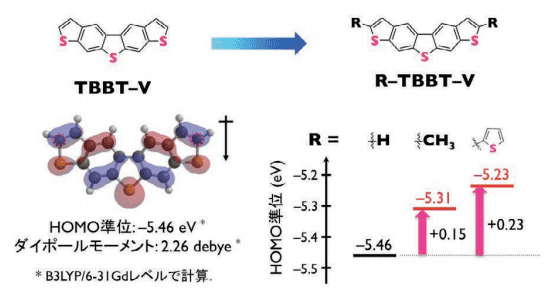
図6. V字型パイ電子系コアTBBT-V
TBBT-V は末端のチオフェン環のα位プロトンは他のプロトンよりも反応性が高いため、各種置換基を選択的に導入可能であり、これにより、各種化合物の誘導化、集合体構造、溶解性、デバイス特性のチューニングが可能となります。また、TBBT-V は DNT-V と同様の軌道形態を有することから DNT-V 同様の高移動度半導体材料として期待され、分子内ダイポールモーメントの増大(2.26 debye)による溶解性の向上が期待できます。
さらに、α位の軌道係数の寄与が大きいため、置換基の導入により HOMO レベルを浅く(イオン化ポテンシャルを小さく)することが可能となり、DNT-V 骨格での問題点であった駆動電圧の改善も期待できます。実際、TBBT-V は同置換基を有する DNT-V と比較して、移動度はほぼ同等で、溶解性の向上、閾値の改善が見られました。
特に、アルキル TBBT-V は成膜性に優れており、スピンコート法、ドロップキャスト法、インクジェット法、エッジキャスト法17など各種プロセスで再現性よく薄膜を得ることができる材料であることがわかりました。筆者の研究室では、初めてデバイスを作る学生の練習実験用サンプルとしてアルキル TBBT-V を使用しています。
さいごに
本稿において、筆者が開発した V 字型有機半導体パイ電子系群である第 1 世代 DNT-V および第 2 世代 TBBT-V の開発物語についてまとめました。これら一連の分子群は、プリンテッド・フレキシブルエレクトロニクス応用に向けて有機半導体材料の不可欠な要件である化学安定性、熱安定性、印刷プロセス性、現在使用されているアモルファスシリコンを超える移動度などを一つずつ戦略的に克服しながら開発した材料群です。しかも簡便かつ効率的な手法で合成可能な材料です。
このように、V 字型パイ電子系分子群は、有機エレクトロニクス分野に新しい潮流を起こすに違いなく、次世代有機半導体材料の開発のための 1 つの分子設計指針になりうると確信しています。
本稿の成果は、筆者が特任准教授から准教授であった大阪大学産業科学研究所および准教授(現在)である東京大学大学院新領域創成科学研究科の竹谷純一教授のグループにおける研究により得られたものです。また、本研究の共同研究者である山岸正和博士(現富山高専助教)や三津井親彦博士をはじめ多くの研究者の協力のもとで行われたものであり、ここに深謝申し上げます。
本研究の一部は、科学研究費補助金基盤研究 B(No.25288091)、科学技術振興機構さきがけ「分子技術と新機能創出」領域(加藤隆史研究総括)、JNC 株式会社および JNC 石油化学株式会社、富士フイルム株式会社の支援により進められたものです。ここに深く感謝申し上げます。
参考文献
- Maliakal, A. et al. : Chem. Mater., 16, 4980 (2004). DOI: 10.1021/cm049060k
- Castle, R. N. et al. : J. Heterocyclic Chem., 20, 1143 (1983). DOI: 10.1002/jhet.5570200502
- Kloc, C. et al. : J. Cryst. Growth, 182, 416 (1997). DOI: 10.1016/S0022-0248(97)00370-9
- Takimiya, K. et al. : J. Am. Chem. Soc., 129, 15732 (2007). DOI: 10.1021/ja074841i
- Takimiya, K. et al. : Adv. Mater., 23, 1222 (2011). DOI: 10.1002/adma.201001283
- Takeya, J. et al. : Adv. Mater., 23, 1626 (2011). DOI: 10.1002/adma.201004387
- Okamoto, K. et al. : Liq. Cryst., 34, 1001 (2007). DOI: 10.1080/02678290701478970
- Kuwabara, H. et al. : WO 2010/098372 A1 (2010).
- Hanna, J. et al. : J. Non-Cryst. Solids, 358, 2516 (2012). DOI: 10.1016/j.jnoncrysol.2012.03.021
- Someya, T. et al. : Adv. Mater., 25, 3639 (2013). DOI: 10.1002/adma.201300941
- Hanna, J. et al. : Nat. Commun., 6, 6828 (2015). DOI: 10.1038/ncomms7828
- Someya, T. et al. : Nat. Commun., 3, 723 (2012). DOI: 10.1038/ncomms1721
- Swager, T. M. et al. : J. Am. Chem. Soc., 116, 9347 (1994). DOI: 10.1021/ja00099a069
- Lloyd-Jones, G. C. et al. : Synthesis, 661 (2008). DOI: 10.1055/s-2008-1032179
- Okamoto, T. and Takeya, J. et al. : Adv. Mater., 25, 6392 (2013). DOI: 10.1002/adma.201302086
- Okamoto, T. et al. : J. Mater. Chem. C, 5, 1903 (2017). DOI: 10.1039/C6TC04721A
- Takeya, J. et al. : Appl. Phys. Express, 2, 111501 (2009). DOI: 10.1143/APEX.2.111501





