【連載】核酸医薬合成基礎講座 「第3回 オリゴヌクレオチド合成におけるカップリング反応」
本記事は、和光純薬時報 Vol.86 No.3(2018年7月号)において、サイエンスライター 佐藤 健太郎 様に執筆いただいたものです。

DNA 及び RNA は、構成単位である核酸が、リン酸ジエステル結合によって多数結合した構造をとる。このリン酸ジエステル結合は、他の低分子化合物ではほとんど見られない結合であり、独特な合成法が開発されている。
核酸合成においては、この結合生成反応を何度も繰り返すことになるため、その効率は全体の収率を大きく左右する。今回は、このリン酸ジエステル結合生成反応について解説してゆく。
カップリング反応の歴史
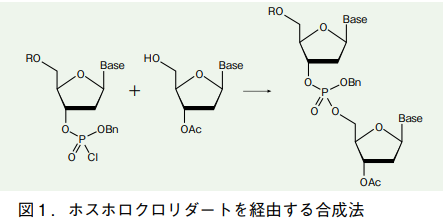
1950 年代、核酸合成が初めて行われた頃に用いられたのは、ホスホロクロリダートを経由する方法であった 1)。形式上、酸塩化物とアルコールの反応によるカルボン酸エステル合成の、リン酸版に当たる。
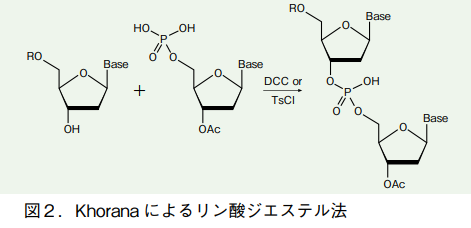
核酸合成の開祖といわれる H. G. Khorana は、保護されたヌクレオチドのリン酸部分と、5' 位が保護されたヌクレオシドを、直接カップリングさせる方法を開発した 2)。縮合剤としては、N,N'-ジシクロヘキシルカルボジイミド(DCC)または塩化 p-トルエンルスホニル(TsCl)が用いられた。これは「リン酸ジエステル法」と呼ばれることがある。
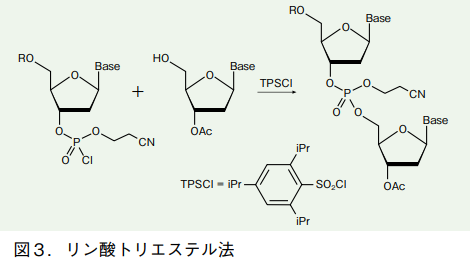
ただしこの方法では、リン酸のヒドロキシ基が両方とも反応しうるため、ヌクレオシドが 2 つ導入された枝分かれ核酸が副生成物として生成してしまう。これを防ぐため、1960 年代には R. Letsinger らおよび C. Reese らによって、「リン酸トリエステル法」が開発された 3)。これは、リン酸のヒドロキシ基のひとつを 2-シアノエチル基で保護した上で、カップリングを行う手法である。シアノエチル基は、オリゴヌクレオチド鎖延長反応終了後に、濃アンモニア水で処理することで、核酸塩基の保護基(前回記事参照)と共に切除される(図 3)。
こうした工夫が重ねられてはきたが、核酸合成においてはこの反応を数十回繰り返す必要があるため、その効率は十分とはいえなかった。たとえば収率 90% の工程でも、30 回繰り返すと総収率は 4.2% にしかならないため、できうる限り収率 100% に近づける必要がある。
そこで 1970 年代に入ってからは、亜リン酸トリエステル法が開発された。四配位のリン酸エステル結合よりも、三配位の亜リン酸エステル結合の方が作りやすいという知見に基づく発想であった。亜リン酸エステル結合の安定性は高くないので、エステル結合生成後に改めて酸化を行ない、リン酸エステルに変換する必要がある。このため工程数は増えるが、全体として収率向上につながるため、この方法が受け入れられていった(酸化反応については次回で詳述)。
ホスホロアミダイト法
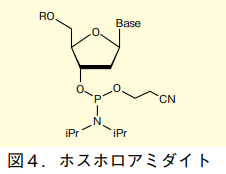
こうした中、核酸合成におけるカップリング反応の決定版として登場したのが、ホスホロアミダイト法である 4)。リン原子に、ヌクレオシド(またはデオキシヌクレオシド、以下同様)の 3' 位とシアノエトキシ基、ジアルキルアミノ基が結合した図 4 のような化合物が、一般にホスホロアミダイトと呼ばれる。ジアルキルアミノ基としては、ジイソプロピルアミノ基が最もよく用いられる。これより小さければ安定性に欠け、かさ高ければ反応性が低下するためである。
適切に保護されたヌクレオシドに対し、活性化剤となる 1H-テトラゾールと共にこのユニットを作用させると、置換反応が起こって両者がカップリングする。活性化剤となるテトラゾールは、2 つの役割を演じる。まずテトラゾールからプロトンが放出され、ホスホロアミダイトの窒素原子に結合して活性化する。ここからジイソプロピルアミンが脱離し、テトラゾリル基と置換したものが活性種となる、これが 5' 位ヒドロキシ基と反応して、カップリングが成立する。
活性化剤として 1H-テトラゾールは有効だが、低温では結晶が析出してしまうことがある。このため、溶解度の高い 2-エチルチオテトラゾール、2-ベンジルチオテトラゾールなどが用いられることもあり、1H-テトラゾールよりも反応が早く終了することが多い。また、4,5-ジシアノイミダゾールなども用いられる。
ヌクレオチド鎖が結合した固相担体に対し、0.02 ~ 0.2 M のホスホロアミダイトのアセトニトリル溶液、0.2 ~ 0.7 M の活性化剤のアセトニトリル溶液を流し込んで反応させる。ヌクレオチド鎖に対し、モル比でホスホロアミダイトを 5 倍程度、活性化剤を 20 倍程度過剰に用いて、徹底的に反応を進行させる。
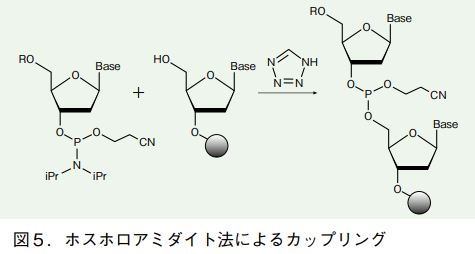
立体障害の少ない DNA 合成の場合には数十秒で反応が終了するが、RNA 合成の場合には 5 分から 15 分ほどの時間を要する。またホスホロアミダイトは水分に弱いため、溶媒などはできる限り乾燥させたものを用いる。反応終了後はアセトニトリルで担体を徹底的に洗浄し、過剰の試薬を除去する。
ホスホロアミダイトの合成
天然の各ヌクレオシドのホスホロアミダイトは市販されているので、通常はこれを用いる。ただし特殊なヌクレオシドなどを用いる場合には、ホスホロアミダイトを自製する必要がある。
適切に保護されたヌクレオシドに対し、2-シアノエチル-N,N,N',N'-テトライソプロピルホスホロジアミダイトを作用させることで、目的とするホスホロアミダイトを得られる 5)。
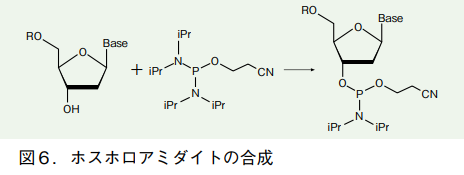
なお、2-シアノエチルN,N,N',N'-テトライソプロピルホスホロジアミダイトは不安定な化合物なので、使用時に調製する必要がある 6, 7)。
ヌクレオシドのホスホロアミダイトは、低温、無水の固体状態でほぼ安定に保存できる。溶液中でも、中性ではかなり安定だが、酸性ではほぼ瞬時に分解してしまう。このため、保存には気を配る必要がある。できたホスホロアミダイトは、シリカゲルカラムで精製を行うことも可能だが、展開溶媒に数 % のトリエチルアミンを添加し、弱塩基性を保ちながら溶出させることが望ましい。
なお、ホスホロアミダイトのリン原子は不斉点となるため、分子全体としてジアステレオマーとなる。このため、TLC では 2 つのスポットが見えることがあり、NMR でも両ジアステレオマーのピークが観測されるので、注意する必要がある。
次回、酸化反応を含めた合成プロトコルの流れについて解説する。
参考文献
- Michaelson, A. M. and Todd, A. R. : J. Chem. Soc., 2632 (1955). DOI: 10.1039/JR9550002632
- Gilham, P. T. and Khorana, H. G. : J. Am. Chem. Soc., 80 , 6212 (1958). DOI: 10.1021/ja01556a016
- Reese, C. B. : Tetahedron, 34 , 3143 (1978). DOI: 10.1016/0040-4020(78)87013-6
- Beaucage, S. L. and Caruthers, M. H. : Tetrahedron Letters, 22 , 1859 (1981). DOI: 10.1016/S0040-4039(01)90461-7
- Nielsen, J. et al. : Nucleic Acids Res., 14 , 7391 (1986). DOI: 10.1093/nar/14.18.7391
- Nielsen, J. et al. : Nucleic Acids Res., 15 , 3626 (1987). DOI: 10.1093/nar/15.8.3626
- Beaucage, S. L. : e-EROS(Encyclopedia of Reagents for Organic Synthesis), doi: 10.1002/047084289X.rn00312
》関連ページ:核酸合成試薬









