同仁化学 アポトーシス(Annexin V)プレートアッセイキット

本キットでは、洗浄操作なしでアポトーシス細胞をプレートリーダーで迅速に蛍光検出できます。カルシウムイオンの存在下でホスファチジルセリン(PS)に特異的に結合する Annexin V の特性を利用しています。
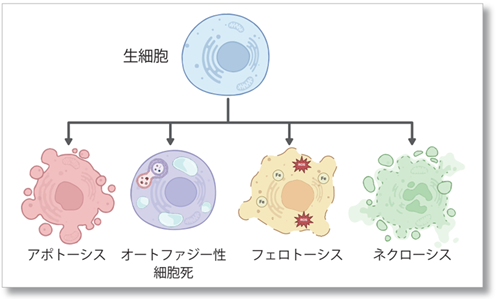
細胞死をより詳細にみる
細胞死は様々な疾患の病因に関わっているため、長年研究の対象とされています。これまで、その状況や誘導のトリガーとなる刺激によってアポトーシスとネクローシスの 2 種類に分けられていましたが、近年フェロトーシスやオートファジー性細胞死など、アポトーシスやネクローシスと異なる経路をたどる細胞死が発見されています。その細胞死を詳細に解析し種類を見分けることは、疾患の治療方法を確立するためのアプローチとして研究されています。
キット内容
| コンポーネント | 数量 | 備考 |
|---|---|---|
| Annexin V - FITC | 1本 | ホスファチジルセリンと結合する Annexin V に蛍光色素である FITC を標識 |
| Quenching Buffer | 11 mL × 1本 | 蛍光標識 Annexin V やホスファチジルセリンに結合していない蛍光標識 Annexin V の蛍光を消去 |
特長
- ホスファチジルセリンを Annexin V で蛍光検出
- プレートリーダーで測定可能(多検体処理)
- 洗浄操作が不要(バラつきや蛍光強度の低下の問題を解決)
- 別指標測定のキットと併用測定が可能
性質
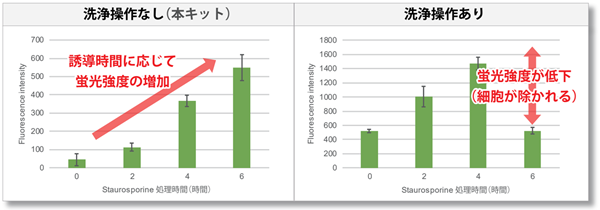
正常な細胞では、細胞内に存在するホスファチジルセリン(PS)がアポトーシスの初期の段階で膜構造が変化し、細胞外へ露出します。本キットでは、ホスファチジルセリンと結合する Annexin V に蛍光色素である FITC を標識した試薬と Quenching Buffer を使用することで、洗浄操作が不要です。これまでプレートリーダーでの測定では、細胞死が誘導されるにつれ細胞が剥がれやすくなるため、洗浄操作によってバラつきや蛍光強度が低下する問題がありましたが、本キットではアポトーシス誘導に比例した結果を得ることができます。
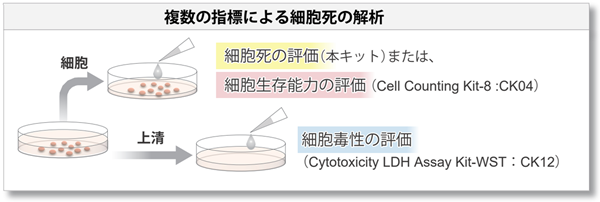
また、本キットでは細胞サンプルを細胞と上清に分け、それぞれを異なる指標(試薬の併用)で測定することで、細胞死をより詳細に解析できます。
技術情報
原理
アポトーシスは、細胞のプログラムされた死の一つであり、植物や動物のホメオスタシスや発生過程の維持に重要な役割を果たしています。その一つの例として、細胞生成過程で発生した異常な細胞はアポトーシスによって除去されます。アポトーシスの初期段階において、細胞膜の内側に存在するホスファチジルセリン (PS) が細胞膜の外側に移行することが知られています。この特異な変化により、アポトーシス細胞を識別することが可能です。
Annexin V は、カルシウムイオンの存在下でホスファチジルセリンに特異的に結合するタンパク質です。この特性を利用し、蛍光標識された Annexin V を用いることで、アポトーシス細胞を蛍光検出することが可能となります。一般的に、フローサイトメトリーや蛍光顕微鏡を用いてアポトーシス細胞の検出が行われておりますが、多検体処理に時間を要します。
本キットには、蛍光標識 Annexin V や PS に結合していない蛍光標識 Annexin V の蛍光を消去する試薬 (Quenching Buffer) が同梱されており、洗浄操作不要でプレートリーダーで迅速に多検体検出が可能です。
フローサイトメトリー法との比較
HeLa 細胞を Staurosporine で処理し、アポトーシスを誘導しました。一方は、市販の FITC 標識 Annexin V で染色後にフローサイトメーターで蛍光検出し、もう一方は Annexin V Apoptosis Plate Assay Kit を用いてプレートリーダーで蛍光検出しました。その結果、フローサイトメーターとプレートリーダー両方でアポトーシスの進行に伴い蛍光強度の増加を確認しました。
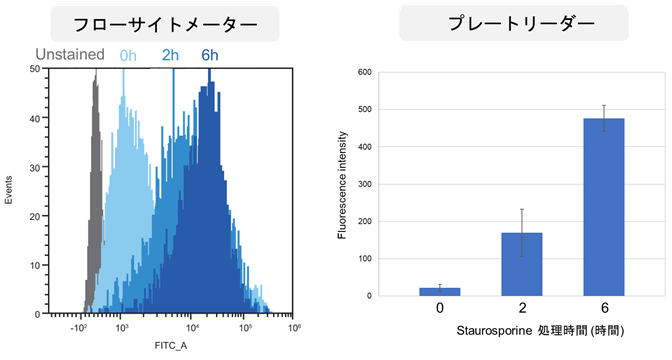
<実験条件>
細胞種:HeLa 細胞
Staurosporine 濃度:5 µmol/L
時間:0~6 時間
<検出条件>
プレートリーダー:TECAN 社製 Infinite M200 PRO, ボトムリーディング
フローサイトメーター:SONY 社製 SA3800
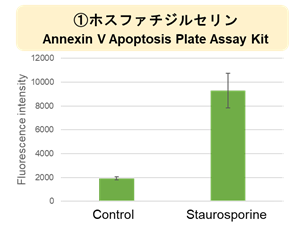
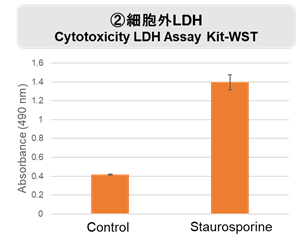
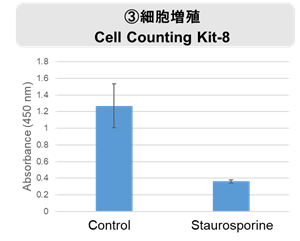
実験例:Staurosporine による各種指標の変化
Staurosporine 処理によりアポトーシス誘導した HepG2 細胞と通常細胞 (Control) のホスファチジルセリン、細胞外 LDH、細胞増殖の変化を解析しました。アポトーシスのマーカーとしてホスファチジルセリンを Annexin V Apoptosis Plate Assay Kit、死細胞の指標として細胞外の LDH を Cytotoxicity LDH Assay Kit-WST、細胞増殖を Cell Counting Kit-8で測定しました。
その結果、Staurosporine 処理によってホスファチジルセリン、細胞外 LDH は増加し、細胞増殖は低下する結果が得られました。
<実験操作>
- HepG2 細胞(2×104 cell/well)を 96 well Black Plate (クリアボトム) に播種し、インキュベーター(37 ℃、5% CO2 存在下)で一晩培養した。
- 培地を除去し、MEM 培地(Control)または MEM 培地で調製した5 μmol/L staurosporine 200 μLを添加し、インキュベーター(37 ℃、5% CO2存在下)で 24 時間インキュベートした。
- ①ホスファチジルセリン測定用ウェルから上清 100 µLを 96 well Clear Plate に移し、②細胞外 LDH を Cytotoxicity LDH Assay Kit の取扱説明書(ノンホモジニアスアッセイ)に従い測定した。
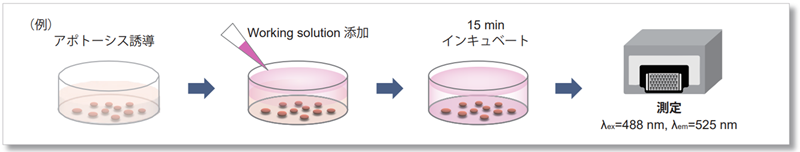
- 96 well Black Plate の①ホスファチジルセリン測定用ウェルに working solution を60 μL 添加し遮光下室温で 15 分間静置した後、プレートリーダー(ボトムリーディング)で蛍光強度(Ex/Em = 488/525 nm)を測定し、得られた値からそれぞれブランクを差し引いて Annexin V - FITC 由来の蛍光強度を算出した。
- 96 well Black Plate の③細胞増殖測定用ウェルから上清 100 μL を除いた後、Cell Counting Kit-8 の取扱説明書に従い測定した(2時間呈色反応し吸光度を測定)。
<測定装置>
TECAN 社製 Infinite M200 PRO
Q&A
- キットあたり測定可能なサンプル数を教えてください。
-
サンプルの測定をそれぞれn=3で行った場合、最大31サンプルを測定可能です。
ただし、培地の異なるサンプルがある場合は、培地ごとにブランクの測定が必要となります。

- ブランクが高いのですが問題ないですか?
-
試薬の特性により、アポトーシスを誘導していないコントロールと比較してブランクが同じくらいの蛍光強度となる場合があります。
試薬に問題はありませんので、取扱説明書に記載の通りブランクの蛍光強度を差し引いて算出してください。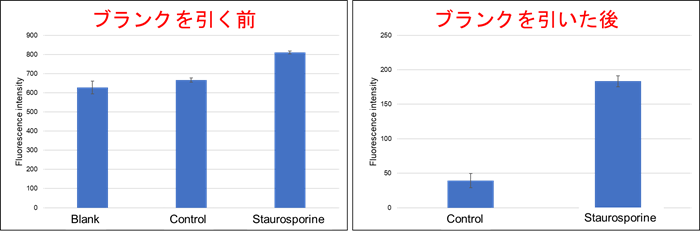
- サンプル間の蛍光強度差が小さいのですが、何を確認したらいいですか?
-
以下2点をご確認ください。
1.細胞数
細胞数によって蛍光強度差が異なることが確認されております。
1-5 × 104 cells/well を目安に細胞数をご検討ください。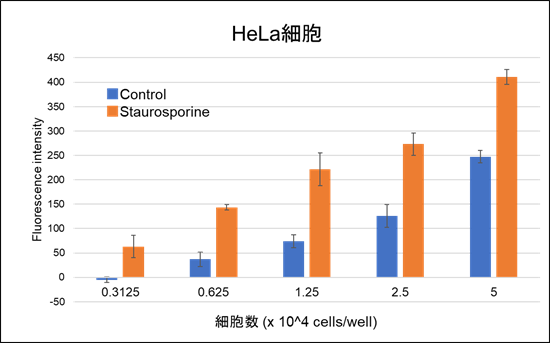
細胞数(×104 cells/well) 0.3125 0.625 1.25 2.5 5.0 S/N - 3.9 3.0 2.2 1.7 2.薬剤処理時間
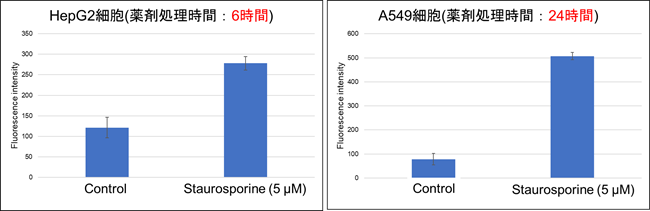
細胞種ごとにホスファチジルセリンが陽性となるまでに必要な薬剤処理時間が異なっております。最適な薬剤処理時間をご検討ください。
製品一覧
- 項目をすべて開く
- 項目をすべて閉じる
- 掲載内容は本記事掲載時点の情報です。仕様変更などにより製品内容と実際のイメージが異なる場合があります。
- 掲載されている製品について
- 【試薬】
- 試験・研究の目的のみに使用されるものであり、「医薬品」、「食品」、「家庭用品」などとしては使用できません。
- 試験研究用以外にご使用された場合、いかなる保証も致しかねます。試験研究用以外の用途や原料にご使用希望の場合、弊社営業部門にお問合せください。
- 【医薬品原料】
- 製造専用医薬品及び医薬品添加物などを医薬品等の製造原料として製造業者向けに販売しています。製造専用医薬品(製品名に製造専用の表示があるもの)のご購入には、確認書が必要です。
- 表示している希望納入価格は「本体価格のみ」で消費税等は含まれておりません。
- 表示している希望納入価格は本記事掲載時点の価格です。



