遺伝子実験
DNAは生物の設計図である遺伝子を構成する化合物です。DNAに関する研究は生命科学分野の発展に大きく貢献しており、現在では診断や治療、食物、エネルギーなど人類の豊かな暮らしの基盤を作ってきました。当社ではDNA研究に関する試薬を幅広く取り扱っています。
学術コンテンツ
DNAとは?

デオキシリボ核酸(Deoxyribonucleic acid / DNA)は、生物の遺伝情報を記録・伝達するための化学物質です。五炭糖である2’-デオキシリボースとりん酸、塩基から構成されています。DNAの塩基にはプリン骨格を持つアデニン(Adenine / A)とグアニン(Guanine / G)、ピリミジン骨格を持つシトシン(Cytosine / C)とチミン(Thymine / T)の4種類が存在します。アデニンとチミン、グアニンとシトシンは水素結合によって相補的な塩基対を形成することができます。
DNAにおける核酸の最小単位は、2’-デオキシリボースの1’位に塩基、5’位にりん酸が結合したデオキシリボヌクレオチドです。デオキシリボヌクレオチド同士は、デオキシリボースの5’ 位のりん酸と3’ 位のヒドロキシ基の間のりん酸エステル結合で直線上に連結され、細長いポリヌクレオチド鎖となります。お互いがお互いの鋳型となるように構成された2本のポリヌクレオチド鎖は逆平行に向かい合って、二重らせん構造の二本鎖DNAを形成します。
塩基の並び方は塩基配列と呼ばれ、これが遺伝情報の本体となります。塩基を3つ並べたものをコドンといい、コドン1つでアミノ酸1つをコードしています。DNAは5’方向から3’方向に読み出され、最終的にコードされたアミノ酸を合成します。
RNAとは?
リボ核酸(Ribonucleic acid / RNA)は、五炭糖であるリボースとりん酸、塩基から構成されるリボヌクレオチドがつながった核酸であり、塩基にはプリン骨格を持つアデニン(Adenine / A)とグアニン(Guanine / G)、ピリミジン骨格を持つシトシン(Cytosine / C)とウラシル (Uracil / U)の4種類が存在します。アデニンとウラシル、グアニンとシトシンは水素結合によって相補的な塩基対を形成することができます。
RNAは主に遺伝子情報の伝達や発現に関与しており、DNA上の遺伝情報が転写されたメッセンジャーRNAを始め、メッセンジャーRNAとアミノ酸をつなぐアダプターのトランスファーRNA、翻訳に不可欠なリボソームを構成するリボソームRNAなどが存在します。
RNAは通常、一本鎖の状態で存在しており、DNAのような二重らせん構造の制約を受けません。そのため、塩基配列によっては局所的にステムループなどの二本鎖構造を形成することができ、さらに複雑な三次元構造をとるものもあります。高次構造をもつRNAには触媒活性を有するものも存在し、細胞内で酵素としてふるまうRNAはリボザイムと呼ばれています。代表的なリボザイムとして、前駆体RNAからtRNAを切り出すRNase Pなどが知られています。
DNAとRNAの違い
デオキシリボ核酸(DNA)とリボ核酸(RNA)は良く似ていますが、以下の点で異なります。
①DNAの主鎖に使用される糖は2’-デオキシリボースであるが、RNAは2’位にヒドロキシ基を含むリボースである。
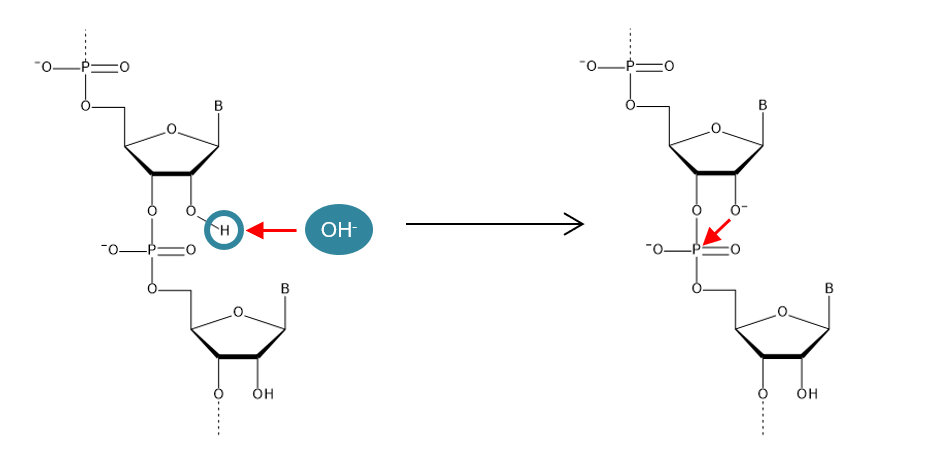
2’位のヒドロキシ基の存在は、核酸の安定性に大きな影響を及ぼします。一般的にRNAはDNAより不安定とされていますが、その理由はこの2’位のヒドロキシ基にあります。2’位のヒドロキシ基にあるプロトンは塩基性物質に引き抜かれやすく、プロトンを失った酸素原子はホスホジエステル結合を形成しているりん原子を攻撃し、リボヌクレオチド同士の結合を切断してしまいます(図1)。同様のメカニズムでRNAを分解するRNA分解酵素(RNase)も存在し、弱塩基性条件下やRNaseの存在下だとRNAは容易に分解されてしまいます。
2’位のヒドロキシ基をO-O-メチル基(-OMe)に変えた修飾ヌクレオチドは、五員環の構造がリボヌクレオチドと同様のC3’-endo型(5′位の炭素と3′位の炭素が同じ方向に突出する)をとる上に、加水分解されにくいため、核酸医薬などの分野で良く利用されています。
②DNAは塩基にチミンを利用しているが、RNAはチミンの代わりにウラシルを利用している。
DNAはチミン、RNAはウラシルと利用する塩基は異なりますが、チミンとウラシルの違いは5’位のメチル基の有無のみで構造的には非常に似ており、チミンは5’-メチルウラシルと呼ぶこともできます。そのためどちらもアデニンと相補的結合を形成することができます。
DNAにウラシルが利用されなかった理由は、ウラシルがシトシンの脱アミノ反応により自然に生じる塩基であるためと考えられています。DNAの塩基としてウラシルを利用してしまうとシトシンの脱アミノ反応で生じたウラシルと本来のウラシルを識別できませんが、DNAにウラシルが含まれていなければ、DNAの修復機構はシトシンの脱アミノ反応で生じたウラシルを異常として認識でき、その部分をシトシンに修復することができます。
RNAの種類と機能
細胞内には様々な種類のRNAが存在しており、それぞれ細胞内で重要な役割を担っています。ここではRNAの種類とその機能を紹介します。
▼メッセンジャーRNA (messenger RNA / mRNA)
mRNAはRNAポリメラーゼによって遺伝子(DNA)から転写された、タンパク質の配列情報をコードするRNAです。真核生物では核内でDNAから転写されると、RNAキャップ形成やポリアデニル化、スプライシングなどのRNAプロセシングを受けます。プロセシングを受けた成熟mRNAは核外に輸送されタンパク質に翻訳されます。一般的な哺乳細胞では全RNAの1~5%がmRNAと言われています。
DNAのように細胞核へ移行させる必要がなく、ゲノムへ組み込まれる可能性も低い一方で、タンパク質に比べて生産や改変が容易であることから核酸医薬やワクチンの分野でも注目されています。生体へ投与した場合の安定性の低さや免疫原性が課題となっていましたが、修飾塩基やキャッピング(Cap1)の適用、ドラッグデリバリーシステムの発展などにより実用化されるようになりました。
▼トランスファーRNA (transfer RNA / tRNA)
tRNAはコドンとコドンが指定するアミノ酸をつなぐアダプターの役割をするRNAです。tRNAはクローバー型の構造をしており、その中にmRNAのコドンと相補的に結合するアンチコドン領域とコドンに適合するアミノ酸が結合する領域が存在します。哺乳細胞では全RNAのうち15~20%を占めています。
▼リボソームRNA (ribosomal RNA / rRNA)
rRNAはリボソームタンパク質とともに翻訳装置であるリボソームを構成するRNAです。一般的な哺乳細胞では全RNAのうち80~85%を占めており、遠心力をかけたときの沈降速度から真核生物では5S / 5.8S / 18S / 28S、原核生物では5S / 16S / 23SのrRNAが存在することが明らかになっています。 rRNAのなかには三次元構造をとり、タンパク質を翻訳する際にアミノ酸同士のペプチド結合形成を触媒するリボザイムとしてはたらくものもあります。
▼マイクロRNA (micro RNA / miRNA)
microRNAは約22塩基からなる機能性小分子RNA(small RNA)の1種で、遺伝子発現を転写後レベルで制御するガイド分子として機能し、様々な生体機能を担っていることが報告されています。ヒトやマウスでは1,000種類以上のmicroRNAがコードされていると考えられており、新規microRNAの機能解明や疾患に関連するmicroRNAの探索など世界中で盛んに研究が進められています。また、細胞内だけでなく血液などの体液中にmicroRNAが存在することが報告され、がんなど疾患の臨床診断マーカー分子としても注目を集めています。
なお機能性小分子RNAとしてmiRNAの他に内在性siRNA (endogenous small interfering RNA)やpiRNA (PIWI-interacting RNA)などがあり、それぞれ塩基数が若干異なっています。結合するAGOタンパク質も異なるため、これらの結合タンパク質を利用した免疫沈降などで単離することが可能です。
その他のRNA
その他にも核内に存在し、RNAスプライシングなどに関与する核内小分子RNA (small nuclear RNA / snRNA)や核小体に存在し、rRNAの修飾などに関与する核小体低分子RNA (small nucleolar RNA / snoRNA)が機能性小分子RNAとして古くから知られています。
遺伝子工学実験の歴史
1953年にJ. Watson、F. CrickによってDNAの二重らせん構造が提唱されました1)。互いに逆方向に結びついた2本のらせんのそれぞれが塩基を内側に、デオキシリボースと結合したりん酸が外側に向くように配置されていること、一方のらせんの塩基がAであれば対となる塩基は必ずT、また一方がGであれば対となる塩基は必ずCであること、そして互いに向き合った塩基は水素結合で結ばれ、らせん構造を安定化させていることが示されました。これはすなわち、遺伝情報の複製の仕組みを暗示し、DNAが遺伝情報を含んでいることを示唆するものでした。1958年には、F. Crickによってセントラルドグマが提唱され2)、遺伝情報がDNAからmRNAに転写され、翻訳されてタンパク質として発現するという一連の流れが解明されました。
その後、1966年にB. WeissとC. RichardsonによってDNAを連結させるDNAリガーゼが分離され、1968年にスイスのW. ArberとアメリカのH. Smithによって遺伝子の中の特定の塩基配列(回文構造)を認識して切断する 制限酵素が発見されました。さらにスタンフォード大学のP. Bergは1972年に発がんウイルスSV40のDNAを大腸菌に導入する遺伝子組換え実験に成功し、翌年にはS. CohenとH. Boyerがプラスミドを用いた大腸菌の遺伝子組換え技術を開発しました。
このような遺伝子組換え技術の進歩に危機感を覚えたP. Bergをはじめとする主要な研究者たちは、1975年カリフォルニア州にてアシロマ会議を開き、遺伝子組換えの潜在的な危険性について論議し、基本的なガイドラインが定められました。1980年代前半までには遺伝子工学が確立し、多くの遺伝子がクローニングされました。1982年には世界初の遺伝子組換え製剤としてヒトインスリンが承認されています。
1983年には新たな遺伝子増幅法としてポリメラーゼ連鎖反応(Polymerase Chain Reaction / PCR)法が考案され、目的とする遺伝子の複製が容易に行えるようになりました。また1976年に発見されたTaq DNAポリメラーゼ3)を利用したPCR法の自動化が実現し、一般的な実験技術として一気に普及しました。これによりDNA鑑定や遺伝子診断・治療への応用が開始されました4) 5)。1993年にはPCR法を発明したK. Mullisにノーベル化学賞が授与されています。
PCR法が考案された同年1983年にはA. Feinberg とB. Vogelsteinにより大腸がん組織でDNAの低メチル化が存在していることが報告され6)、ヒトにおいてがんの発生にエピジェネティクスが関与していることが示唆されました。1987年、R. Hollidayは発がん及び老化におけるDNAのメチル化とエピジェネティクスの関連性について報告しました7)。これらはDNAの塩基配列を変えることなく遺伝子発現を制御・伝達するエピジェネティクス研究の先駆けとなります。
1990年代にはシークエンシング技術を用いた大規模ゲノム解析技術が確立し、多くの生物におけるゲノムプロジェクトが進展しました。ヒトゲノムプロジェクトが開始されたのは1990年で、2003年に終了しました。2005年には同時に数百万以上の膨大なシークエンス反応を同時に処理することができる次世代シークエンサー(Next generation sequencer / NGS)が実用化されました。NGSによって大規模なゲノム配列を短時間で決定することが可能になり、オーダーメイド医療や遺伝性疾患の診断・治療、また製薬などの分野で大きな役割を果たしています。またNGSはメタゲノム解析技術の発展をもたらし、微生物叢(マイクロバイオーム)の解析などが進展しました。
現在ではポストゲノム研究として、プロテオミクスやトランスクリプトーム、バイオインフォマティクスなど、より大規模かつ複雑な解析が行われています。またZFN、TALEN、CRISPR-Cas9などのゲノム編集技術の登場で一塩基レベルの遺伝子改変がより容易に行えるようになってきました。
参考文献
1) Watson, J. D. and Crick, F. H.:Nature, 171, 964(1953).
2) Crick, F. H.: Symp Soc Exp Biol, 12(138-63), 8(1958).
3) Chien, A., Edgar, D. B. and Trela, J. M. :Journal of bacteriology, 127(3), 1550(1976).
4) Saiki, R. K. et al.:Science, 230(4732), 1350(1985).
5) Mullis, K. B. and Faloona, F. A. :Methods in enzymology, 155, 335(1987).
6) Feinberg, A. P. and Vogelstein, B.:Nature, 301(5895), 89 (1983).
7) Holliday, R.:Science, 238(4824), 163(1987).
8) 平尾一郎, 胡桃坂仁志 編:「目的別で選べる核酸実験の原理とプロトコール」 (羊土社) (2011).
9) 塩見美喜子, 中川真一, 浅原弘嗣 編:「ノンコーディングRNAテキストブック」 (羊土社) (2015).
10) Watson, J. D.他著, 中村桂子 監訳:「ワトソン 遺伝子の分子生物学(第7版)」 (東京電機大学出版局) (2017).
製品ラインアップ
-
検体採取/保存
-
-
- 協同インターナショナル OMNIgene®・SALIVA
- 協同インターナショナル OMNImet®・GUT
- ニッポンジーン Gene Keeper RNA & DNA stabilization solution
- 協同インターナショナル Oragene®・Discover
- 協同インターナショナル OMNIgene®・VAGINAL
- 協同インターナショナル OMNIgene®・GUT
- 協同インターナショナル PERFORMAgene™
- 協同インターナショナル PERFORMAbiome™・GUT
- 協同インターナショナル OMNIgene ® ・ SKIN
- 協同インターナショナル OMNIgene®・ORAL
-
-
核酸抽出/精製
-
核酸増幅 (PCR / LAMP)
-
cDNA合成
-
遺伝子クローニング
-
核酸電気泳動
-
mRNA
-
-
- TriLink社 高収量mRNA IVT合成キット
- TriLink社 CleanCap® M6 ModTail mRNA
- TriLink社 CleanCap® AG (3' OMe) CleanScript™ IVT Kit
- TriLink社 CleanCap® saRNA
- CleanCap® ライセンス費用
- 天然ヌクレオシド三りん酸
- TriLink社 CleanScribe™ RNAポリメラーゼ
- Polysciences社 mRNA精製ビーズ
- RNA SHAPE試薬
- 修飾ヌクレオシド三りん酸
- TriLink社 mRNA受託合成サービス(in vitro転写合成)
- TriLink社 CleanCap® Reagent
- TriLink社 CleanCap® mRNA
-
microRNA
-
シークエンス
-
エピジェネティクス研究
-
マイクロバイオーム研究
-
ゲノム編集
-
核酸実験用汎用試薬
-
遺伝子発現解析試薬



