ニッポンジーン CLEAR STAIN Blue
本品はアガロースゲル電気泳動後の核酸を染色するための試薬です。
本品は核酸を青色に染色し可視化するため、検出用の装置を必要としません。また臭化エチジウム(EtBr)のような変異原性はなく、取り扱いは非常に安全で容易です。
【使用上の注意】
- 電気泳動の際には 6 x Loading Buffer Orange G など、ドデシル硫酸ナトリウム(SDS)が含まれていないローディングバッファーを使用してください。
ローディングバッファーに SDS が含まれているとゲルに染色されない丸い領域ができることがあります。 - CLEAR STAIN Blue 原液に塩が混ざると色素が析出して使用できなくなります。塩を含む溶液が付着した器具などを原液につけないようにしてください。
- 容器に色素が付着するため、染色用容器(タッパーなど)は本品専用としてください。衣服等に本品が付着しないようご注意ください。
製品内容
特長
- 変異原性はなく、非常に安全
- 専用の検出用装置を必要としません
使用回数
200 mlの染色液を調製する場合、20 ml のCLEAR STAIN Blueを180 ml の水に加えて撹拌します。10倍に希釈した染色液は使用頻度にもよりますが、数日から1週間以内であれば数回繰り返し使用できます。
使用例
使用の際には水(蒸留水、またはイオン交換水)または、泳動バッファー(1 x TAE, 1 x TBE)で10倍に希釈してください。アガロースゲルの大きさに合わせて、適当な大きさの容器(タッパー等)*1を準備します。ゲルが染色液に完全に浸る量を調製します。
*1 青色色素は容器に付着します。染色用容器は本品専用としてください。本品に接触するもの(容器や使い捨てスポイト等)は、色素が付着してもよいものを使用してください。
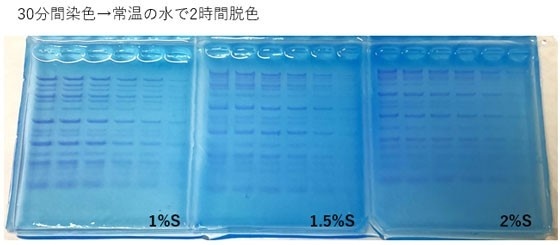
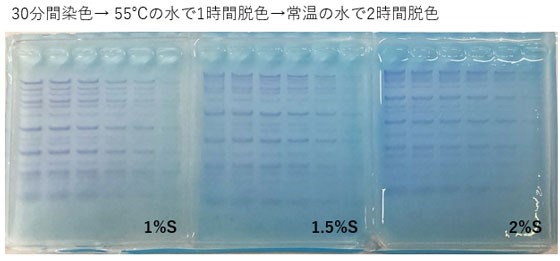
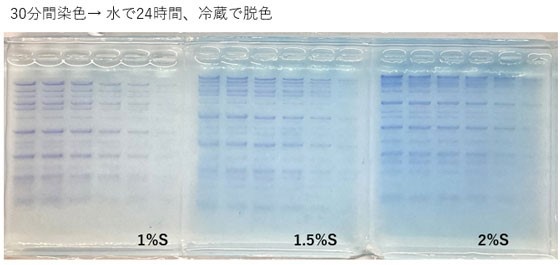
使用例1 各アガロースゲル濃度の脱色の程度
染色液として、CLEAR STAIN Blue を10倍に希釈した溶液を用意した。
1%、1.5%、2%の Agarose S ゲルに Gene Ladder Wide 1 を 6 μl、5 μl、 4 μl、 3 μl、 2 μl、 1 μl アプライし、電気泳動した。
電気泳動後のアガロースゲルを取り出し、染色液の中に30分間沈めて染色し、溶液から取り出したゲルを水の中に15分間、2時間、3時間、24時間 沈めて脱色を行った後、写真撮影した。

Q & A
- 脱色時間を短くするためシェーカー等で振とうした方がよいですか?
- 脱色は静置で問題なく進みます。また、振とうでゲルの割れ、欠けなど生じる可能性があるため、ニッポンジーンでは静置で実施しています。
より早く脱色したい場合はこまめに高めのお湯(60℃以下)を交換する方が早いです。
染色時間が長くなると、脱色時間も長くなります。
- バンドを見やすくする方法はありませんか?
-
アガロースゲルの厚さを薄くし、脱色時間を長くすると見やすくなります。

脱色時間が長すぎるとバンドがぼやける場合もあります。目的フラグメントのサイズ、ゲル濃度や厚み、染色時間にもよりますが、脱色時間は一晩よりも3-4時間程度の方がバンドが見えやすい傾向があります。
アガロースゲルの厚さは、アガロース濃度や強度、サイズによりますが、なるべく薄く(3-5 mm程度)すると見やすくなります。
工夫の一例として、図のように発泡スチロールの箱にラップを張って、その上にゲルを載せるとバンドが見やすいです。
- CLEAR STAIN Blueで染色後、ゲルから切り出したDNAはクローニングに使用できますか?
- CLEAR STAIN Blueで染色したDNAは、切り出し・クローニングに問題なく使用できます。また、EtBr/UV処理したものと比較しても同等以上の形質転換効率を得ています。
製品一覧
- 項目をすべて開く
- 項目をすべて閉じる
- 掲載内容は本記事掲載時点の情報です。仕様変更などにより製品内容と実際のイメージが異なる場合があります。
- 掲載されている製品について
- 【試薬】
- 試験・研究の目的のみに使用されるものであり、「医薬品」、「食品」、「家庭用品」などとしては使用できません。
- 試験研究用以外にご使用された場合、いかなる保証も致しかねます。試験研究用以外の用途や原料にご使用希望の場合、弊社営業部門にお問合せください。
- 【医薬品原料】
- 製造専用医薬品及び医薬品添加物などを医薬品等の製造原料として製造業者向けに販売しています。製造専用医薬品(製品名に製造専用の表示があるもの)のご購入には、確認書が必要です。
- 表示している希望納入価格は「本体価格のみ」で消費税等は含まれておりません。
- 表示している希望納入価格は本記事掲載時点の価格です。




