アセチルCoA検出蛍光プローブ
RH-NH2は、ミトコンドリアに局在することが知られているテトラメチルローダミン骨格を有する蛍光プローブです。本プローブはアミノ基がアセチル化されることによって蛍光強度が増大することから、細胞内のアセチルCoAを検出することが可能です。
アセチルCoAについて
アセチルCoAはエネルギー代謝で中心的な役割を果たす重要な中間体であり、炭水化物、アミノ酸および脂質を分解してエネルギーを得る場合、ほとんどがTCA回路でアセチルCoAとして酸化されます。同時に、アセチルCoAはヒストンのアセチル化反応におけるアセチル基の供与体でもあります。ヒストンは核に存在する塩基性のタンパク質であり、一般的にヒストンのアセチル化は遺伝子の発現を促進する方向に働きます。ヒストンアセチル基転移酵素によって、アセチル基がヒストンテールに付加されると、ヒストンの正電荷が減少し、ヒストンとDNAの間の電気的な相互作用が減少するために凝集したヌクレオソーム構造が緩み、RNAポリメラーゼがプロモーター領域に結合しやすくなるためです(図1)。 逆に発現を抑制する場合は、ヒストン脱アセチル化酵素によってアセチル基が除去され、その結果、ヒストンとDNAの結合が強固になり、遺伝子の発現は抑制されます。 がんでは、ヒストンの脱アセチル化によってがん抑制遺伝子の発現が負に制御されている例が報告されており、ヒストン脱アセチル化酵素は抗がん剤の標的として注目されています。以上のことから、アセチルCoAは代謝調節や遺伝子転写調節において重要な役割を担っていることが明らかになっており、細胞内のアセチルCoAを容易にアッセイできる方法が求められています。
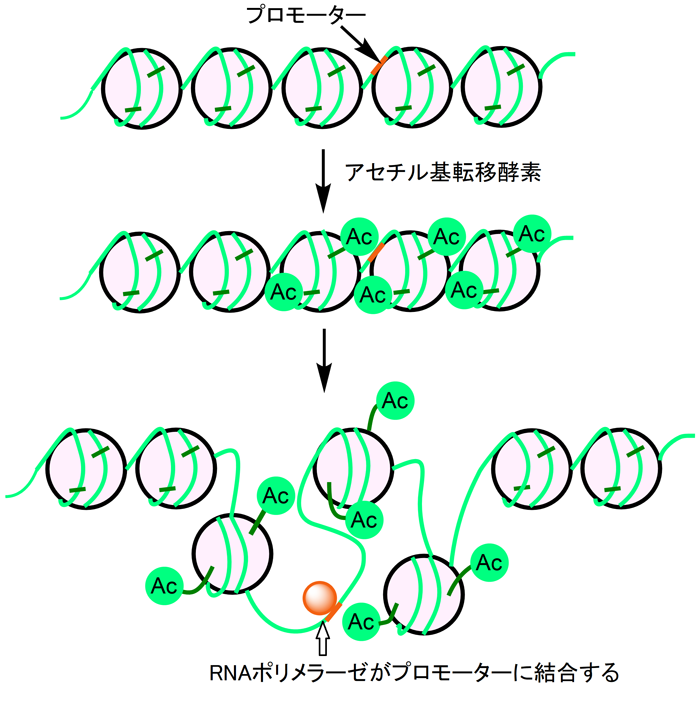
図1. ヒストンアセチル化によるクロマチン構造の変化
蛍光プローブRH-NH2について
細胞内のアセチルCoAを蛍光シグナルとして検知するには、アセチルCoAにより構造変化が誘起され、蛍光強度が増大する分子が必要です。東京大学の山次先生らは、蛍光プローブとともにアセチルCoAからアセチル基を転移させる反応促進剤を用いることで、細胞内でアセチルCoAから蛍光プローブへとアセチル基を転移し、それにより蛍光強度を増すことができないかと考えました。そこで、アセチルCoAが産生されるミトコンドリアに局在することが報告されているN,N,N’,N’-テトラメチルローダミンを蛍光プローブの母骨格に採用し、そのアミノ基がアセチル化を受けることでPhotoinduced-electron transfer (PET)メカニズムが解除されることにより蛍光強度が増大する蛍光プローブRH-NH2を設計しました(図2)。RH-NH2は546 nmに最大吸収波長(ε = 71400 M-1cm-1)と570 nmの最大蛍光波長を有し、そのアセチル化体であるRH-NHAc (図2)は553 nmの最大吸収波長(ε = 35500 M-1cm-1)と572 nmの最大蛍光波長を有します。また、PBS緩衝液中(1% DMSO)での蛍光量子収率はRH-NH2が4.9 x 10-4 であるのに対し、そのアセチル化体であるRH-NHAcは0.12を示し、520 nmの励起時においておよそ50倍の蛍光強度を示します(図3a)。したがって、RH-NH2はそのアミノ基がアセチル化を受けることによって蛍光強度が増大するturn-on型の蛍光プローブであることが示されました。
アセチルCoAからRH-NH2へのアセチル基の転移を促進する反応促進剤を検討したところ、tributylphosphine (PBu3)が最も効率よくRH-NH2へのアシル基転移を促進できると分かりました。図3bにはアセチルCoAと同じチオエステルであるThioester 1 (図2)をアセチル化剤、PBu3を反応促進剤として用いた時の、RH-NH2の蛍光強度の時間変化を示します。RH-NH2とThioester 1存在下、測定開始1分後に反応促進剤であるPBu3を添加することで速やかな蛍光強度の増大が見られました。その増大の程度は2〜3倍であり、RH-NH2が完全にアセチル化された際の50倍の蛍光強度の増大(図3a)と比べると低いものの、mMオーダーのアセチルCoAを蛍光検出できることが分かりました。
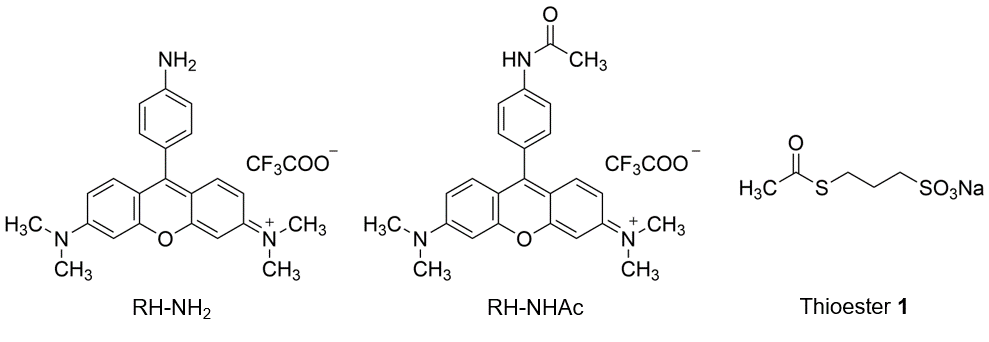
図2. 蛍光プローブRH-NH2の構造
RH-NH2、そのアセチル化生成物 RH-NHAc、アセチルCoA等価体 Thioester 1
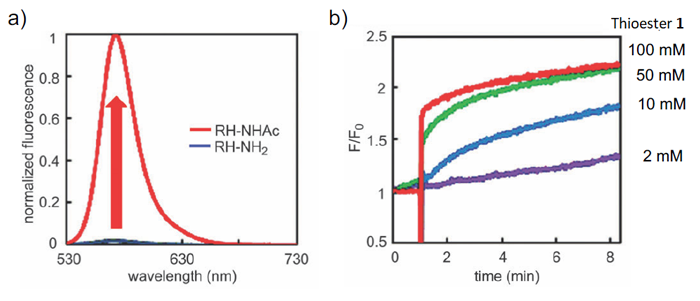
図3. RH-NH2の蛍光特性
a) RH-NH2のアセチル化による蛍光強度の増大 (励起波長520 nm)
b) アセチル基転移促進剤PBu3の添加によるRH-NH2の蛍光増大の時間変化
HeLa S3細胞をRH-NH2 (2 µM)で処理したところ、予想通りミトコンドリアに局在して弱い蛍光を発する様子が観察されます。このままでは蛍光強度の増大は見られませんが、ここにアセチル基転移促進剤であるPBu3 (5 mM)のDMSO溶液を加えたところ、1分以内に明らかな蛍光強度の増大が見られました(図4)。これは反応促進剤であるPBu3がアセチルCoAを活性化してミトコンドリアに局在しているRH-NH2プローブをアセチル化し、蛍光強度の増大が起こったものと考えられます。なお、PBu3 (5 mM)やRH-NH2 (10 µM)の添加では細胞毒性やミトコンドリアの膜電位変化が生じないことを確認しています。

図4. RH-NH2による細胞内アセチルCoAの蛍光検出
<参考文献>
1) Komatsu, H. et al. : Chem. Commun., 49 (28), 2876 (2013).
2) 山次健三, 金井求 : 和光純薬時報, 90 (1), 11 (2022).
製品一覧
- 項目をすべて開く
- 項目をすべて閉じる
- 掲載内容は本記事掲載時点の情報です。仕様変更などにより製品内容と実際のイメージが異なる場合があります。
- 掲載されている製品について
- 【試薬】
- 試験・研究の目的のみに使用されるものであり、「医薬品」、「食品」、「家庭用品」などとしては使用できません。
- 試験研究用以外にご使用された場合、いかなる保証も致しかねます。試験研究用以外の用途や原料にご使用希望の場合、弊社営業部門にお問合せください。
- 【医薬品原料】
- 製造専用医薬品及び医薬品添加物などを医薬品等の製造原料として製造業者向けに販売しています。製造専用医薬品(製品名に製造専用の表示があるもの)のご購入には、確認書が必要です。
- 表示している希望納入価格は「本体価格のみ」で消費税等は含まれておりません。
- 表示している希望納入価格は本記事掲載時点の価格です。



