【連載】アミノ酸分析~新たな潮流~ 「第 3 回 アミノ酸分析の新しい潮流② キラルに着目したアミノ酸分析」
本記事は、和光純薬時報 Vol.87 No.1(2019年1月号)において、味の素株式会社 イノベーション研究所 唐川 幸聖様、原田 真志様に執筆いただいたものです。
はじめに
生体を構成している化合物の多く、例えば糖、核酸、アミノ酸、タンパク質など、これらのほとんどは「キラルな化合物」である。不思議なことに、現存する生命の多くがキラル化合物の一方の立体を選択的に利用しており、この偏った状態のことを「ホモキラリティ」と呼んでいる。
一対のキラル化合物(エナンチオマー)は、旋光性以外の物理的、化学的性質が全く同じであることが知られているが、「ホモキラリティ」の状態である生体中では全く違う働きをするものが多い。例えば、医薬品サリドマイドの光学異性体の一方が催眠作用を持つが、もう一方の立体は生体内での働きが全く異なり、その催奇形性が判明したことはとても有名な話である。
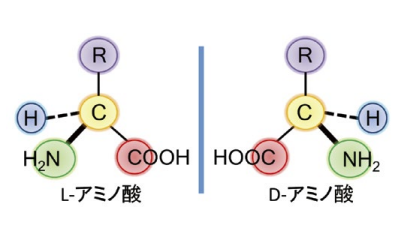
図1.L- および D- アミノ酸の構造
医薬品だけでなく、より身近な例としてはアミノ酸のキラリティがある。タンパク質を構成するアミノ酸はアミノ基α位の炭素にキラル中心を持っており、エナンチオマーは L 体、D 体として区別される(図1)。タンパク質の構造として用いられるものも含め、生体中のアミノ酸の大部分は L 体であり、マイナーな D 体の存在に関しては「意味のないもの」として古くから議論されてこなかった。
しかしながら近年、D-アミノ酸が細菌のペプチドグリカン構成成分として産生、利用されていることや、環境応答因子として機能していることが明らかとなってきた1)。また、D-アミノ酸は身近な発酵食品や醸造酒中に多く含まれていることや2)、アミノ酸の L 体と D 体で味が異なることが知られている3)。さらには、哺乳動物においても D-セリンが脳で記憶や学習に機能していること4, 5)など、L-アミノ酸とは異なる機能を有することが様々な生物種で明らかとなり、アミノ酸を D 体と L 体に分けて分析する重要性が高まってきている。
キラルなアミノ酸を区別する
これまで様々な方法でキラルなアミノ酸を区別することが試みられてきた。エナンチオマーの唯一の物理的特質の違いである「旋光性」を利用した旋光度計、円二色性検出器を用いた検出法では光学純度を直接測定することができる。また、エナンチオマーを分離し個々に検出する方法では、「別のキラル化合物」を用いて「キラルを認識」させることによって、キラル化合物を区別し、分離している。これは例えるならば、差し出された手(=キラル化合物)が右手か左手かを区別するときに、こちらが右手を出して正しく握手できたら右手、できなければ左手である、という方法と似ている。
分析の世界では、認識に用いる「別のキラル化合物」のことを「キラルセレクター」と呼んでおり、汎用的分離手法は、キラルセレクターの使い方によって大きく2つに分類される。
一つは、キラルセレクターを固定相に担持(または移動相に添加)することにより、カラム中にキラルな環境を持たせたキラル固定相法(またはキラル移動相法)であり、直接法ともいわれる。もう一つの方法は、キラルセレクター自体を誘導体化試薬として分析種と反応させる方法がある。この方法はキラル誘導体化法、もしくは間接法と言われており、性質が同じで分離できないエナンチオマーを、化学的性質の異なる立体異性体であるジアステレオマーに変換することができ、分離にはキラルでないカラムを用いる。
どちらの方法も、液体クロマトグラフィー(LC)、ガスクロマトグラフィー(GC)、超臨界クロマトグラフィー(SFC)、キャピラリー電気泳動(CE)など様々な分離方法が用いられる6)。
本稿では、特に食品や生体試料中の微量な D-アミノ酸を、多量に含まれる L-アミノ酸や夾雑成分と分けて分析する方法について、LCを用いた直接法、間接法それぞれの長所、短所と合わせて紹介したいと思う。
キラルカラムを用いた D, L- アミノ酸分析
キラルなアミノ酸をキラルカラムで分離する方法は古くから検討されており、非常に信頼性が高い方法である。この方法では、キラルな分子が固定相に担持されたキラルカラムを用いて、水素結合、静電相互作用、π-π相互作用、疎水性相互作用などにより分析種のキラル化合物を認識し、分離する。キラルセレクターの選び方次第では、これらの相互作用がうまく噛みあい、非常に良好なキラル分離を達成することが可能であるため、ある特定の化合物をキラル分離する場合には非常に便利な方法である。
一方で、バラエティに富んだ構造を有するアミノ酸を幅広くキラル分離できる固定相は、非常に限られている。さらに、L-アミノ酸やその他の夾雑成分が多量に存在する食品や生体試料から微量な D-アミノ酸を分析するためには、選択性や感度が不足するケースも多い。そのため、プレカラム誘導体化、多次元LC、質量分析計(MS)など、選択性や感度を向上させる工夫をキラルカラムでの分離と組み合わせる方法が近年開発されている。
代表例として、プレカラム誘導体化と2次元LCを組み合わせることで選択性、感度ともに優れた分析法が報告されている7)。本法は、本連載第2回でも述べられているアミノ基と選択的に反応する誘導体化試薬、4- フルオロ -7- ニトロ -2,1,3- ベンズオキサジアゾール(NBD-F)を用いて化合物を誘導体化する。その後、1次元目の逆相カラムで各アミノ酸を分離、オンライン分取した後、2次元目のキラルカラムに分取したアミノ酸を順次導入していくことにより、アミノ酸の D, L 体を分離する。
本分析法では幅広いアミノ酸を一斉にキラル分析するため、独自に設計、作製されたキラルカラムを使用している8)。このような多次元 LC を用いた分析法は、1サンプルの分析に数時間から十数時間と長時間かかるが、非常に選択性が高く、夾雑成分の多い生体試料の分析では非常に信頼性が高く有用な手法である。
一方、キラルカラムを用いた非誘導体化での網羅的 D, L-アミノ酸分析法も開発されている。キラルなアミノ酸を一斉にキラルカラムにて分離し MS に導入することにより、質量(正確には m / z)の違いによりアミノ酸ごとの分離、検出を行う。代表例として、キラルクラウンエーテルを固定相に有するカラム(CROWNPAK CR-I(+),ダイセル)を用い、HILICモードの移動相で分析を行うことでプロリンなどの第二級アミノ酸を除く幅広いアミノ酸の良好なキラル分離を達成した分析法が報告されている9)。
本法では、1サンプルの分析時間が非常に短時間であり、誘導体化を行わないため、前処理がより簡便であるという特徴がある。高感度な MS を用いることにより微量な D-アミノ酸を検出できる一方で、マトリックス効果や、複雑な試料の分析では同じ m / zを有する夾雑成分の妨害を受けやすいことに注意する必要がある。
キラル誘導体化試薬を用いた D,L- アミノ酸分析
誘導体化試薬にキラルな構造を持たせてキラルセレクターとする、というのがキラル誘導体化法である。キラル化合物とキラル化合物を反応させることにより、キラルな化合物はジアステレオマーとなり、化学的性質が異なる化合物となる。そのため、キラルな環境を有さないカラムでもジアステレオマーを分離することが可能になる。
キラル誘導体化法は、キラルセレクターが固定相側に存在するキラルカラムを用いる方法よりも、より空間的に近い場所でキラルを認識することができ、誘導体化試薬の選択次第では非常に高い分離度で D, L-アミノ酸を分離することができる。また、誘導体化試薬の骨格として、「特定の官能基と選択的に反応する反応基」、「検出器に合わせて高感度に検出するための検出基」を持たせることにより、高選択的かつ高感度な分析が可能となる。
これまで様々なキラル誘導体化試薬が開発されてきた10)。多くの試薬のキラル骨格として、アミノ酸や糖といった天然由来の化合物が利用されており、用途に合わせて様々な試薬が使用されている。代表的なものにオルトフタルアルデヒド(OPA)とキラルチオールを用いて D, L-アミノ酸をジアステレオマーに誘導体化する方法が知られている2)。しかしながら、先述の通りアミノ酸は多様な構造と性質を持つため、幅広くアミノ酸を D, L- 分離することが難しかった。単一の試薬、単一の分離条件での D, L- アミノ酸の一斉分析はキラル誘導体化法の課題であった。
最近、軸不斉骨格を有する LC-MS / MS 分析用に設計された新しいキラル誘導体化試薬、(R) -BiAC(図2)が開発された11)。この試薬は第一級または第二級アミノ基を有する化合物と選択的に反応する。アミノ酸の不斉点付近に軸不斉骨格による良好な不斉場が構築されるため、D, L- アミノ酸の立体を良好に識別することが可能である。その結果、分離度Rs 1.9 以上の高い分離度ですべてのタンパク質構成アミノ酸 19 種類のキラル分離が 11.5 分という短時間で可能となった(図3)。
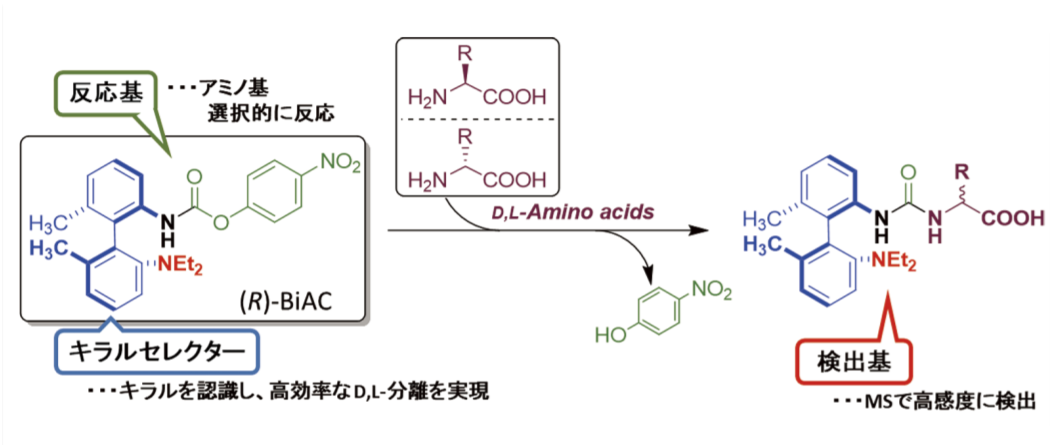
図2.(R)-BiAC の構造の特徴とアミノ酸との反応
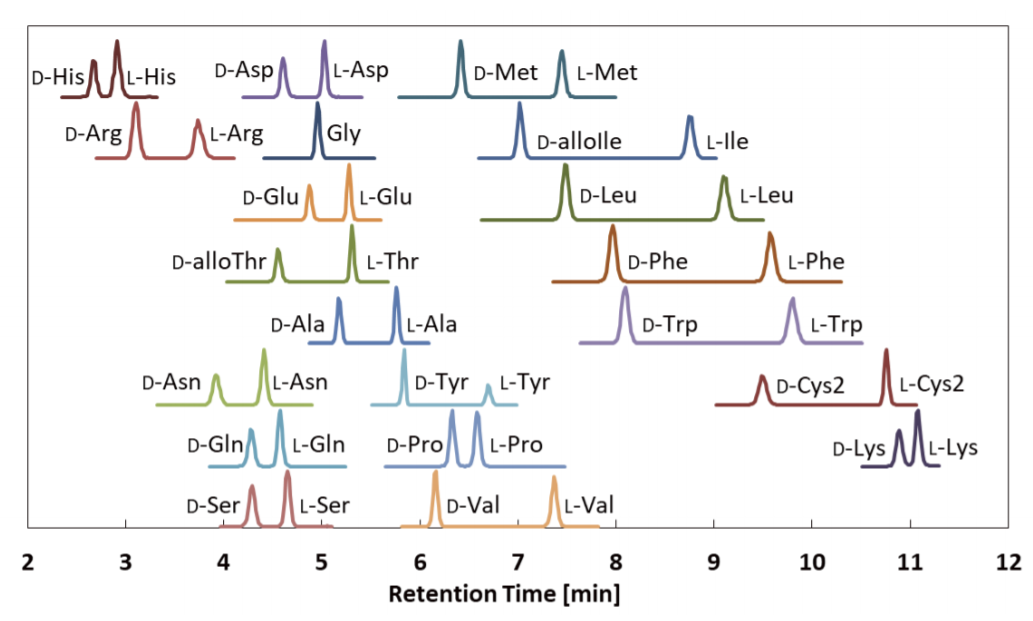
図3.(R)-BiAC によるアミノ酸標品 20 種類の抽出マスクロマトグラム
この試薬の最大の特徴は、D,L- アミノ酸の溶出順であえり、すべてのアミノ酸において D 体→ L 体の溶出順となっている。この溶出順は、生体試料中に微量に含まれる D- アミノ酸の検出に適した方法であるといえる。また、MS での感度を向上させるためのジエチルアミノ基を有しており、1 インジェクションあたり atto モルレベルでの高い感度が実現できる。
本分析法では、高い光学純度の誘導体化試薬を準備する必要があることや、MS の分析に伴うマトリックス効果の補正のため安定同位体標識された内標準物質を準備する必要があるものの、誘導体化試薬とカラムを準備すれば、汎用の LC-MS / MS 装置で D, L- アミノ酸の一斉分析を実施することができるというメリットがある。今後、本 (R)-BiAC を用いる分析法は様々なサンプルの D, L-アミノ酸をはじめとするキラル化合物の分析に応用されていくと期待される。
おわりに
これまでのシリーズで、非常に多様なアミノ酸分析の方法が紹介されてきた。キラルアミノ酸分析はさらに多様であり、測りたいサンプルの種類、アミノ酸の種類、必要な精度や感度などに合わせてこれらの分析法を選択する必要がある。今後のキラルアミノ酸分析法の発展と、それを用いたさらなる D- アミノ酸の研究成果が、人々の暮らしに貢献できることを期待し、本稿を終えたい。
参考文献
- Aliashkevich, A. et al. : Front Microbiol., 9, 683 (2018).
- Gogami, Y. et al. : J. Chromatogr. B, 879, 3259 (2011).
- Kawai, M. et al . : Amino Acids , 43, 2349 (2012).
- Nishikawa, T. : J. Chromatogr. B, 879, 3169 (2011).
- Kakegawa, W. et al. : Nat. Neurosci., 14, 603 (2011).
- Kirschner, D. L. et al. : J. Sep. Sci., 32, 2305 (2009).
- Hamase, K. et al. : Anal. Sci., 25, 961 (2009).
- Furusyo, A. et al. : Chromatography, 39, 83 (2018).
- Nakano, Y. et al. : J. Biosci. Bioeng., 123, 134 (2017).
- Ilisz, I. et al. : J. Pharm. Biomed. Anal., 47, 1 (2008).
- Harada, M. et al. : 特願 2015-197070








