【連載】核酸医薬合成基礎講座 「番外編 オリゴヌクレオチドの精製」
本記事は、和光純薬時報 Vol.87 No.1(2019年1月号)において、サイエンスライター 佐藤 健太郎 様に執筆いただいたものです。

前回までに、主に固相合成法によって、オリゴヌクレオチドを合成する方法について記してきた。固相担体に結びつけたヌクレオチド鎖を必要なだけ伸長し、脱保護及び担体からの切り出しを行うことで、合成は完了する。
ただし、こうしてできた合成ヌクレオチド鎖は、さまざまな不純物を含む。合成の途中で徹底的に洗浄を行うとはいえ、各種不純物の残存は完全には避けられない。
不純物の中でも一番厄介なのは、伸長反応や脱保護の失敗によって生じた、目的物よりも短いオリゴヌクレオチド類である。これらは性質が目的物に類似しているため、基本的に分離が難しい。キャッピング反応を各段階であらかじめ行っておくことで、精製困難な不純物の生成をかなり抑えられるが、場合によっては除去に苦労するケースも多い。
どの程度こうした不純物の残存を許すかは、使用目的による。一般的な PCR(ポリメラーゼ連鎖反応)のプライマーに用いる場合であれば、神経質に高純度を求める必要はないが、用途によっては不完全なヌクレオチド鎖をできる限り除去する必要が出てくる。人体に投与する核酸医薬では、最高レベルの純度を求められるのはもちろんのことである。また、ヌクレオチド鎖長や修飾状態(蛍光タグなどが組み込まれているか否か)によっても、精製方法は変わってくる。
リボヌクレアーゼへの対策
オリゴヌクレオチドの中でも、RNA 合成における特有の問題として、酵素による分解がある。リボヌクレアーゼ(RNase)は多くの生物に普遍的に存在し、効率よく RNA を分解してしまう。研究者の手に付着した細菌、空気中に浮遊する各種微生物もこの RNase を持っており、大切な合成 RNA を破壊してしまう。
これを防ぐため、研究者はラテックスなどの実験用手袋を着用し、使い捨てのプラスチック製容器(RNase フリー)を用いて、無菌で操作を行わねばならない。ガラス製容器は 200℃で一晩加熱するなどして、滅菌処理を行っておく必要がある。また水なども滅菌済みのものを用い、氷冷状態で取り扱うなどの配慮が必要となる。
脱塩処理
オリゴヌクレオチドの精製には、いくつかの方法が知られており、これらを使い分け、あるいは併用することで目的の純度の生成物を得ることができる。
前回までに述べたように、固相担体上で合成されたオリゴヌクレオチドは、アンモニア水で処理することで、側鎖の脱保護と担体からの切り出しが同時に行われる。この状態では、合成に用いた溶媒、保護基の残渣であるイソブチルアミド、ベンズアミドやアクリロニトリル、アンモニウム塩及び、塩基配列に欠損のあるオリゴヌクレオチドなどが不純物として残存する。
真空下で溶媒を留去することで、過剰のアンモニアは除かれる。この水溶液に酢酸ナトリウムなどの塩を加え、リン酸部分をナトリウム塩とする。ここにエタノールを加えていくことで、オリゴヌクレオチドが凝集してくる。これを遠心分離によって沈降させ、上澄みを捨てることで、無機塩や保護基由来の低分子などをある程度除去することができる。
順相または逆相シリカを充填した短いカラムを用いた、脱塩処理も広く行われる。逆相カラムを用いる場合、トリエチルアミン−酢酸緩衝液などに合成オリゴヌクレオチドを溶解し、カラムにチャージして各種緩衝液などで流し出すことにより、低分子や無機塩などの不純物を除くことができる。
この操作では、保護基残渣などの低分子は除かれるが、不完全なオリゴヌクレオチド鎖は除去されず残存してしまう。ただし、用途が PCR のプライマーなどであれば、この程度の精製でも十分利用可能である。またこの脱塩工程は、HPLC など他の精製法の後に、塩類を除去する目的でも行われる。
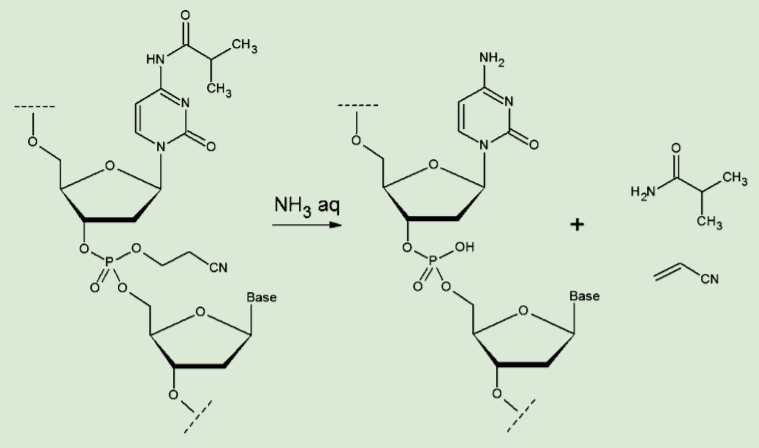
図1.オリゴヌクレオチドの脱保護
高速液体クロマトグラフィー(HPLC)
さらに高い純度が求められる場合には、HPLC が用いられる。多くの場合、シリカに C18 の炭化水素鎖を結合させた逆相カラムが利用される。条件の一例として、不純物を含んだオリゴヌクレオチド鎖を水溶液としてチャージし、酢酸アンモニウム水溶液で溶出する。徐々に移動相のアセトニトリル含量を上げていくことで、不完全なオリゴヌクレオチド鎖との分離を行う。
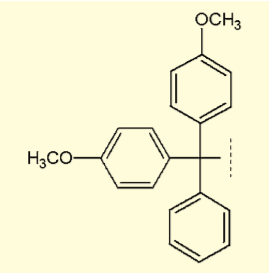
図2.4, 4'-ジメトキシトリフェニルメチル(DMTr)基
トリチルオンと呼ばれる分離手法もある。固相担体上でオリゴヌクレオチド鎖を必要なだけ延伸し、すぐさまアンモニア水処理することで、5'末端保護基の 4, 4'- ジメトキシトリフェニルメチル(DMTr)基を残したまま切り出すことができる(トリチルオン)。
この状態のオリゴヌクレオチド鎖を逆相カラムにチャージすると、脂溶性の高いトリチル基のために目的のオリゴヌクレオチドは吸着され、キャッピング処理された不完全なオリゴヌクレオチド鎖は早く溶出してくる。こうして不純物を十分流し出した後で、アセトニトリル含量を増やしていくことにより、目的のオリゴヌクレオチドを後から溶出させるというものである。
DMTr 基は酸処理で容易に切断できるので、これによって効率的な精製が可能となる。ただし、DMTr 基切断の際の酸処理により、アデニンやグアニンの脱アミノ化などの副反応が起きる可能性がある。
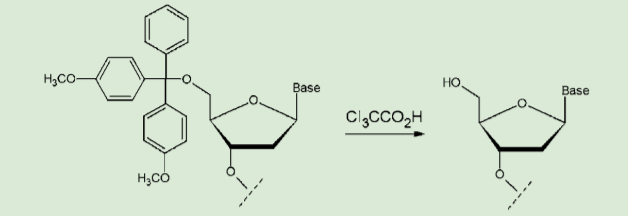
図3.DMTr 基の脱保護
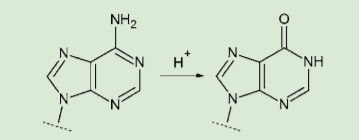
図4.アデニンの脱アミノ化
HPLC 精製に伴う問題点として、一本鎖オリゴヌクレオチドが分子内で水素結合を形成し、ヘアピンループなどの高次構造を作ってしまうケースがある。こうした場合では、ピークがブロード化するか、2 本に分裂してしまう。アルカリ性溶液を用いるか、カラムオーブンでカラムを温めることによって水素結合を破壊し、これを防ぐことができる。
また、核酸医薬を目指す場合に一般的に用いられる、ホスホロチオエートオリゴヌクレオチド(リン酸部分の P=O 結合が P=S 結合に変換されたもの)では、HPLC のピークがややブロードになることがある。これは、ホスホロチオエートのリン原子がキラリティを持つため、微妙に溶出時間が異なるジアステレオマーの混合物となるためである。
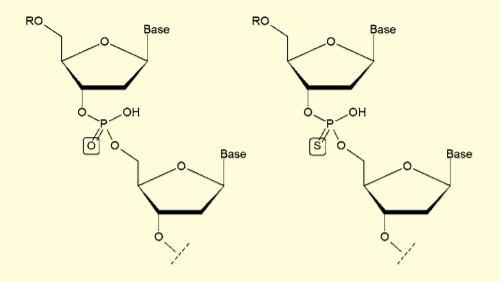
図5.通常のオリゴヌクレオチド(左)とホスホロチオエートオリゴヌクレオチド(右)
HPLC 法は、サイズの大きなカラムを用いることで、大規模な精製にも対応できる利点がある。ただし一般に、HPLC による精製は 50 塩基程度が限界であり、それ以上の長いオリゴヌクレオチド鎖では分離が困難になるケースが出てくる。
イオン交換クロマトグラフィー
クロマトグラフィーの固定相として、四級アンモニウム塩部位を持ったゲルを用いる方法である。オリゴヌクレオチドのリン酸基は負に帯電しているため、長いものほど強くゲルと相互作用する。これを利用し、長さの異なるオリゴヌクレオチドを分離できる。ただし、あまりに長いオリゴヌクレオチドでは分離能が低下するため、この方法は 40 塩基程度の長さまでに限られる。
ポリアクリルアミドゲル電気泳動法(PAGE)
オリゴヌクレオチドはリン酸基を持ち、マイナスの電荷を持つ。これを利用し、電気泳動を用いた精製法が可能になる。ポリアクリルアミドゲルは分子ふるい効果が大きく、分子量別に分離するのに適している。
フレーム内にアクリルアミド、ビスアクリルアミドなどを含んだ溶液を流し込み、重合開始剤を加えて重合させ、ゲルを作る。ここに精製したいオリゴヌクレオチド溶液を流し込んで電圧をかけると、オリゴヌクレオチドは陽極側に引かれて徐々に移動する。鎖長が異なると泳動する距離も変わるため、これを利用して不純物との分離が可能となる。
エチジウムブロマイドなどの蛍光剤は DNA に結合して紫外線照射で光るため、ゲル内のオリゴヌクレオチド検出を容易にする。目的物の分画をスライスして取り出し、これを洗い出すことによって、目的のオリゴヌクレオチド鎖を得る。目的のオリゴヌクレオチド鎖が長くなると、ゲルの網目からの回収が難しくなるが、ゲルをスパーテルなどでよくすりつぶすことで効率が向上する。
塩基数が 80 を超えると、他の方法での精製は難しいため、PAGE による精製がほぼ唯一の手段となる。ただし、ゲルからの完全な回収は困難であるため、必ずロスが出てしまうのがこの方法の難点である。
このように、オリゴヌクレオチドの精製法は複数あり、それらの特徴をよく知った上で使い分け、あるいは併用する必要がある。他のジャンルの実験同様、さまざまな方法を自分の手で試し、経験を積んでコツを掴むことが、結局は重要ということになるだろう。
》関連製品:核酸合成試薬









