【連載】アミノ酸分析~新たな潮流~ 「第 2 回 アミノ酸分析の新しい潮流① 質量分析を利用したアミノ酸分析」
本記事は、和光純薬時報 Vol.86 No.4(2018年10月号)において、東京大学大学院薬学系研究科 角田 誠様、住田 有子様に執筆いただいたものです。
はじめに
「あなたは、あなたが食べたものでできている。」というCMがあったのをご存知だろうか。
私たちの体の 20% はタンパク質でできている。タンパク質の構成成分であるアミノ酸を、私たちは食物から摂っている。特に、私たちの体内で合成することのできない必須アミノ酸は、食物から摂取する必要がある。アミノ酸は、タンパク質のもとになるだけでなく、神経伝達物質やその前駆体としての役割も担っており、私たちの生命活動を支えている。
私たちの体内のアミノ酸濃度変化は様々な病態と関連していることが報告されており、たとえば、血中アミノ酸分析は新生児マススクリーニングなどに利用されている。アミノ酸分析法のほとんどは、分離分析を利用している。タンパク質を構成するアミノ酸だけでも 20 種あり、それらを分離することが必須だからである。分離分析法として最も利用されているのが、液体クロマトグラフィー(LC)である。
LC を用いたアミノ酸分析法は、ノーベル化学賞受賞者の S. Moore とW.H. Stein によって、1958年に初めて開発された。本連載第1回において詳しく述べられているように、現在も、Moore と Stein によって開発された原理に基づくアミノ酸自動分析計が汎用されている。その原理は、イオン交換クロマトグラフィーによるアミノ酸分離とニンヒドリンを用いたポストカラム誘導体化・吸光度検出を組み合わせたものである。本分析法は精度に優れた分析法であるものの、分離時間が大変長い。また、試料によっては感度が十分でない場合もある。
そのため、これまでに、非常に多くの分析法が開発されてきた。実際、1958年から2017年の60年間に原著論文として報告されている、LCを用いたアミノ酸分析法だけでも 1600 報以上ある1)。しかし、何れの分析法にも何らかの欠点があり、未だに、どんなアミノ酸でも簡単に精度良く分析できる方法は開発されていない。それは、アミノ酸の分子構造が類似しているために分離が難しいこと、また、アミノ酸が吸収団や蛍光団を有しないことから検出が容易でないことに起因する。
近年の質量分析装置の発展に伴い、高い検出感度と選択制を有する分析法として、質量分析計(MS)を検出系とする、LC/MS 法が開発されるようになってきた。LC/MS 法は、LCにおける溶出時間とMSにおけるm / z値の組み合わせによる高い選択性を有する。そのため、LCによる分離が不十分な複数成分であっても、それぞれの質量ごとに分離して検出することにより分析が可能となる。
LC/MS法は、アミノ酸を含む低分子化合物の定量からタンパク質などの高分子化合物の分析まで広く用いられている。過去5年のLCを用いたアミノ酸分析法の原著論文は230報あり、そのうちの半数(118報)がLC/MS法を用いている2)。
本稿では、アミノ酸分析の新しい潮流として、LC/MS 法を用いたアミノ酸分析法について概説する。LC/MS法を用いたアミノ酸分析法は、非誘導体化分析法と誘導体化分析法の 2 つの方法に大別される。以下、それぞれについて述べる。
LC/MS 法を用いた非誘導体化アミノ酸分析
非誘導体化とは、その名のとおり、誘導体化を行わずに分析する方法である。つまり、アミノ酸分析においては、アミノ酸そのものを分離、検出することになる。誘導体化を行う手間や時間が不要なだけでなく、分析における再現性や生成物の安定性など、誘導体化に伴う問題を回避することができる。しかし、アミノ酸をそのままの状態で感度良く検出できる方法がなかったため、MSが検出系として用いられるようになるまで、アミノ酸の非誘導体化分析が主要な方法として注目されることはなかった。
アミノ酸の非誘導体化分析において、最も困難を伴うのは分離である。LC/MS 法による分析を行う場合、MSにおける高い選択制を利用することにより、アミノ酸の完全分離は必要ないように考えられる。しかし、同じm / zをもつアミノ酸(代表的なものとしてロイシン(Leu)とイソロイシン(Ile)がある。他にも多くの組み合わせが存在する。)は、MSにて分離することは不可能であるため、LCにおける分離が必須である。
一般的な低分子化合物の分離には、オクタデシルシリル(ODS)カラムのような逆相カラムが広く用いられている。アミノ酸は、アミノ基とカルボキシル基を持つ化合物の総称であり、通常は水溶液中でイオンとして存在するため親水性が高い。そのため、疎水性分子を強く保持する逆相カラムでアミノ酸を保持させることは困難である。保持できなければ分離できないことは言うまでもない。
LC/MS 法を用いたタンパク質構成 20 種アミノ酸の分析法が初めて報告されたのは、1999年のことである 3)。この分析においては、揮発性イオンペア試薬であるトリデカフルオロヘプタン酸(TDFHA)を含む移動相が用いられた。2005年には、同様の移動相を用いたLC/MS分析によって、血漿中の 76 種アミノ酸が同定された。また、安定同位体標識内標準物質を用いることにより、16 種アミノ酸の定量に成功した 4)。
しかし、イオンペア試薬は、MSにおけるイオンサプレッションやMS装置の汚染の原因となることが報告されている。イオンペア試薬を用いた逆相カラムにおけるアミノ酸分離は、LC/MS 法におけるベストな分離方法であるとは言い難い。
近年、LCにおける新たな分離モードとして、親水性相互作用クロマトグラフィー(HILIC)が注目されている。HILICにおいては、イオンペア試薬を用いることなく、親水性化合物を保持、分離することができる。さらに、用いられる移動相がアセトニトリルを多く含むことから、逆相カラム使用時(基本的な移動相に水を多く含む)と比較して、分析対象物のMSにおけるイオン化を容易にし、その結果、より感度良く検出することが可能になる。そのため、非誘導体化アミノ酸の分離において、HILICが主に用いられるようになってきた。
HILICの固定相には、多くの種類がある。代表的な官能基として、シラノール基、アミド基、スルホベタイン基がある。分離対象物に適した固定相を選択することが、HILICにおいて良い分離をするために最も重要である5)。これまでの研究から、アミノ酸の分離にはアミドカラムが適していることが明らかになっている。
アミドカラムを用いたアミノ酸の分析例を一例紹介する6)。カラムには、Acquity BEH Amide column が用いられた。ギ酸とギ酸アンモニウムを含む水溶液とアセトニトリルの2つの移動相を用いたグラジエント溶離を行ったときに、最もよい分離が達成された。図1のクロマトグラムに示すように、23 種アミノ酸の 12 分での分離に成功した。開発した分析法を用いて、ナツメに含まれているアミノ酸の定量が行われている。
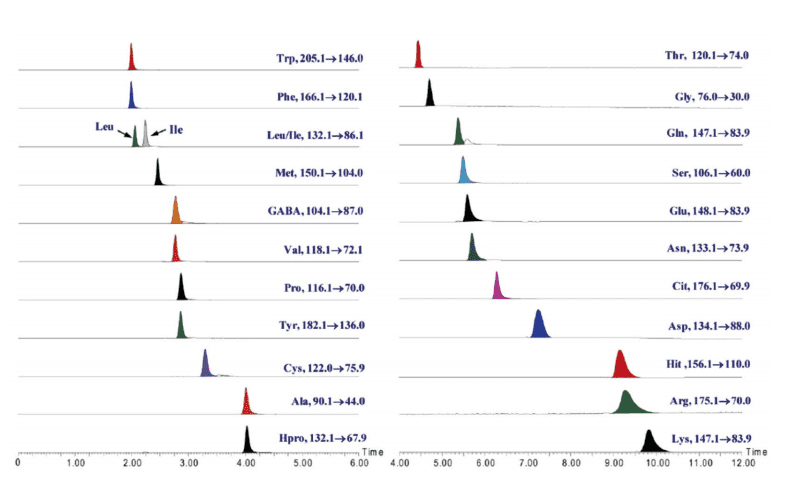
図1.アミドカラムを用いた非誘導体アミノ酸の分離(参考文献6)
非誘導体化分析は、アミノ酸を誘導体化せずに分析できる利点があることは前述のとおりである。しかし、生体試料や食品などの複雑なマトリックスを分析するときには、何らかの前処理が必須であることを最後に申し添える。
LC/MS 法を用いた誘導体化アミノ酸分析
本連載第1回にて述べられているように、誘導体化には、プレカラム誘導体化とポストカラム誘導体化の2つの方法がある。LC/MS 法を用いたアミノ酸分析においては、プレカラム誘導体化が主たる誘導体化法であることから、以下、プレカラム誘導体化を用いた方法についてのみ述べる。
LC/MS 法におけるプレカラム誘導体化には、LC 分離と MS 検出の両面において利点がある。LC 分離においては、アミノ酸を誘導体化することにより、多くの場合、疎水性が高くなる。そのため、汎用されている ODS カラムでの分離が容易となる。アミノ酸そのものの分離が難しいことは、前述のとおりである。
MS 検出においては、誘導体化したアミノ酸を測定することになるため、アミノ酸そのものより大きな m / z値を検出することになる。実試料中には、アミノ酸と同程度の分子量の化合物が多く存在する。アミノ酸を誘導体化することにより、それらの化合物による影響を抑えることができる。また、疎水性が高い化合物はイオン化効率が高いことが知られている。結果として、高感度検出が可能となる。
誘導体化において重要なことは、より良い分離をし、より高感度に検出を可能にする誘導体化試薬を選ぶことである。MS に用いられる誘導体化試薬の中には、吸光度あるいは蛍光検出用に開発された既存の誘導体化試薬を転用した例が報告されている。6- アミノキノリル -N- ヒドロキシスクシンイミジルカルバメート (AQC)、ダンシルクロリド(DNS-Cl)、9- フルオレニルメチルクロロフォルメート(FMOC-Cl)、4- フルオロ -7- ニトロ -2,1,3- ベンズオキサジアゾール(NBD-F)やオルトフタルアルデヒド(OPA)などの誘導体化試薬である。
これらの試薬による誘導体化アミノ酸の分離条件はこれまでに最適化されており、分離の面においては優れている。しかし、必ずしも、MS に適した誘導体化試薬ではない。一方、MS における感度向上を目的とした誘導体化試薬として、N, N-ジメチル -2,4- ジニトロ -5- フルオロベンジルアミン(DMDNFB)や N- アルキルニコチン酸N- ヒドロキシスクシンイミドエステル(Cn-NA-NHS)などが開発された。これらは、それぞれ第3級アミンや第4級アンモニウム部位を有するため、アミノ酸誘導体の MS におけるイオン化効率が高くなり、高感度検出を可能にしている。
2009年に p- トリメチルアンモニウムアニリル -N- ヒドロキシスクシンイミジルカルバメート (TAHS)と 3- アミノピリジル -N- ヒドロキシスクシンイミジルカルバメート (APDS)の 2 つの誘導体化試薬が開発された。両試薬の活性カルバメート基は、弱アルカリ性の緩衝液中、55℃という穏やかな条件下、短時間でアミノ酸のアミノ基と反応し、安定なウレイド化合物を生成する(図2)。これらの誘導体は、LC/MS 分析における利点を有している。
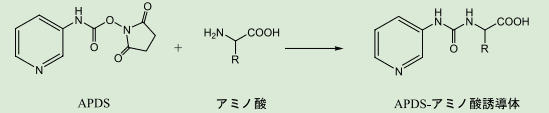
図2.APDS とアミノ酸の反応式
分離においては、アミノ酸そのものよりも疎水性が高まっており ODS カラムにおける分離に適している。APDS の方が TAHS と比較すると疎水性が高いため、より分離が容易である。実際、TAHS 誘導体は、最適分離条件下、17 種アミノ酸が 20 分で分離された7)。一方、APDS 誘導体は、主要アミノ酸 20 種の他、アンセリン、シトルリン、タウリン、γ- アミノ酪酸等のアミノ酸関連物質を含む 38 種アミノ化合物がわずか 8 分で分離された(図3)8)。
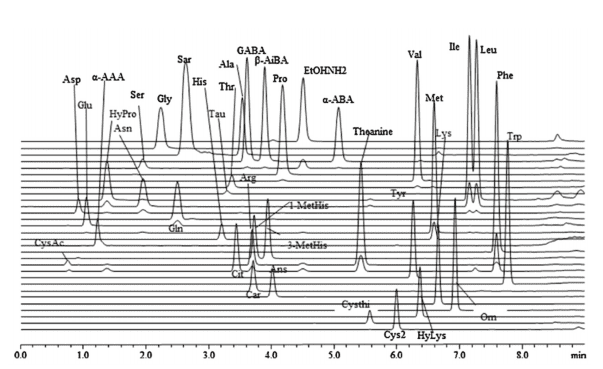
図3.APDS- アミノ酸誘導体の分離(参考文献 8)
検出においては、TAHS は第4級アンモニウム部位、APDS はアミノピリジル基を有するため、MS におけるイオン化効率が高まる。さらに、TAHS と APDS は、三連四重極質量分析計を用いた LC/MS/MS 分析に適した誘導体化試薬である。
三連四重極質量分析計(MS/MS)は、質量分離が可能な四重極(マスフィルター)が2つあり、それらの間に衝突室を有する。第一四重極(Q1)で特定の質量を持つイオン(プリカーサーイオン)のみを透過させて衝突室(Q2)に導入し、衝突室内で衝突ガス(コリジョンガス)との衝突によりイオンを開裂(衝突誘起解離:CID)させ、生じたイオン(プロダクトイオン)を第三四重極(Q3)で質量分解することができる。
TAHS と APDS は、CID において、アミノ基との結合部位であるウレア結合が特異的に開裂するよう設計されており、規則的なプロダクトイオン(それぞれ m / z = 177, 121)を生成する(図4)。これを利用し、Q1 での m / zをアミノ酸誘導体のものに、Q3 での m / zを 177 または 121 と設定して選択反応モニタリング(SRM)を行うことで、目的とするTAHS- あるいは APDS- アミノ酸誘導体だけを MS クロマトグラム上に抽出することができる。
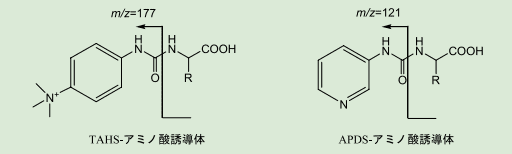
図4.TAHS- アミノ酸誘導体と APDS- アミノ酸誘導体の特異的開裂
複雑な試料マトリックスを分析する際には、この選択性の高さは極めて有用である。TAHS を用いた MS/MS 検出では、従来の蛍光検出用試薬を用いたアミノ酸の検出限界とされるフェムトモルレベルを、アトモルレベルへと大きく向上させた。APDS については、アミノ酸自動分析用キットである「アミノ酸キット APDS タグ®ワコー」や自動分析機器である「UF-Amino Station」の商業化も行われており、今後、一層の活用が期待される。
おわりに
長いアミノ酸分析の歴史の中にあって、LC/MS 法を用いたアミノ酸分析法の開発の歴史は浅い。本稿ですべての分析法を取り上げることはできなかったものの、感度や選択性に優れた多くの分析法が開発されてきた。近い将来、アミノ酸の標準分析法となるような方法が開発されることを期待して本稿を終える。
参考文献
- Web of Science (Clarivate Analytics)にて、"amino acid*"と、"liquid chromatography"または"LC"または"HPLC"をタイトルに含む論文数の検索結果。
- 1)と同様に検索した結果。LC/MS 法については、"mass spectrometry"または"MS"を追加して検索。
- Chaimbault, P. et al. : J. Chromatogr. A, 855, 191 (1999).
- Piraud, M. et al . : Rapid Commun. Mass Spectrom., 19, 1587 (2005).
- Isokawa, M. et al . : Bioanalysis , 6, 2421 (2014).
- Guo, S. et al. : J. Agric. Food Chem., 61, 2709 (2013).
- Shimbo, K. et al . : Anal. Chem ., 81, 5172 (2009).
- Yoshida, H. et al. : J. Chromatogr. B, 998-999, 88 (2015).








