【総説】動物を用いない高感度な皮膚感作性評価法 "ADRA" の紹介
本記事は、和光純薬時報 Vol.87 No.1(2019年1月号)において、富士フイルム株式会社 環境・品質マネジメント部 安全性評価センター 山本 裕介様、藤田 正晴様、笠原 利彦様、勝岡 尉浩様に執筆いただいたものです。

はじめに
動物福祉の観点から世界的に動物実験に対する規制が進んでいる。海外ではEU において、1993 年より段階的に化粧品原料に対する動物実験の規制が実施されており、2013 年以降 EU 加盟国における動物実験を使用した原料を含む化粧品類の販売が全面的に禁止 1)となった。
このような背景から、動物を使わない安全性試験(動物実験代替法)の開発が喫緊の課題となり、皮膚刺激性、眼刺激性、皮膚腐食性、皮膚感作性、光毒性などの動物実験代替法が、国際的に合意された試験方法として経済協力開発機構(OECD)のテストガイドライン(TG)に収載されている。国内では 2006 年に動物愛護管理法が改訂・施行 2)され、以降実験動物における3Rs ※の強化が進められてきた。
これを受けて、国内でも動物実験代替法の開発が盛んに進められており、眼刺激性試験代替法のShort Time Exposure in vitro test method3)(STE)(OECD TG491)、皮膚感作性試験代替法の human Cell Line Activation Test4)(h-CLAT)(OECD TG442E ; ANNEX I)およびInterleukin-8 Reporter Gene Assay5)(IL-8 Luc assay)(OECD TG442D ; Appendix IA)が TGとして収載されている。
また、代替法に使用される材料の開発も国内において行われており、3 次元培養皮膚モデルを用いた皮膚刺激性試験代替法の Reconstructed Human Epidermis Test Method6)(OECD TG439)や 3 次元培養角膜モデルを用いた眼刺激性試験代替法の Reconstructed Human Cornea-like Epithelium Test Method7)(RhCE)(OECD TG492)にジャパン・ティッシュ・エンジニアリング社製の皮膚モデルおよび角膜モデルが採用されている。
上記の化粧品業界に加えて、近年では EU における化学品の登録・評価・認可および制限に関する規則であるREACH 規則においても、2016 年 6 月にREACH 付属書ⅦおよびⅧの改訂がなされ、年間 10トン以下製造・輸入する物質は、皮膚腐食性および刺激性、眼刺激性、皮膚感作性試験について、動物実験代替法を標準の試験法とすることが義務づけられている。
本稿では、筆者らが新たに開発した皮膚感作性試験代替法であるAmino acid Derivative Reactivity Assay(ADRA)について説明する。
皮膚感作のメカニズムと代替法
皮膚感作性とは、皮膚が化学物質に暴露されることで引き起こされるアレルギー反応のことである。皮膚感作性は、体内の免疫系が化学物質を異物として記憶してしまうため、再度化学物質に暴露した際に過剰な反応を示し、紅斑(発赤)、浮腫(腫れ)および水疱(水膨れ)のような症状となって現れる。また、皮膚感作性は、皮膚刺激性の反応と異なり、免疫系の過剰な反応により重篤な症状を引き起こすことがある。さらに、免疫系を介するため、皮膚が感作性物質に暴露されてから症状が現れるまで複雑な過程がある。OECD では、このステップのうち 4 つの Key event(1. タンパク質と感作性物質の結合、2. 角化細胞の活性化、3. 樹状細胞の活性化、4. T 細胞の増殖)が定義されている8)。
現在、最も幅広く使用されているin vivo 皮膚感作性試験法としてマウスを使用したLocal Lymph Node Assay(LLNA)が知られており、この試 験 法は Key event 4 に基づいた評価法となっている。動物実験代替法では Key event 4を除く3 つの Key event に基づいた試験法として、Key event 1 では、Direct Peptide Reactivity Assay9)(DPRA)(OECD TG442C)、Key event 2 では、ARE-Nrf2 luciferase test method10)(KeratinoSens™)(OECD TG442D ; Appendix IA) および ARE-Nrf2 Luciferase LuSens11)(OECD TG442D ; Appendix IB)、Key event 3では、h-CLAT4), U937 Skin Sensitization Test12)(U-SENS)(OECD TG442E ; ANNEXⅡ)および IL-8 Luc assay5)の計 6 試験が収載されている。
感作性物質は、体内に入った後、タンパク質と結合して複合体を形成し、この複合体を免疫細胞の一つである樹状細胞が取り込むことで抗原(異物)として認識される。このタンパク質と感作性物質が結合して複合体を形成する過程がKey event 1 であり、2015 年に TG に収載された DPRAと同様に、筆者らが開発した ADRAもこの過程での反応性を評価する試験法である。
ADRAと DPRAの原理と比較
タンパク質と感作性物質の結合は、主にタンパク質に含まれるシステインのチオール基またはリジンのアミノ基との共有結合によるものであることが知られている13, 14)。そのため、DPRA ではシステインを含むペプチド(システイン含有ペプチド)とリジンを含むペプチド(リジン含有ペプチド)の 2 種類を用い、それぞれに対する被験物質の反応性からタンパク質との結合性を評価している15)。
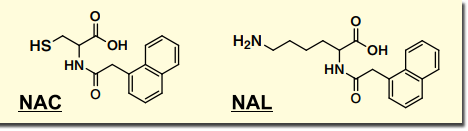
図1.NAC、NAL の構造式
これに対し、ADRA はシステインとリジンの 2 つのアミノ酸に、それぞれナフタレン環を導入した新規アミノ酸誘導体であるN-(2-(1-Naphthyl)acetyl)-L-cysteine(NAC) および α -N-(2-(1-Naphthyl)acetyl)-L-lysine(NAL)を用い(図 1)、これらと被験物質の反応性からタンパク質との結合性を評価する14, 15, 16)。
試験手順を次に示す。まず、96ウェルプレート上で NACまたは NALと被験物質をそれぞれ 1:50 のモル比で混合した反応液を調製し、24 時間 25℃で遮光状態にてインキュベートする。24 時間後、反応停止液であるトリフルオロ酢酸(TFA)水溶液を添加して反応を停止した後、HPLC にて被験物質と未反応のNAC、NAL の量を測定することで、被験物質の NAC、NAL に対する反応性を算出する(図 2)。DPRAもADRAと同様、ペプチドと被験物質を24 時間反応させた後、未反応のペプチドをHPLCで定量して、被験物質の反応性を算出する。
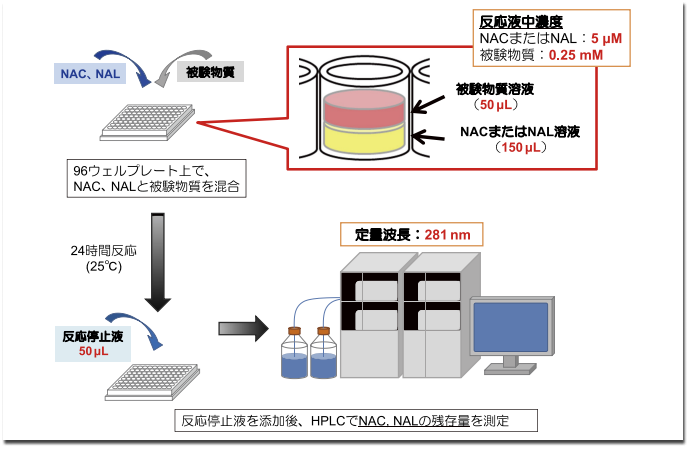
図2.ADRA の試験法の流れ
この ADRA や DPRA は培養細胞や生体由来成分を用いるin vitro 試験とは異なり、物質の化学反応のみを評価する試験法(in chemico 試験)であるため、in vitro 試験と比較して、簡便かつ再現性や定量精度の高い試験法であると言える。
しかし、基本的な原理や試験手順は同じであるものの、ペプチドの代わりにNACおよびNALを用いていることにより、ADRA は DPRAよりも多くの点で優れている(表 1)。
表1.ADRA と DPRA の比較表
| ADRA | DPRA | |||||
|---|---|---|---|---|---|---|
| 試薬 | 求核試薬 | 種類 | NAC | NAL | Cysteine peptide | Lysine peptide |
| 反応液中濃度 | 5 µM | 500 µM | ||||
| 酸化防止剤 | 0.2 µM EDTA | 不要 | なし | 不要 | ||
| 被験物質溶液 | 溶媒の種類 | ①水,②アセトニトリル,③アセトン,④DMSO/ アセトニトリル | ①アセトニトリル,②水,③アセトニトリル / 水,④イソプロパノール,⑤アセトン,⑥アセトン / アセトニトリル,⑦アセトニトリル /DMSO | |||
| 反応液中濃度 | 0.25 mM | 5 mM | 25 mM | |||
| 緩衝液 | 種類 | リン酸緩衝液 | リン酸緩衝液 | 酢酸アンモニウム緩衝液 | ||
| pH | 8.0 | 10.2 | 7.5 | 10.2 | ||
| 反応 | 反応容器 | 96 ウェルプレート | HPLC 用バイアル瓶 | |||
| 求核試薬必要量 | 約 0.3 µg/ウェル | 約 400 µg/バイアル | ||||
| 被験物質必要量 (分子量 200 として算出) |
0.01 mg/ウェル | 0.2 mg/バイアル | 1 mg/バイアル | |||
| 反応液総量 | 200 µL | 1000 µL | ||||
| 温度 | 25 ℃ | |||||
| 時間 | 24 時間 | |||||
| 反応 停止 |
反応停止液 | 溶液 | TFA溶液 | なし | ||
| 添加量 | 50 µL | |||||
| HPLC 測定 |
検出波長 | 281 nm | 220 nm | |||
| 分析時間 | 20 分間/試料 | 20 分間/試料 | ||||
EDTA:エチレンジアミン四酢酸
TFA 溶液:2.5%(v/v)トリフルオロ酢酸水溶液
DPRA では、反応液中の被験物質濃度が5~20 mMと高いため、しばしば被験物質の析出が見られることや、2 種のペプチドを220 nm の短波長で定量する必要があるため、被験物質由来のピークと重なり(共溶出)、正しく評価できないこと等の問題がある。
これに対し、NAC および NAL はナフタレン環を持つため、DPRAよりも約 60 nm 長波長である281 nm で定量することが可能である。そのため、被験物質由来のピークと共溶出することがほとんどない。その上、HPLC での検出感度が高く、反応液における被験物質の濃度は 0.2 mMとDPRA のおよそ 1/100 の濃度で試験ができるため、被験物質の析出がほとんどない。
このほかにもDPRA では、システイン含有ペプチドのチオール基が酸化されて二量体化することによる定量精度の低下が認められるが、筆者らはチオール基の酸化に金属イオンが関係していることを見出し、ADRA におけるNACの反応液に極微量の EDTA を添加することで NAC の安定性を向上させている18)。
また、DPRA におけるシステイン含有ペプチドの二量体は反応液中で析出するため、HPLC の測定に対する影響が懸念される上に、どれくらい二量体化されたかを定量することができない。これに対し、NAC の二量体は析出することなく、HPLC で定量することが可能であるため、万が一 NAC が酸化されても、試験系への影響を容易に判断することができる。
以上の点に加え、ADRA では反応停止液を添加することにより、HPLCの測定中における反応の進行を抑えられると考えらえるため、DPRAと比較してばらつきの少ない安定したデータの取得が可能であること、HPLC 用バイアル中で反応液調製を行うDPRAと異なり、ADRAでは96ウェルプレートとマルチチャンネルピペッターでの操作を基本にすることにより、スループット性にも優れていることなど、ADRA は高い試験精度のほか汎用性や操作性にも優れた試験法であると言える。
ADRA の感作性評価性能
動物実験代替法には、動物実験と同等の安全性評価ができることが求められる。ADRA においても、動物実験と同様に化学物質の皮膚感作性評価が可能か確認するため、DPRA の試験法確立に使用された 82 物質を用いて、LLNA に対する予測精度評価を実施している。その結果、ADRA の予測精度は 87%と非常に高い値であった 18)。
以上より、ADRA が非常に有用な試験法であることが確認できたため、2016年からOECD のテストガイドライン収載を目指した取り組みを行っている。2017 年には 4 施設の研究機関参加による試験の再現性と妥当性を評価するバリデーション試験を実施し、非常に高い施設内再現性と施設間再現性が得られている。現在、この結果に基づきテストガイドライン申請を行っている。
今後の展望
本稿では ADRA が DPRAよりも多くの点において優れていることを説明してきたが、培養細胞を使用しないため、他のin vitro 代替法試験と比較すると、特別な施設や設備および無菌操作などの技術が不要であること、試験期間が短く安価に実施できること、再現性が良いことなど、多くの利点が挙げられる。
EU における化粧品原料に対する動物実験禁止の背景から、動物実験代替法は化粧品業界におけるニーズが最も高いが、REACH 規則の改正など化粧品原料以外の一般化学物質における安全性評価にも動物実験代替法が取り入れられてきているため、今後、化粧品業界に限らず幅広い分野で利用されることを期待している。
キーワード
3Rs
「Replacement:動物を使用しない方法への置換」、「Reduction:使用動物数の削減」、「Refinement:実験に伴う動物に対する苦痛の削減」の 3 つから成る動物実験における原則。
参考文献
- EU 化粧品指令 (第7次改正) European Commission : "DIRECTIVE 2003/15/EC OF THE EUROPEAN PARLIAMENT AND OF THE COUNCIL of 27 February 2003,amending Council Directive 76/768/EEC on the approximation of the laws of the Member States relating to cosmetic products", Official J. European Union, L66/26 (2003).
- 環境省告示,「動物の愛護及び管理に関する施策を総合的に推進するための基本的な指針」,平成 25 年 8 月30日,第 80 号 (2013).
- OECD : "Short Time Exposure In Vitro Test Method for Identifying I) Chemicals Inducing Serious Eye Damage and II)Chemicals Not Requiring Classification for Eye Irritation or Serious Eye Damage", OECD Guideline for the Testing of Chemicals 491 (2018).
- OECD : "ANNEX Ⅰ : In Vitro Skin Sensitisation : Human Cell Line Activation Test (h-CLAT)", OECD Guideline for the Testing of Chemicals 442E (2018).
- OECD : "ANNEX Ⅲ : In Vitro Skin Sensitisation : IL-8 Luc assay", OECD Guideline for the Testing of Chemicals 442E (2018).
- OECD : "In Vitro Skin Irritation : Reconstructed Human Epidermis Test Method", OECD Guideline for the Testing of Chemicals 439 (2013).
- OECD : "Reconstructed human Cornea-like Epithelium (RhCE) test method for identifying chemicals not requiring classification and labelling for eye irritation or serious eye damage", OECD Guideline for the Testing of Chemicals 492 (2018).
- OECD : OECD Series on Testing and Assessment, 168, 1 (2014).
- OECD : "In Chemico Skin Sensitisation: Direct Peptide Reactivity Assay (DPRA)", OECD Guideline for the Testing of Chemicals 442C (2015).
- OECD : "Appendix IA : In Vitro Skin Sensitisation : The ARE-Nrf2 Luciferase KeratinoSens™ Test Method", OECD Guideline for the Testing of Chemicals 442D (2018).
- OECD : "Appendix IB : In Vitro Skin Sensitisation : The ARE-Nrf2 Luciferase LuSens Test Method", OECD Guideline for the Testing of Chemicals 442D (2018).
- OECD : "ANNEX Ⅱ : In Vitro Skin Sensitisation : U937 Cell Line Activation Test (U-SENS™)", OECD Guideline for the Testing of Chemicals 442E (2018).
- Roberts D. W. et al. : Chem. Res. Toxicol., 20, 1019 (2007). DOI: 10.1021/tx700024w
- Ahlfors, S. R. et al. : Skin Pharmacol. Appl. Skin Physiol., 16, 59 (2003). DOI: 10.1159/000068288
- Gerberick, G. F. et al. : Toxicol. Sci., 97, 417 (2007). DOI: 10.1093/toxsci/kfm064
- Fujita M. et al. : J. Pharmacol. Toxicol. Methods, 70, 94 (2014). DOI: 10.1016/j.vascn.2014.06.001
- Yamamoto Y. et al. : J. Appl. Toxicol., 35, 1348 (2015). DOI: 10.1002/jat.3139
- Fujita M. et al. : J. Appl. Toxicol., in press, (2018).




