【連載】アミノ酸分析~新たな潮流~ 「第 1 回 アミノ酸分析の歴史とニンヒドリンによるアミノ酸分析法」
本記事は、和光純薬時報 Vol.86 No.3(2018年7月号)において、株式会社日立ハイテクサイエンス 伊藤 正人 様に執筆いただいたものです。
「アミノ酸分析〜新たな潮流〜」シリーズ開始にあたって
味の素株式会社 イノベーション研究所 宮野 博
アミノ酸はタンパク質の構成成分であり、代謝物としても重要である。アミノ酸測定技術は、1941 年の分配クロマトグラフィーに始まるが、現在も進歩し続けており、高感度化、高速化、D- アミノ酸の高感度測定法の開発、正確な定量値を出すための環境整備等が進んでいる。アミノ酸分析技術の進歩は、生化学や栄養学始めさまざまな研究を発展させ、ひいては人々の豊かな暮らしに貢献していくものである。
本連載では、それぞれの技術を実際に牽引する先生に執筆をお願いし、アミノ酸分析の最新情報を提供する。
はじめに
アミノ酸は、生命の起源を思い描くにあたり最初にできた複雑な物質と考えられている。ただ不思議なことに私たちの体をつくるタンパク質は L- アミノ酸だけで構成されている。L- アミノ酸は光学異性体の一方であり、生命誕生の初期段階に地球内外のどこかで L-アミノ酸が D- アミノ酸より自発的に優勢になり、以降 L- アミノ酸が増殖したにちがいない。このようなミステリーを解明すべく例えば地球外から飛来する生命構成物質が探索されている。
なにはともあれ生命をつかさどる基本的なアミノ酸であるが、タンパク質構成アミノ酸は 20 成分あり、それらを分析するにはそれぞれ分子構造が類似しているためまず各成分を分離する必要がある。また大部分のアミノ酸分子には紫外線の吸収に特異性がないため、クロマトグラフィー分離法の検出手段として一般に用いられている紫外吸光光度法がそのままでは利用されてこなかった。
実際には後述するようないくつかの分離方法と誘導体化検出手段の組合せによる分析方法が考案されている。
アミノ酸分析法
第17改正日本薬局方には8つのアミノ酸分析法が参考情報として収載されているが1)、前述の通りアミノ酸分子をそのまま検出する方法はなく何れも誘導体化アミノ酸を検出するものである(表1)。アミノ酸はアミノ基とカルボキシル基(カルボキシ基)をもつ両性イオン(双性イオン)物質であり、水溶液中ではイオン化している。イオンのままでは分離分析でもっぱら使用されている逆相クロマトグラフィー(逆相HPLC)が適用しづらいため、カラムに導入する前に誘導体化するプレカラム誘導体化法がいくつか考案された。イオン交換クロマトグラフィーを利用すれば、イオン自体をそのまま分離することも可能だが、検出するためには分離後に誘導体化する必要がある。こちらはポストカラム誘導体化法と呼ばれる。
表 1 に示す誘導体化法には一長一短がある。ポストカラム検出法は、アミノ酸の各成分をそのままイオン交換クロマトグラフィーにより分離してから反応試薬を混合し誘導体化するため希釈やピーク拡散が生じるが、反応物が複数種類生成されても反応が途中であっても影響が少ない。このため定量性、再現性に優れている。一方、プレカラム誘導体化法は反応生成物が安定で 1 種類であれば、逆相 HPLC が利用できるため高速高感度化が図りやすい特徴がある 2)。また反応試薬の消費量は比較的少ないが、反応効率が試料マトリックスの影響を受ける可能性がある。試薬ブランクは、プレカラム法では検出されないか分離する必要がある。ポストカラム法では検出に影響の少ない試薬を選ばなければならない。ポストカラム法にはニンヒドリン法と OPA 法があり、前者は安定性が高く、後者は感度が高いと言える。
逆相クロマトグラフィーはイオン交換クロマトグラフィーよりも高速高分離化にむいていると言われており、その分離方法を応用するプレカラム法が局方に 6 つ収載されている。それぞれに特色があり、まず PITC 法は Edman 分解に伴う誘導体化法であり、プレカ ラム法の原点とも呼べる。AQC 法は蛍光検出法により高感度化が図られたが、システイン(Cys)の検出限界は他の成分に比べあまりよくない。
OPA プレカラム法は、高感度な蛍光検出法であるが、プロリン(Pro)など 2 級ア ミンを検出できない欠点を補うため方法 7 または 8 と組み合わせて利用されている。DABS-Cl 法は可視光の吸光光度法を応用し、PITC 法に比較して高選択性 ・ 高感度化がなされた。FMOC-Cl 法は 2 級アミンの高感度分析が可能であるがヒスチジン(His)誘導体が分解されやすく安定測定が難しいため、OPA プレカラム法と併用される場合がある。最後の NBD-F 法は 2 級アミンを含めて分析できるため実用的な高感度法として位置づけられている。
表1.日本薬局方におけるアミノ酸分析法の記載事項
| 方法 | アミノ酸分析法 | 分離方法 | 検出波長 | 検出限界 | 直線性・範囲 |
|---|---|---|---|---|---|
| 方法1 | ニンヒドリンによるポストカラム検出法 | イオン交換クロマトグラフィー | 吸光 1 : 570 nm 吸光 2 : 440 nm |
約10 pmol Proは約50 pmol |
20~500 pmol |
| 方法2 | OPAによるポストカラム蛍光検出法 | イオン交換クロマトグラフィー | 励起 348 nm 蛍光 450 nm |
数 10 pmol Proは特別処理で検出可能 |
数 pmol~数 10 nmol |
| 方法3 | PITCプレカラム誘導体化法 | 逆相HPLC | 吸光 245 nm | ほとんど1 pmol | 20~500 pmol |
| 方法4 | AQCプレカラム誘導体化法 | 逆相HPLC | 励起 250 nm 蛍光 395 nm |
成分により約 40~320 fmol Cysは約 800fmol |
2.5~200 µmol/L |
| 方法5 | OPAプレカラム誘導体化法 | 逆相HPLC | 励起 348 nm 蛍光 450 nm |
50 fmol、実質は1 pmol Proは検出できない |
- |
| 方法6 | DABS-Clプレカラム誘導体化法 | 逆相HPLC | 吸光 436 nm | 約1 pmol | 2~5 pmolが定量限界 |
| 方法7 | FMOC-Cl | 逆相HPLC | 励起 260 nm 蛍光 313 nm |
数 fmol His誘導体は分解していく |
0.1~50 µmol/L |
| 方法8 | NBD-F プレカラム誘導体化法 | 逆相HPLC | 励起 480 nm 蛍光 530 nm |
約10 fmol | - |
一口にアミノ酸と言っても、Pro、Cys、His などに対して各分析法にそれぞれの適用性があり、用途に応じて使いこなす必要がある。本稿では標準的な方法として永く利用されているニンヒドリンによるポストカラム検出法にフォーカスし、アミノ酸分析の歴史を振り返る。
ニンヒドリン法の歴史
歴史をさかのぼること 3)1948 年、Moore と Stein がアミノ酸分析のクロマトグラフィーで使用するためのニンヒドリン光度法を報告した。でん粉クロマトグラフィーを利用し、反応生成物質の吸光度スペクトルやアミノ酸各成分のニンヒドリン反応特性が検討された。

図1.KLA-2 形(1962)
1958 年に Spackman は両博士とともにアミノ酸のクロマトグラフィー利用のための自動記録クロマトグラフィー装置を発表した 4)。これがちょうど表1のニンヒドリンによるポストカラム検出法のさきがけとなった。
1962 年、日立製作所は同様の KLA-2形アミノ酸分析計 5)を完成した(図1)。国産初となった KLA-2 形は内径 9 mm、長さ 50 cm と 150 cm のガラス製カラムを 2 本搭載していた。当時はまだ充てん剤のイオン交換樹脂は破砕状であり、粒径は約 300 〜 1,000 µm もあった。短い方のカラムによりリジン(Lys)〜アルギニン(Arg)の塩基性アミノ酸を先に 4 時間で、長い方でアスパラギン酸(Asp)からフェニルアラニン(Phe)までの酸性・中性アミノ酸を 15 時間かけて分析した。試料添加などを含めるとおよそ 1日に 1 検体ペースの分析法であった。

図2.835 形(1977)
1977 年 4 月、ニュージーランド沖で日本のトロール船が謎の動物を捕獲し、ネス湖のネッシーのようなプレシオサウルスではないか、もしかしたら怪獣を発見したかもしれないとのニュースが報じられた 6)。甲板に付着したひげ状の前びれが日立製作所那珂工場に持ち込まれ、当時の最新鋭機によりアミノ酸組成分析が試みられた。特徴的なコラーゲンの組成を示したためサメ(フカ)のひれの棘条(きょくじょう)であることが判明し、怪獣の夢は発見から 3 か月後水泡に帰してしまった。
この時に使用された 835 形から 10 MPa 以上の高圧力をかけて分析する高速液体クロマトグラフィー(HPLC)としてのアミノ酸分析計の時代が始まった(図 2)。充てん剤は粒径 5 µm にまで微粒子化された球形の樹脂が採用された。内径 4 mm 長さ 150 mm のステンレス鋼カラムを用いて酸性から中性、塩基性アミノ酸まで 1 本のカラムで分析可能となった。タンパク質加水分解物のアミノ酸 18 成分を約 50 分間で分析できるところまで高速化された。
ニンヒドリン法の現在

図3.LA8080 AminoSAAYA®(2017)
2017 年、コンパクトな卓上型高速アミノ酸分析計 LA8080 が公表された 7)(図 3)。ニンヒドリン法の測定原理はMoore らの報告 4) と同じであるが、最新の流路図を用いて説明する(図 4)。溶離液として、タンパク質加水分解物であるアミノ酸約 20 成分の分析法にはクエン酸ナトリウム系の緩衝液が、生体液由来の約 40 成分にはクエン酸リチウム系の緩衝液が用いられている。溶離液はポンプ 1 により送液され、アンモニア除去用のフィルタカラムを経て、オートサンプラに至る。
ア スパラギン(AspNH2)やグルタミン(GluNH2)は酸化されやすく、それを抑えるためには冷蔵保存が有効である。カラムは、スルホン酸基が導入さ れた強酸性のイオン交換樹脂(粒径 3 µm)が充てんされ、ペルチエ方式のカラム恒温装置により温度コントロールされる。ポストカラム誘導体化のため分離カラムから溶出された各アミノ酸成分に対し、ポンプ 2 からのニンヒドリン反応液を合流・混合する。
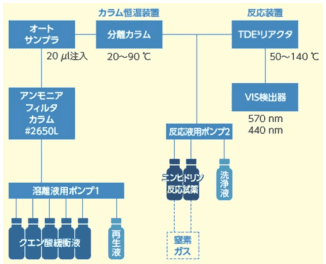
図4.ニンヒドリン法の流路図
反応装置はカートリッジタイプの TDE3(キューブ)リアクターを 135℃で恒温する。検出器は、アミノ酸の反応生成物である Ruhemann's purple の吸光度極大である可視光 570 nm で検出する 3)。一方、2 級アミンである Pro とハイドロキシプロリン(Hypro)からは Ruhemann's purple が生成されず、440 nm で検出する。この検出波長はMoore らの装置 4)とまったく同一である。
タンパク質の加水分解は一般に 6 mol/L 塩酸を用いて 110℃ 24 時間の条件下で行われる。Cys やメチオニン(Met)を正確に定量分析する場合、過ギ酸酸化してから塩酸を用いて加水分解する方法もある。またトリプトファン(Trp)を測定する場合にはアルカリで加水分解する方法もある。
ニンヒドリン法のアプリケーションとして、タンパク質加水分解物分析法のクロマトグラム(標準試料各成分 2 nmol注入、カラム温度 57℃一定)を図 5 に示す。イソロイシン(Ile)とロイシン(Leu)は分子構造が類似しており、クロマトグラフィーの分離は難しい。その分離度として 1.2 以上が得られた。さらに SN 比 2 で Asp の検出限界 2.5 pmol 以下、グリシン(Gly)とヒスチジン(His)のピーク面積再現性 RSD1.0%以下の結果であった。なお Cys は標準試料中ではジスルフィド結合をしたシスチンの状態で存在している。
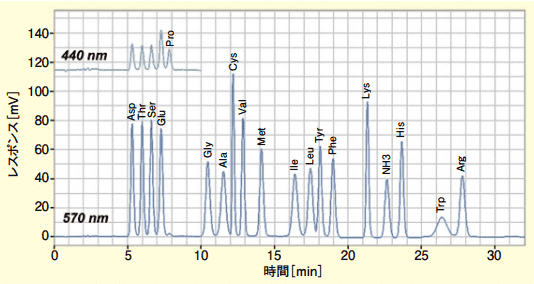
図5.タンパク質加水分解物分析法
もう一つのアプリケーションとして生体液分析法もある。その名の通り動物試料の血清や尿などを分析するわけだが、健康サプリメントおよびワインや醤油などの食品中のタウリン(Tau)、ギャバ(γ -ABA)、オルニチン(Orn)などアミノ酸類縁物質を含めて約 40 成分も分析できる。温度タイムプログラムを駆使する生体液分析法(標準試料各成分 2 nmol 注入)も良好なクロマトグラムが得られた(図 6)。
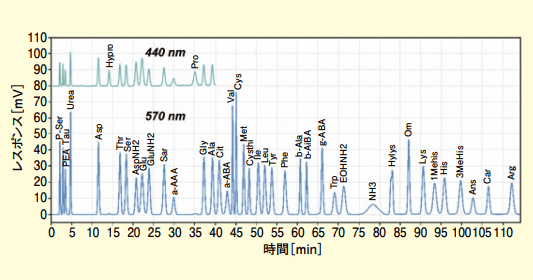
図6.生体液分析法
AspNH2 や GluNH2 が分離される以外に、例えばジペプチドのアンセリン(Ans)やカルノシン(Car)が検出されている。ハイドロキシリジン(Hylys)には立体異性体があり、カラムが良好な時はダブルピークになって見えることがある。また、シトルリン(Cit)とα- アミノ酪酸(α-ABA)、あるいは 1- メチルヒスチジン(1-Mehis)や 3- メチルヒスチジン(3-Mehis)も分離が難しい成分である。
最後に今なお Moore らのポストカラムニンヒドリン法が広く利用されている理由を述べたい。一つは分離方法にある。アミノ基に起因するカチオンを交換するクロマトグラフィーがベースであり 8)、基本的にはアミノ酸各成分の等電点の順番に保持時間が並ぶ。ただそれだけでは説明できない分離のメカニズムが存在する。それは充てん剤担体であるスチレンとジビニルベンゼンの共重合体が寄与する疎水性相互作用モードである。例えば、フェニルアラニンとチロシンなど芳香族アミノ酸の分離に効果があると考えられる。分析法開発者は溶離液組成や、ステップワイズ溶離の切り替えタイミング、カラム温度コントロールなどによりイオン交換と疎水性相互作用をたくみに操り、目的成分の分離を実現することができる。
今一つはニンヒドリンを用いるポストカラム誘導体化法に特長がある。こちらもアミノ基が鍵となり、Ruhemann's purple を生成する。ポストカラム法は試料中の夾雑成分を分離することができるため、夾雑物に妨害されづらい。このため食品や生物由来の実試料であっても除タンパクとフィルタリングだけ確実に前処理しておけば、一定のデータが得られる高い信頼性がある。Ruhemann's purple 生成の特異性が高く、かつ可視光域の吸光度を測定しているためクロマトグラムに夾雑ピークがほとんど出現しない。このような理由により高い定量再現性が得られ、さらに検出のダイナミックレンジも広く 4 桁以上の直線性が確保できる。加えてニンヒドリン試薬も冷暗所に保管しておけば劣化しづらく安定である。
おわりに
多くのアミノ酸分析法の中でも特にポストカラムニンヒドリン法は、分離法を検討すれば分析時間がかかっても一定の分離度が確保でき、最終的に高い定量精度が得られることが魅力になっていると言えよう。冒頭に述べた非対称性研究などのために D- アミノ酸を L- アミノ酸から分離する分析法については本連載に掲載されることを期待して筆を置きたい。
謝辞
味の素イノベーション研究所 基盤技術研究所の宮野博所長と小澤真一研究員、ならびに出口喜三郎 元北海道大学特任教授にご指導いただきましたこと心より感謝申し上げます。
参考文献
- 一般財団法人 医薬品医療機器レギュラトリーサイエンス財団編:「第十七改正日本薬局方」(じほう)(2016).
- 中村 洋監修:「ちょっと詳しい液クロのコツ前処理編」(丸善)(2006).
- 小澤真一、宮野博、伊藤正人:S. I. NEWS, 58, 4968(2015).
- Spackman, D. H. et al. : Anal. Chem., 30, 1190 (1958).
- 宇井信生、岩永貞昭、崎山文夫共編:「タンパク質・ペプチドの高速液体クロマトグラフィー」(化学同人)(1984).
- 伊藤正人:ぶんせき,2010,145 (2010).
- 伊藤正人、成松郁子、裴敏怜、森崎敦己、鈴木裕志、福田真人、八木隆、大月繁夫、関一也、豊崎耕作:S. I. NEWS, 61, 5360 (2018).
- 中村 洋監修:「ちょっと詳しい液クロのコツ分離編」(丸善)(2007).








