IVT-mRNAを用いた癌CAR-T細胞免疫療法の進展
TriLink BioTechnologesのブログメディア「Zone in with Zon」の”Advances in Cancer CAR T-Cell Immunotherapy Using IVT-mRNA”を許可を得て翻訳・編集した記事です。

CleanCap製品やmRNA受託合成はこちら
生体試料製品はこちら
T細胞は、発癌性腫瘍の排除などのヒトの免疫系による監視に不可欠な免疫細胞である。T細胞は、外来細胞や癌細胞を識別するために、T細胞受容体(TCR)を利用し、抗原提示細胞の表面にある抗原ペプチドを認識する。しかし、初期の悪性細胞は免疫システムを免れる術を持つ(Baumeister et al., 2016)。そのため、養子細胞移植(Adoptive cell transfer:ACT)免疫療法によってこの免疫回避を克服するために多くの研究開発が行われている(Cohen et al., 2017)。
ACTは、患者から採取したT細胞をラボで大量に増殖させ、その後患者に戻す。すでに患者の癌に対して抗原刺激されている患者由来のT細胞をin vitroで増殖させてから患者に戻すことで、免疫系が癌細胞を認識できるようになる。
ラボでは、癌細胞への特異性を向上させるために患者由来のT細胞を改変する。ACTが対象とする癌は様々であるが、小児白血病患者の治療に早期に成功したキメラ抗原受容体(CAR)T細胞療法への関心が高まっている。
当初の癌免疫療法用のCAR-T細胞改変には、プラスミドまたはウイルスベクターを用いた形質転換法が用いられた。現在は、IVT(in vitro transcription)によるmRNAの一過性発現によってより安全に行うことができる。今回、この新しいmRNAベースのアプローチを用いた癌免疫療法を示し、TriLink BioTechnologies社が提供する注目製品を紹介する。造血器腫瘍および固形癌の治療用のIVT mRNA CAR-T細胞の包括的なレビュー(Rajan et al., 2020)も報告されているのでそちらも参考にしていただきたい。
自家CAR-T細胞(Autologous CAR T Cells)
Hughes-Parryらがレビューしているように、当初のCAR-T細胞デザイン(図1)は3つの部分から構成されていた。
- 細胞外抗体由来抗原結合ドメイン(単鎖可変領域フラグメント、scFv)
- 膜貫通ドメインと連結されたスペーサー
- CD3ζシグナル伝達尾部から成る細胞内共刺激ドメイン
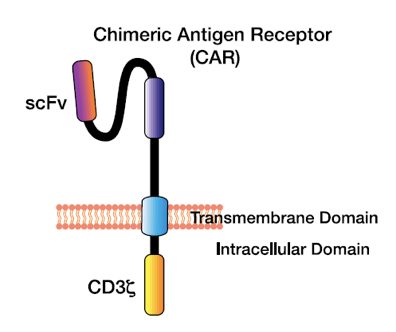
CARの単鎖可変領域フラグメント(scFv)は抗体可変領域の重鎖および軽鎖に由来し、CAR CD3 ζドメインはT細胞受容体の細胞内シグナル伝達ドメインに由来する。Hughes-Parry et al. (2020)より引用。
重要なことは、抗原結合により誘発されたCD3 ζを介するシグナル伝達により、細胞傷害性顆粒のエキソサイトーシスと抗原発現癌細胞のアポトーシスが促進されることである。
この最初の「第1世代」CARデザインに続いて、自家再注入用に癌患者由来T細胞を改変するため、より洗練した「次世代」CARデザインが開発された。この進展により、2017年に2つの薬剤がFDAに承認された。急性B細胞リンパ芽球性白血病に対するKymriahと、びまん性大細胞型B細胞リンパ腫に対するYescartaである。しかし、これらの自家細胞を用いた療法は、個々の患者に対してオーダーメイドで実施する必要があり、複雑かつ高価である。残念なことに、CAR-T細胞治療は患者の化学療法による前処置によって悪影響を受けることがある。場合によっては CAR-T細胞治療の効果がなくなることもある。
同種CAR-T細胞(Allogeneic CAR T Cells)
臍帯血幹細胞または健常ドナーのT細胞から、同種CAR-T細胞を産生する細胞を得られる。同種CAR-T細胞治療は、提供されたT細胞を改変・増殖し、CART-細胞をリンパ球除去化学療法を受けた他家の患者に投与するものである(Pampusch et al., 2019; Bechman and Maher, 2021)(図2)。 Eshharらは、初めて同種CAR-T細胞のことを「ユニバーサルCAR-T細胞」または「既製(off-the-shelf)CAR-T細胞」と呼んだ。彼らは、腫瘍特異的な同種CAR-T細胞を用いた概念実証試験を発表している(Marcus et al., 2011)。
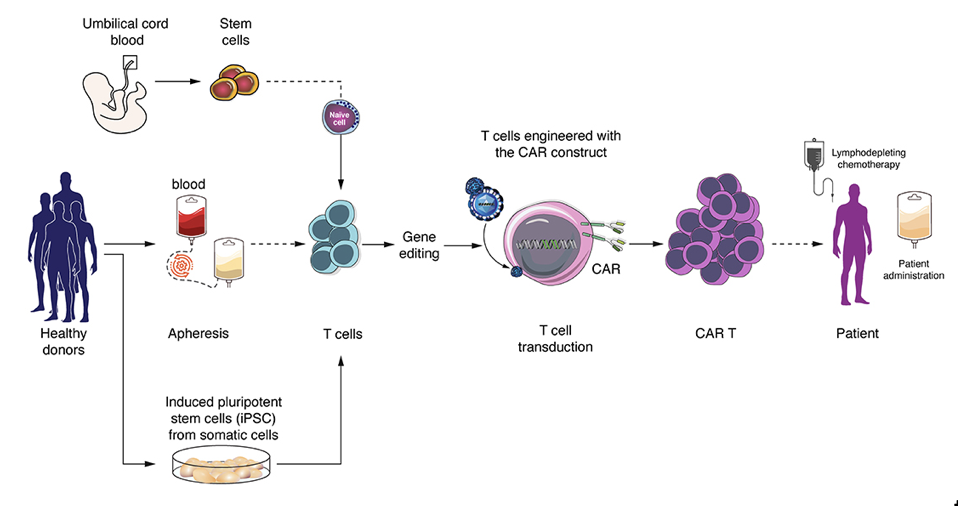
Bedoya et al. (2020)より引用。
腎細胞癌治療のための同種CAR-T細胞
米国癌協会は、2022年の米国の腎細胞癌(RCC, 別名は腎癌)の新規症例数は約79,000例、死亡数は約14,000例となると予測している。化学療法は進行した腎癌に対してほとんど効果がないため、免疫療法の研究開発の優先事項である。
最近、標的として注目されているのはCD70である。臨床試験も始まっている。 Panowskiら(2022)は、CD70は正常組織よりもRCCで発現量が高く、CAR-T細胞療法の標的となり得ると考えた。彼らは、抗CD70 scFvをベースとした一連のCAR-T細胞を作製し、その特性評価を行った。同種抗CD70 CAR-T細胞のTALENベースの遺伝子編集(図3)を用いて細胞を編集し、同種T細胞が移植片対宿主病(allogeneic T cell-induced graft-versus-host disease:GVHD)を誘発しないようにした。TriLinkのmRNAを用い、ラボでCAR-T細胞を編集した(図3)。
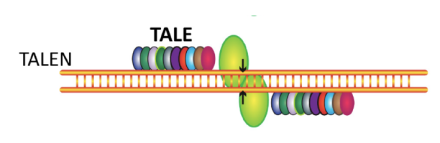
二本鎖を切断(矢印)するFokIエンドヌクレアーゼ(緑色)と結合した、DNA特異的結合のためのTALEタンパク質ドメインで構成され、遺伝子の破壊、修正、または挿入を行える。Rahimmanesh et al. (2022)より引用。
得られた同種抗CD70-CAR-T細胞を大規模に生産し、免疫治療薬の候補(ALLO-316)として、Allogene Therapeutics社が支援する第I相臨床試験が行われている。この試験は、リンパ球除去化学療法を受けた成人の進行性または転移性RCC患者を対象に、ALLO-316の安全性、有効性および細胞動態を検討する用量漸増試験(dose escalation study)である。この試験では患者を積極的に募集しており、2022年末までに主要な臨床評価項目の結果を得られる予定である。
T細胞悪性腫瘍治療のための同種CAR-T細胞
T細胞悪性腫瘍は、ヘテロな集団であり、様々な発生段階の機能不全T細胞に起因する。T細胞急性リンパ芽球性白血病(T-ALL)は小児および成人のALL症例のそれぞれ15%および25%を占めており、小児にみられるT細胞癌の中で最も一般的である(Fleischer et al., 2019)。
ほとんどのT-ALLは、膜貫通型糖タンパク質CD7を高度に発現しているが、Cooperら(2018)は、CAR-Tの作製に使用される正常T細胞の86%もまたCD7を発現していることを報告した。この共通したT細胞抗原の発現により、免疫学者がしばしば「フラトリサイド(兄弟殺し)」と呼ぶ、CAR-T細胞の自己殺傷が生じ、腫瘍活性を阻害する(図4)。
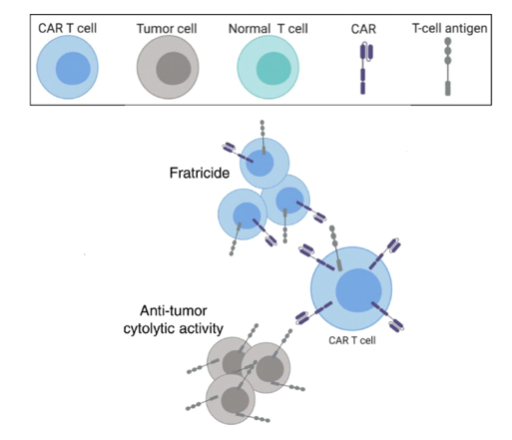
CAR-T細胞を患者に再注入すると、その同種抗原を認識して増殖・攻撃する。CAR-T細胞と腫瘍細胞どちらにも標的抗原が発現している場合、フラトリサイドと抗腫瘍活性が生じうる。Fleischer et al. (2019)から引用
フラトリサイドを防止しながら抗腫瘍活性を維持するため、Cooperらは、CRISPR-Cas9によって内因性CD7を除去してT細胞抗原結合を阻止しつつ、これらの同じT細胞にCD7を標的とするCARを導入すること考えた。その方法を簡潔に紹介する。まず、既知の抗CD7 scFv配列を遺伝子合成し、CD7-CAR-T細胞(CART7と呼ぶ)を作製した。次に、以下の遺伝子編集試薬を用いてエレクトロポレーション法でCART7中の内因性CD7およびTRACを除去した。
- Streptococcus pyogenes Cas9(spCas9)mRNA(5meC, Ψ)
- ヌクレアーゼ活性から保護するためにgRNAの5'末端と3'末端の3つの末端塩基に2'-O-メチルリボヌクレオシドおよびホスホロチオエート結合を組み込んだTRACとCD7のsgRNA
Cooperらは、CD7とTRACの2つを欠損させた細胞をユニバーサルCART7(UCART7)と呼んだ。In vitroアッセイで、患者3例の試料を用いてUCART7が初代T-ALL芽球を効率的に(95%)死滅させたことが示された。次に、マウスにおいて、患者由来の異種移植モデルを用いてUCART7の初代T-ALLに対する殺傷能力をin vivoで検討した。その結果、Kaplan-Meierカーブから、UCART7投与マウス群では生存期間の中央値が60日であったのに対し、非投与マウス群では30日間で死亡もしくは瀕死状態となったことが示された。UCART7誘導性の異種GVHDは認められなかった。
より最近では、Georgiadisら(2021)が、塩基編集を使用して同様な戦略を行い、フラトリサイド耐性CAR-T細胞を用いてT細胞悪性腫瘍を標的とした。この例では、抗原CD7およびCD3を共有するT-ALL細胞を、別々に作製したCD7CAR-T細胞およびCD3CAR-T細胞を併用して標的とした。これらのCAR-T細胞におけるCD7およびCD3の発現は、CRISPR誘導塩基編集(脱アミノ化して新しい終止コドンを作る、またはスプライスドナー/アクセプター部位を破壊する)によってブロックされた。彼らは、ラットAPOBEC1デアミナーゼと融合した不活化Cas9ニッカーゼと単一のウラシルグリコシラーゼ阻害薬から構成されるBE3(Komor et al., 2016)を使用した。これらはすべてTriLink BioTechnologies社のカスタム合成CleanCap® (Cap 1)mRNAにコードされて使用された。これらの塩基編集CAR-T細胞を共培養したところ、in vitroおよびin vivoヒト/マウスキメラモデルでCD3+/CD7 + T-ALL標的に対して最も高い細胞毒性を示した。
課題と期待
白血病におけるCAR-T細胞の成功に対し、固形腫瘍におけるCAR-T細胞の有効性にはまだまだ改善の余地がある(Marofi et al., 2021)。CAR-T細胞の主な課題は、腫瘍微小環境における認識、輸送、生存である。固形腫瘍は、腫瘍部位によって抗原発現レベルがまちまちであり、その上抗原が多様でCAR-T細胞の抗原認識を複雑にしている。T細胞は腫瘍組織を通り抜けて免疫抑制腫瘍微小環境に浸潤することができないため、血液癌と比較して、固形腫瘍におけるCAR-T細胞療法は限定される。
Marofiらは、それぞれの課題は新しいアプローチへのチャンスであると強調している。研究されている新たなテーマとしては、T細胞の認識を改善するための多重CAR、輸送を改善するための固形腫瘍への局所注入、腫瘍微小環境における生存を改善するための腫瘍微小環境調節因子の利用などがある。重要なことに、IVT-mRNAは複数の抗原受容体の産生を促進し、さまざまな表面抗原を有するヘテロな癌細胞の認識を改善できる可能性がある。また、IVT-mRNAは、ヘパリナーゼなどの腫瘍微小環境調節因子の一過性発現にも使用でき、それによってCAR-T細胞の腫瘍浸潤および抗腫瘍活性を促進できる(Rafiq et al., 2020)。
CleanCap製品やmRNA受託合成はこちら
生体試料製品はこちら
mRNAに関する他の記事はこちら




