エクソソームの基礎研究から前臨床への発展
TriLink BioTechnologesのブログメディア「Zone in with Zon」の"Exosomes Advance from Biological Curiosities to Preclinical Applications"を許可を得て翻訳・編集した記事です。
CleanCap製品やmRNA受託合成はこちら
- mRNAワクチン/医薬品 研究・製造・QC用製品カタログ
- TriLink社 CleanCap® Reagent
- TriLink社 CleanCap® mRNA
- TriLink社 修飾ヌクレオシド三リン酸
- TriLink社 mRNA受託合成サービス(in vitro転写合成)
エクソソームは、細胞から分泌される約100 nmの脂質二重層粒子であり、細胞に由来する細胞表面タンパク質、DNA、RNAなどのそのさまざまな生体分子を含んでいる。エクソソームは哺乳類の赤血球の成熟に関する研究で最初に発見され、1987年にJohnstoneらが初めてそれを「エクソソーム」と名付けた。それ以来、特に過去10年間、「エクソソーム」の用語で索引が付けられたPubMedの年間発表文献数は指数関数的に増加している(図1)。
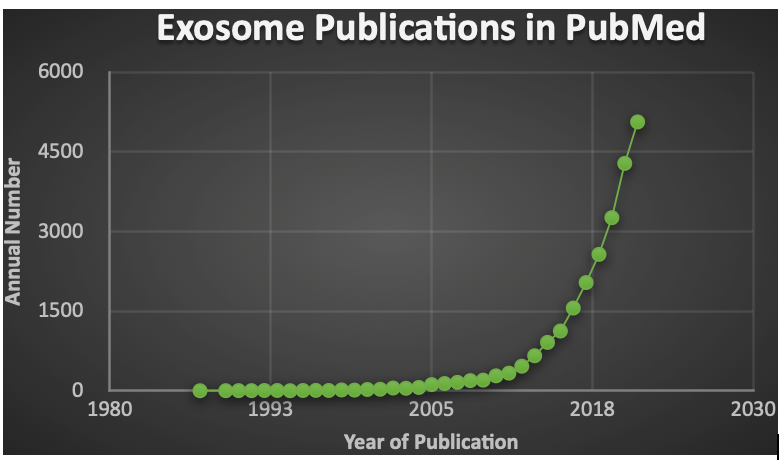
2021年までの全分野を対象に「exosomes」で検索した結果を示している。
最近、Science誌でKalluriとLeBleu(2020)がエクソソームに関するレビューを発表し、細胞外分泌物の非常に複雑な機能について議論している。エクソソームの大きさ、内包物、およびレシピエント細胞に対する機能は不均一であり、エクソソームの起源となる細胞の種類、ゲノムの状態、細胞の培養条件によって分泌されるエクソソームの性質は異なる。細胞間のエクソソームの輸送は、細胞間情報伝達のひとつとして高い関心を持たれている。
エクソソームのドラッグデリバリーへの利用も大きく注目されている(Kalluri and LeBleu, 2020)。PubMedには現在、エクソソームを用いたmRNAのデリバリーに関する5つの報告がある。そのうちの1つは、この新たな使用法に関する前向きレビュー(Aslan et al., 2021)である。本記事では、今後の治療への応用に向けた、エクソソーム媒介性mRNAデリバリーに関する最近の2報、「家族性高コレステロール血症治療のためのエクソソームに基づくmRNA療法」および「SARS-CoV-2免疫性を誘導するためのエクソソーム媒介性mRNAデリバリー」を簡単に紹介する。これらの報告はともに、mRNAデリバリーにおけるエクソソームの臨床有用性を示唆している。
家族性高コレステロール血症の治療
家族性高コレステロール血症( Familial Hypercholesterolemia: FH)は、常染色体優性遺伝疾患であり、血漿中の低比重リポタンパク質コレステロール(LDL-C)の上昇と早発性冠動脈心疾患が特徴である(Li et al., 2021)。FHのほぼ全症例のLDL受容体(LDLR)遺伝子に機能喪失変異が認められる。LDLRは、肝細胞表面の重要なリポタンパク質受容体として、肝臓によるLDL-Cクリアランスに重要である。生体内にLDLRと同じ機能を持つタンパク質はない。
FHに対する現在の治療方法は、複数の薬物治療や生活習慣の改善などである。しかし、それらはFH患者の重篤な合併症を予防するうえで十分ではない。特に若年期に診断された患者に対する新しい根治的治療が期待される。
2020年に、ホモ接合性 FH の患者を対象とした組換えLDLR発現アデノ随伴ウイルス(AAV)の小規模第1/2相臨床試験が完了した。しかし、AAV療法の発癌性に対する長年の懸念と、COVID-19のmRNAワクチンの劇的な成功により、Liらは、FHに対する安全かつ効果的と考えられる治療法として、LDLRタンパク質をコードするmRNAのエクソソームデリバリーを検討することを決断した。その研究の中で試みられたアプローチは以下である。
mRNAを多く含むエクソソーム中に、目的の分子が非常に多量に存在することが、エクソソームを用いた遺伝子治療には必須である。したがってLiらは、in vitroで発現を促進するために強力なプロモーターと制御因子を持つLdlr発現DNAプラスミドベクターを構築した。このプラスミドベクターを、「パッケージング」マウス肝細胞株(転写されたLdlr mRNAをエクソソームにリクルートする働きをする)に遺伝子導入し、エクソソームを分離して(図2)、機能的なLdlr mRNAを多く含む「真正エクソソーム」(ExoLdlr)とした。最後にLiらは、in vitroで、ExoLdlr が効率的に送達され、レシピエント細胞内でLDLRタンパク質に翻訳されることを示した。
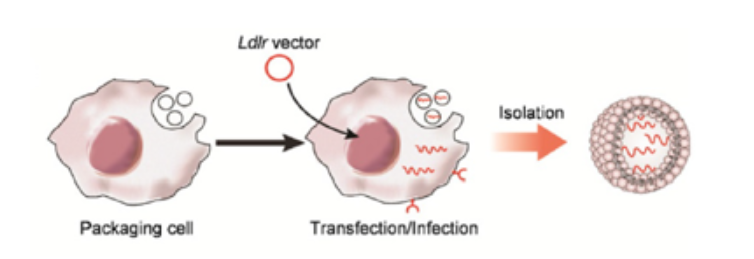
エクソソーム(空の丸)パッケージング細胞に、Ldlrを発現するプラスミド(赤丸)をトランスフェクト/感染させ、LDLR受容体タンパク質をコードするmRNA(赤い波線)を内包するエクソソームを産生させた。LDLR受容体タンパク質をトランスフェクトした細胞表面上に示す(赤いU字型)。Li et al.(2021)より引用。
次に、in vivoで、ExoLdlr治療により機能的LDLRタンパク質の発現が回復したことが示された。簡単に説明すると、Ldlr-/-ノックアウトマウスに高脂肪食を8週間与えてLDL-C値を上昇させ、その後ExoLdlrを3日間毎日注射した。そして、肝臓におけるmRNAおよびタンパク質レベルでのLdlrの発現を、投与3日後に調べた(図3)。
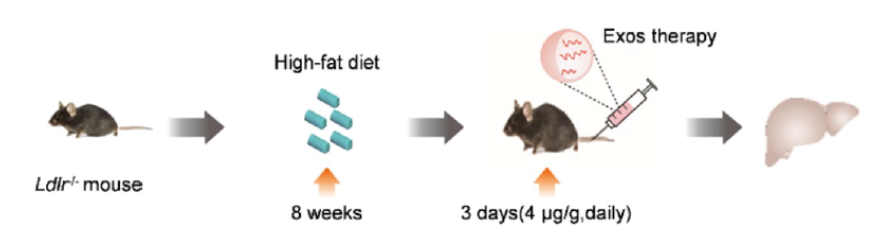
機能的LDLRタンパク質を測定するため、Ldlr-/-マウスに高脂肪食を8週間与え、その後、図2に従って作製したエクソソームを注射した。肝臓におけるmRNAおよびタンパク質レベルでのLdlrの発現を投与3日後に調べた。Li et al.(2021)より引用。
最後にLiらは、事前に太らせたLdlr-/- マウスを用いて、脂肪肝およびアテローム性動脈硬化の他の疾患モデルにおけるExoLdlr注射の効果を検討した。同様な実験デザインを用いたところ、肝切片および病変の通常染色、血清生化学検査、並びに線維形成および炎症遺伝子の発現などのさまざまな指標に基づき、ExoLdlr注射によりこれらの疾患の症状が改善されたことが示された。
本研究ではFH症状を有するマウスにおいて、エクソソームを利用したmRNA送達の肯定的なデータが示されたが、Liらは、この方法を臨床に進める際には、以下のように複数の問題に対処する必要があると指摘した。
- 標的外のエクソソーム送達を減少させる
- 治療に必要なExoLdlr の量を減らす、
- Ldlr mRNAの安定性を改善する、
- 無細胞系でmRNAをエクソソームに封じ込める、
- エクソソーム分離の収率と純度を改善する。
SARS-CoV-2の免疫性
ジョンズホプキンス大学のStephen Gouldは、エクソソームおよびその他の小胞の専門家である。その専門知識とCOVID-19ワクチン開発の重要性から、GouldらはSARS-CoV-2の免疫反応を誘導するためのin vivoでのエクソソーム媒介性mRNA送達について研究することとなった(Tsai et al., 2021)。
この報告は大きく2つの部分に分けられる。
(i)マウスにおいて送達と発現を定量するための、Antares2と名付けた発光レポーターmRNA(Yeh et al., 2017)の調製とエクソソームへの内包
(ii)SARS-CoV-2のスパイク(S)タンパク質抗原およびヌクレオカプシド(N)タンパク質抗原のmRNAを含むエクソソームを投与したマウスを用いたワクチンの評価
Gouldらは、S抗原がワクチン有効性に重要であることを示す広いエビデンスがあることから、Sタンパク質をコードするmRNAと、Nタンパク質をコードするmRNAを使用した。
図4に模式的に示したように、293F細胞から「精製エクソソーム」を得るために長い多段階のワークフローを使用した。細胞をchemically defined培地で培養し、遠心分離、ろ過、サイズ排除クロマトグラフィーを連続的に多数行い、最後に100kDaろ過を行う。
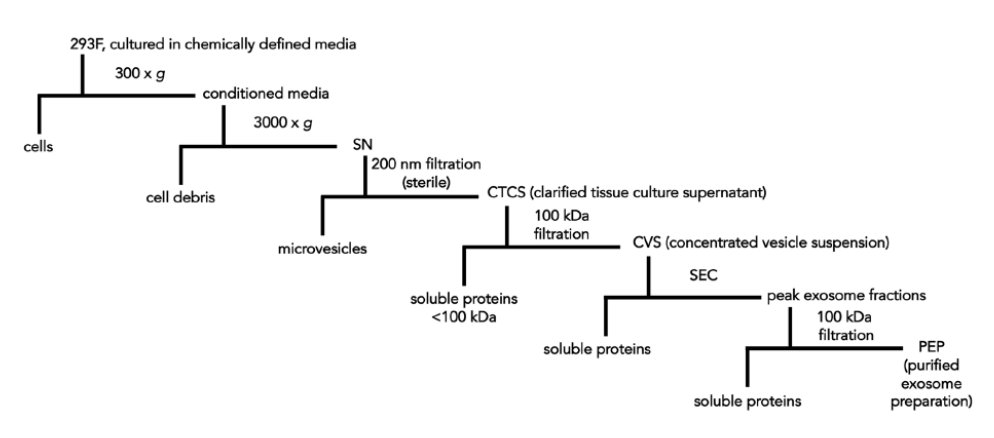
Tsai et al.(2021)より引用。
Antares2、S抗原、またN抗原をコードする3種類のmRNAを、カスタムmRNA合成により合成し、TriLink BioTechnologies社のCleanCap®技術でmRNAをキャッピングした。次に、各mRNAをカチオン性脂質溶液と共にプレインキュベートし、脂質で被覆したmRNAを作製した。この脂質被覆mRNAを mixing-induced partitionによりエクソソームに内包させた。
Gouldらは、Antares2 mRNAを含有するエクソソームを用いて安全性を確立し、持続的に発現を確認した。8週間にわたり注射を6回行った2週間後に、マウスの全身イメージングによりin vivoでAntares2の発現を測定した。Antares2の発現は依然として検出可能であり、mRNAを内包したエクソソームを反復投与すれば、最終投与の数週間後でも、目的タンパク質を持続的に発現することが示された。
コントロールとしての空のエクソソーム、またはS抗原とN抗原を両方含むエクソソーム(ExoS+Nと呼ぶ)を、13週齢の雄マウスの脚筋に、大量または少量のmRNAとともに1、21、42日目に筋注した。84日目まで定期的に血液を採取し、84日目に血液学的および組織学的分析を行った。ExoS+N ワクチン接種動物では、SARS-CoV-2のS抗原とN抗原の両方に対して用量依存的な抗体反応が認められた。これらの抗体反応性は比較的一定で長期間持続し、3ヵ月試験の終了時まで残存していた。
ExoS+N ワクチン接種動物および対照動物の脾細胞における抗原反応性CD4+およびCD8+ T細胞の存在を84日目に解析した。組換えSおよびNタンパク質の存在下または非存在下での増殖アッセイにより、対象とするT細胞の割合が有意に増加した。これらのExoS+N ワクチン特異的抗原誘発性増殖反応から、ワクチンが、SおよびNタンパク質に対する細胞性免疫を刺激することが示された。そして重要なことにin vivoで有害作用は認められなかった。
この試験の結果、「これはmRNAを内包するエクソソームの最初の前臨床試験であり、このプラットフォームが複数の機能的mRNAを問題なくえりバリーできることを実証した。ワクチンおよび治療薬として使用するためにmRNA内包エクソソームの開発を進めること」が結論づけられた。
まとめ
Tsaiらの論文を作成したGouldのチームには、Capricor Therapeutics社の研究者が含まれていた。同社は疾患の治療と予防のためのエクソソームをベースとした治療法を開発中である。同社のウェブサイトによれば、COVID-19のワクチン候補としてエクソソームプラットフォームを開発中とのことである。同社のwebcastでも本プログラムおよびTsai et al., 2021の状況に関する詳細情報が提供されている。
CleanCap製品やmRNA受託合成はこちら
- mRNAワクチン/医薬品 研究・製造・QC用製品カタログ
- TriLink社 CleanCap® Reagent
- TriLink社 CleanCap® mRNA
- TriLink社 修飾ヌクレオシド三リン酸
- TriLink社 mRNA受託合成サービス(in vitro転写合成)
エクソソーム/細胞外小胞研究の製品や受託サービスはこちら




