mRNAワクチン・医薬品の研究開発と製造
本記事はTriLink BioTechnologies提供の記事を当社にて和訳したものです。
mRNAワクチンの研究開発
mRNA(メッセンジャーRNA)をベースとしたワクチンは、新たなワクチンであり、生ワクチンやサブユニットワクチンの代替として期待されています。mRNAワクチンは、抗原をコードするmRNAを体内で発現させます。抗原は細胞内で発現されるため、mRNAワクチンはサブユニットワクチンとは異なるMHCクラス応答を誘導します。
従来のワクチンと比べ、mRNAワクチンは、比較的安価かつ短期間で大量生産が可能です。そのため、パンデミックやバイオテロなど、広範囲で緊急性の高い感染症が発生した場合に非常に有効です。
mRNAワクチンの有用性は感染症に限ったものではなく、がん治療のためのmRNAワクチンの研究も進められています。がんを対象としたmRNAワクチンには大きく2種類あります。1つ目は、特定のがんに共通する抗原を発現させるもので、不特定多数のがん患者への利用が期待されます。2つ目は、個別のがん患者に合わせたがん抗原を発現させるものです。
後者の個別化がんワクチンでは、ある患者の腫瘍の遺伝子配列を決定し、腫瘍内に存在するが体細胞組織には存在しないネオアンチゲンを同定します。このようにして作られたネオアンチゲンを発現するmRNAは、患者のがん抗原情報を元にしているため、高い効果が期待されます。
さらに、アルファウイルスから得られた自己複製RNAをベースとしたワクチンの研究開発も生まれています。自己複製RNAは、細胞内に導入されるとウイルスポリメラーゼを発現し、RNA複製を開始します。自己複製RNAはカプシドタンパク質(capsid proteins)を持たないため、感染性のウイルスを産生することはありません。自己複製RNAは二本鎖の状態を経て複製されるため、二本鎖RNAを認識する受容体を活性化し、免疫反応を誘導します。複製RNAは、細胞内で自己複製するため、少ない投与量で効果を得られます。
mRNAの特徴
ヒトの体内では何千種ものタンパク質が産生され、それらには様々な機能があります。例えば、触媒作用、細胞構造の支持、シグナル伝達などが挙げられます。これらのタンパク質を合成するための情報は、DNAに保存されています。しかし、タンパク質をDNAから直接合成することはできません。核内にあるDNAの情報をタンパク質の合成が行われる細胞質へ伝達するmRNAが必要です。
mRNAは、目的のタンパク質を合成するために必要となる遺伝情報のコピーです。mRNA内のコドンと呼ばれる三塩基対構造により、最終的なタンパク質を構成するアミノ酸が指定されます。
mRNAは、ヌクレオシド三りん酸がつながった鎖状構造をしており、さらにポリアデニル化された末端(ポリA末端)と5'キャップが付加されています。
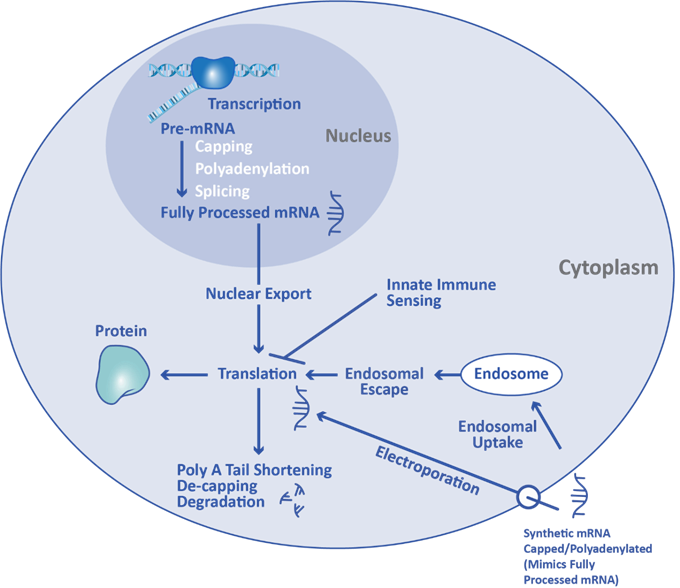
まず、核内のDNAテンプレートからRNAポリメラーゼによってmRNA前駆体(precursor mRNA)が生成されます。次に、mRNA前駆体は、核内においてキャッピング、ポリアデニル化およびスプライシングを受けて成熟したmRNAになります。そして、成熟mRNAは、核内から細胞質内に輸送され、リボソームと結合します。リボソームでは、mRNAによって指定された順番にアミノ酸が結合し、目的タンパク質を合成します。最終的に、mRNAは、ポリA末端がエキソヌクレアーゼによって切断され、デキャッピングされて分解されます。
mRNAからタンパク質への翻訳の流れを概説しましたが、mRNAワクチンやmRNA医薬品もこの翻訳機構を利用しています。in vitroの転写によって産生された人工mRNAは、脂質ナノ粒子(lipid nanoparticles)やエレクトロポレーションを用いて細胞内へ導入されます。細胞質内に入った人工mRNAはリボソームを結合し、その情報を基にタンパク質が産生されます。
しかし、人工mRNAがin vivoで効率的に翻訳されるには、自然免疫系による認識を回避しなければなりません。特定の外来分子のみを認識する獲得免疫系とは異なり、自然免疫系は"病原体間の共通パターン"と"細胞が損傷を受けた際に放出される内因性分子"を認識して機能します。前者は病原体関連分子パターン(pathogen-associated molecular pattern; PAMP)、後者は傷害関連分子パターン(damage-associated molecular pattern; DAMP)と呼ばれます。どちらもパターン認識受容体(pattern recognition receptor; PRR)と結合することで下流の免疫応答を誘発します。
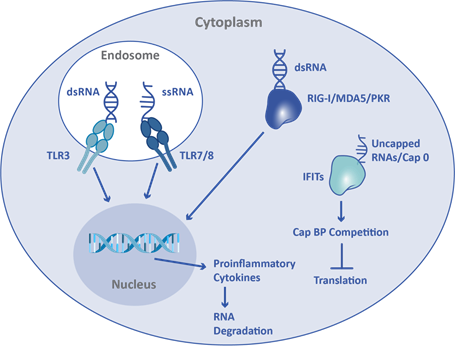
mRNAなど1本鎖RNAがエンドソーム内に存在すると、Toll様受容体(toll like receptor; TLR)7および8によってDAMPとして認識されます。2本鎖RNAの場合は、エンドソーム内および細胞質内において、TLR3およびレチノイン酸誘導遺伝子-I(RIG-I)/メラノーマ分化関連タンパク質5(MDA5)/プロテインキナーゼR(PKR)によって認識されます。さらに、インターフェロン誘導テトラトリコペプチド反復(IFIT)タンパク質は、異常なmRNAのキャップ構造を認識します。
自然免疫系が活性化すると、炎症反応、mRNAの翻訳の抑制およびmRNAの分解を引き起こします。投与したmRNAの自然免疫系による認識を回避するためには、mRNAの配列を改変・化学的に修飾し、キャップ構造を付加します。
配列に関して、ウリジンが多い配列は自然免疫応答を惹起するため、最終的なmRNAの配列からなるべくウリジンを除去します。この際、同じアミノ酸をコードする同義コドンを利用します。配列にウリジンを含むコドンをウリジンを含まない同義コドンへ置き換えることで、同じタンパク質を産生させながらもmRNAの免疫原性を抑えられます。
また、改変ヌクレオシド三りん酸(NTP)への置換も効果的です。例えば、シュードウリジン三りん酸、N1-メチルシュードウリジン三りん酸、および5-メトキシウリジン三りん酸は、自然免疫による検出を回避するために、ウリジン三りん酸と置き換えることができます。
キャップ構造に関して、高等な真核生物で産生される成熟mRNAは、自然免疫応答に対する防御としてキャップ1と呼ばれる5'キャップ構造があり、これによりin vivoでの翻訳効率が高められています。
キャップ1は、7-メチルグアノシン(m7G)がmRNAの1番目のヌクレオチドに結合する構造を持ち、1番目のヌクレオチドの2'リボースがメチル化されます。キャップ0は、キャップ1と同様に7-メチルグアノシン(m7G)を持ちますが、1番目のヌクレオチドはメチル化されていません。
IFIT(Interferon-induced protein with tetratricopeptide repeats)は、RNAのキャップ構造の違いを認識して自然免疫応答を誘起します。キャップ1構造を持つRNAは、キャップ0構造のRNAよりもIFITとの結合親和性が低く、さらにMDA5(melanoma differentiation-associated 5)によるmRNAの認識を回避することが報告されています。
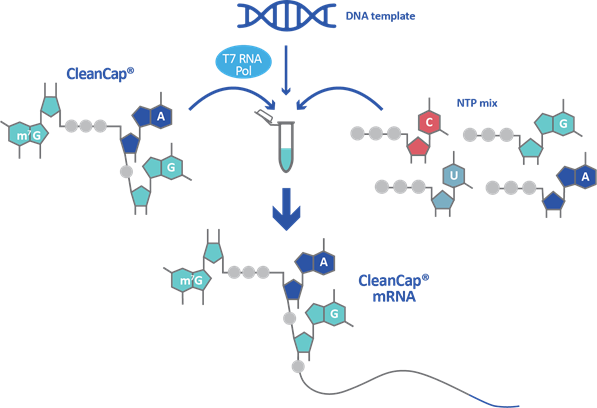
in vitroで転写したmRNAはキャップ構造がないため、製造工程においてキャップ構造を付加します。キャッピング方法には、共転写キャッピング法と呼ばれるCleanCap®およびアンチリバースキャップアナログ(ARCA; Anti-Reverse Cap Analog)があります。どちらも転写反応時にキャップアナログを添加することでキャッピング済みmRNAを合成します。
CleanCap®は、RNAにキャップ1構造を付加するのに対し、ARCAはキャップ0構造を付加します。免疫原性が低く、かつ翻訳効率の高いmRNAを得るには、キャップ1構造を付加する方が適切です。
mRNAの利点と治療への応用
mRNAは、治療用タンパク質の代替、遺伝子編集、細胞療法、ワクチンなど多くの用途があります。ほとんど全てのタンパク質はmRNAに代替でき、細胞内で抗原を発現させることが可能です。
mRNAを用いる利点として、mRNAの配列改変や改変ヌクレオシド三りん酸(NTPs)などによる化学的修飾によって、mRNAの特性を制御できる点が挙げられます。また、研究開発の期間が比較的短く、さらにスケーラブルな製造が可能である点も優れています。
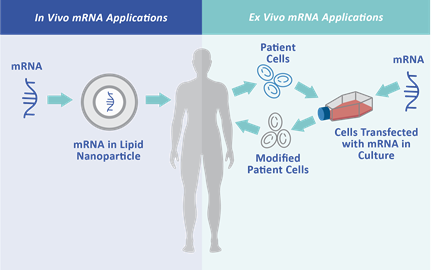
現在のmRNA治療薬は、in vivoで患者の体内へ直接mRNAを導入するか、ex vivoでmRNAを導入した細胞を体内に注入するかの方法で用いられます。mRNAを体内に直接導入する場合は、mRNAを脂質ナノ粒子(Lipid Nanoparticle; LNP)など送達用の媒体に封入し、宿主細胞まで輸送します。臓器選択的な送達方法も研究されています。
mRNAの製造方法
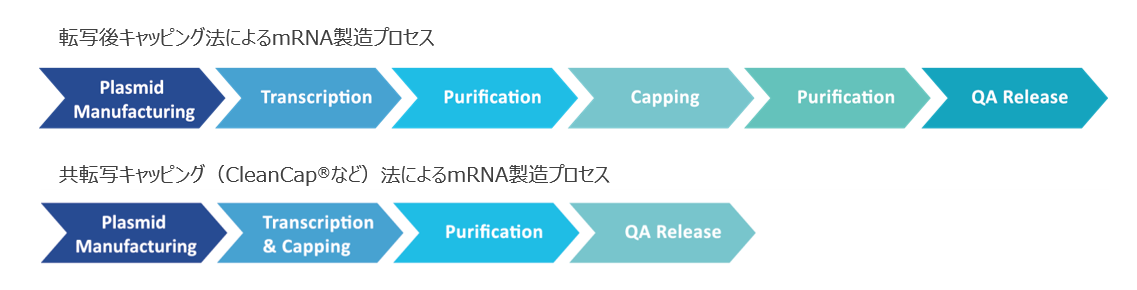
mRNAの製造の流れは、採用するキャッピング方法によって異なります。転写後キャッピング法では、転写後にRNAを精製し、その後キャッピングをして再び精製します。一方、CleanCap®など共転写キャッピングでは、転写とキャッピングをひとつの工程で行います。これにより、精製回数を減らすことができ、製造プロセスの効率化が可能です。
mRNAの配列最適化および化学的修飾
mRNA配列を最適化することで、mRNAワクチン/治療薬のin vivoでの安定性および翻訳効率を向上させることができます。同義コドンと修飾NTPは、いずれも配列からウリジンを除去する方法として用いられ、これによってmRNAの免疫原性が低減され、翻訳が促進されます。
TriLink社は、mRNAのための修飾NTPとして、シュードウリジン三りん酸、N1-メチルシュードウリジン三りん酸、5-メトキシウリジン三りん酸など幅広い製品を取り揃えています。
プラスミド製造
多くのmRNAワクチン/治療薬は、直鎖化したプラスミドDNAをテンプレートとした転写により製造されます。プラスミドを含む大腸菌をバイオリアクター内で増殖させ、プラスミドを精製・回収します。
TriLink社では、mRNAワクチン/治療薬のために最適化したプラスミド製造を受託サービスとして提供しています。
mRNA製造
in vitroでの転写は、mRNAを合成するための安定した方法です。mRNAの製造は、in vivoのプロセスと同じように、直鎖DNAをテンプレートとしてT7 RNAポリメラーゼによって行われます。ポリA末端は、DNAテンプレートであらかじめ設計しておくか、酵素を用いて転写後のmRNAに付加されます。改変ヌクレオシド三りん酸を用いる場合、それらを転写反応時に添加することで、置換された配列を持つmRNAを得られます。
TriLink社は、mRNAのCDMOとしての何十年にも渡る経験があります。
mRNAのキャッピング
5'キャップ構造は、免疫系による認識を回避し、翻訳を促進するためには必須です。in vivoで合成されたmRNAには自然にキャップ構造が付加されますが、in vitroで作製した人工mRNAにおいては、製造過程でキャップ構造を付加しなければなりません。
キャップを付加する方法には、in vitroの転写段階で付加する共転写キャッピング法と転写後キャッピング法があります。共転写キャッピング法を採用することで、製造プロセスの総ステップ数を減らすことができます。キャッピング酵素を用いる方法もありますが、共転写キャッピング法よりも製造プロセスが複雑になります。
アンチリバースキャップアナログ(ARCA)法など従来の共転写キャッピング法では、自然には存在しない非天然型のキャップ0構造が付加されるのに対し、TriLink社のCleanCap®キャッピング技術では、天然型のキャップ1構造が形成されます。複数のCleanCap®が販売されており、mRNAの開始配列に合わせてAG、AU、GGから選択できます。
本記事はTriLink BioTechnologiesから提供を受けた以下の記事を当社にて和訳したものです(2021年9月)。
- Vaccine Development
https://www.trilinkbiotech.com/application/vaccine-development - mRNA Basics
https://www.trilinkbiotech.com/mrna-basics - Applications for mRNA
https://www.trilinkbiotech.com/applications-for-mrna - mRNA Manufacturing
https://www.trilinkbiotech.com/mrna-manufacturing




