ヒトiPSC由来腸管上皮細胞 F-hiSIEC アプリケーションのご紹介②
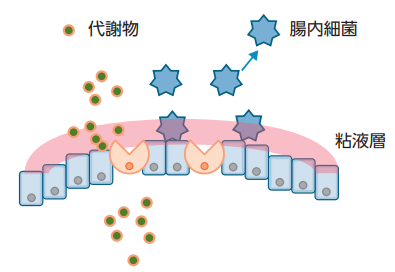
1. 腸内細菌と生体小腸が相互作用する経路
小腸には体中の免疫細胞の約 7 割が集まっており、生体の免疫システムを制御する、重要な器官です。 同時に腸内細菌が存在することで腸管免疫に重要な役割を果たしています。腸管免疫が作用する経路は2通りあります。
経路① 腸内細菌が直接上皮細胞に接触する
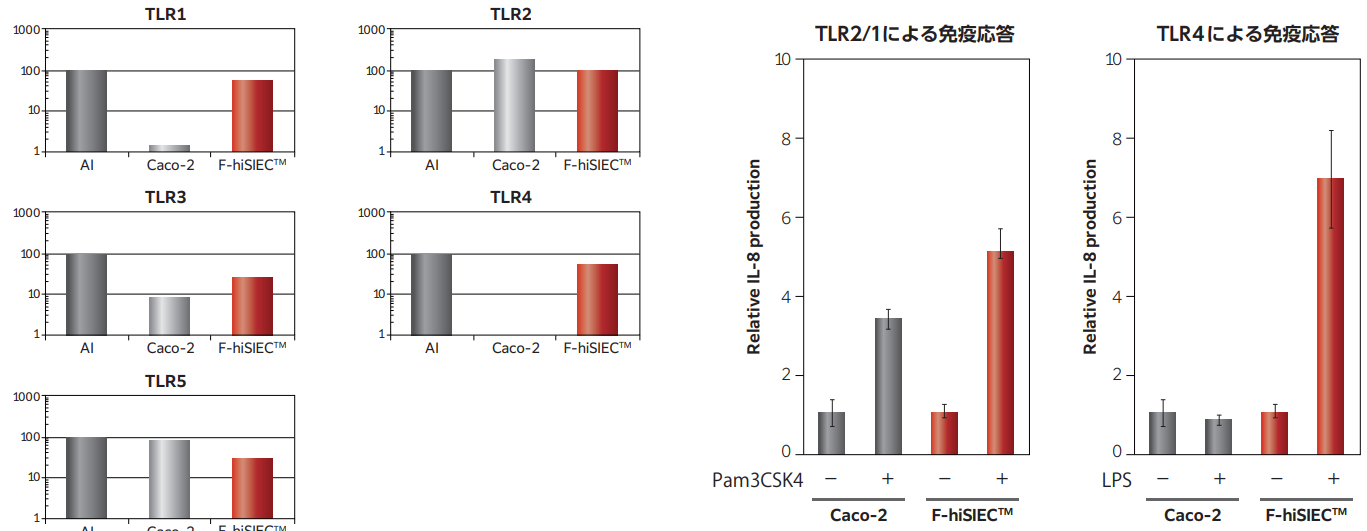
腸内細菌の存在はToll-like receptor(TLRr)によって認識され、免疫応答することで細菌を排除します。ヒト小腸上皮の主要なTLRrについて、F-hiSIECは生体小腸同等の遺伝子発現を示しています。またTLR2/1、TLR4 を介した免疫応答を評価可能です。
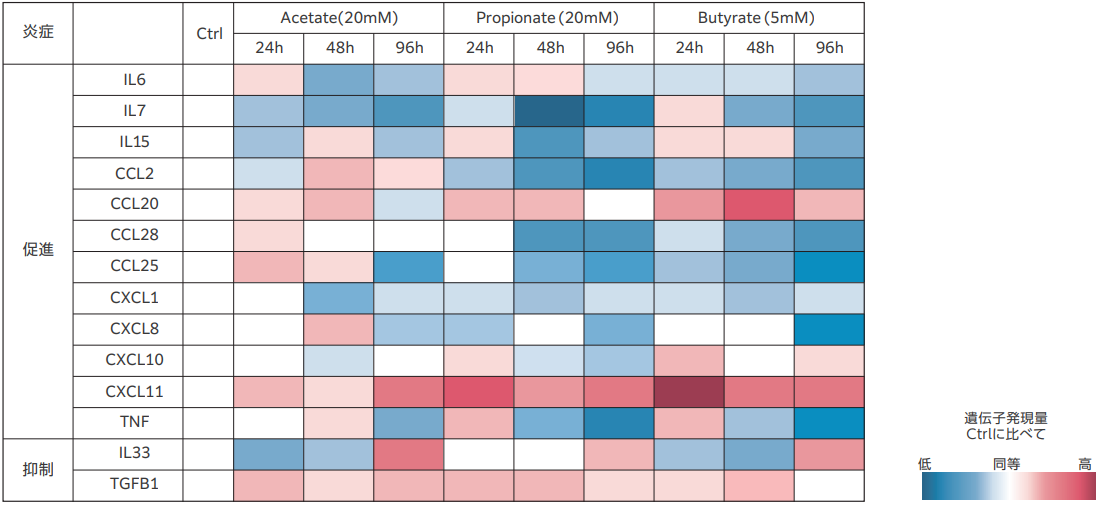
経路② 腸内細菌が産生する代謝物(短鎖脂肪酸)が上皮細胞に作用する
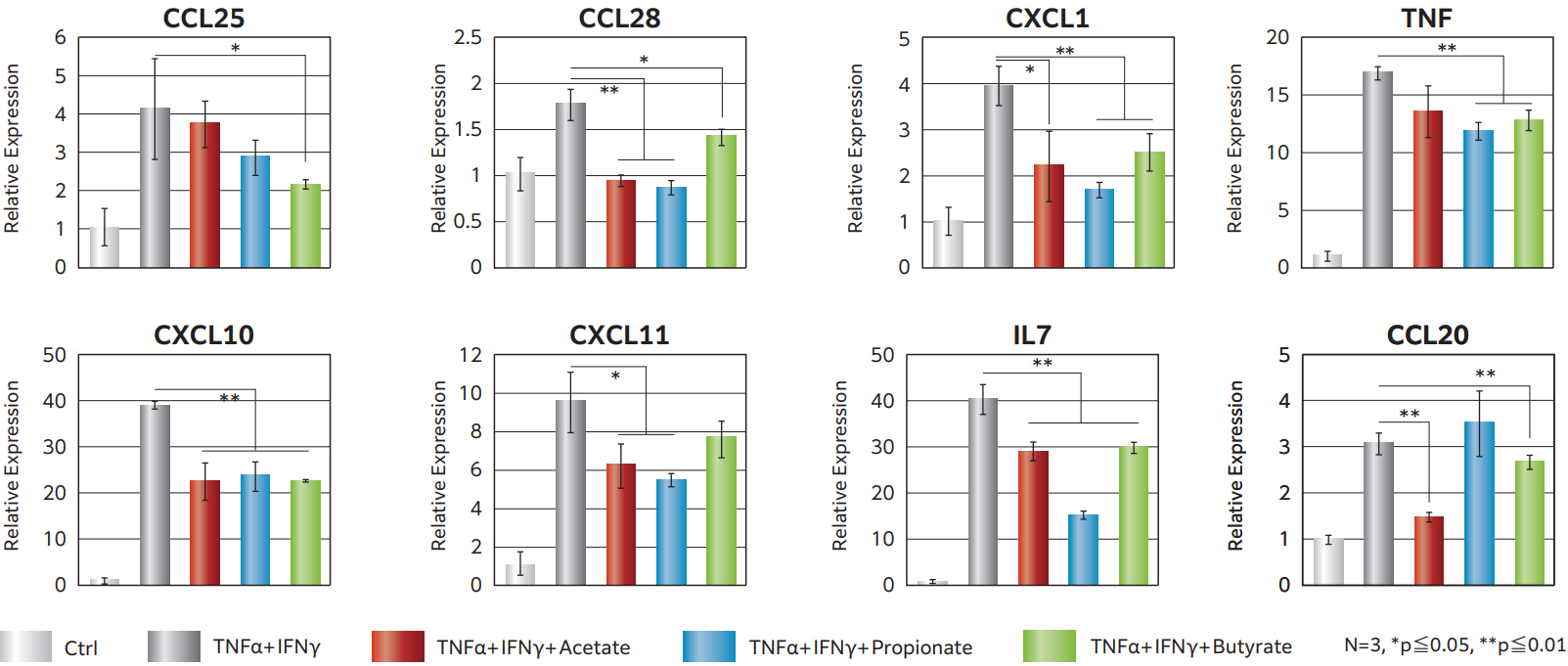
腸内細菌が産生する代表的な短鎖脂肪酸(Acetate, Propionate, Butyrate) をF-hiSIECに添加し、経時でのサイトカイン・ケモカイン14 遺伝子の発現を qPCRにて測定しました。短鎖脂肪酸を添加すると、経時的に炎症促進系の遺伝子発現が低下し、抑制系の発現が上昇しました。これは、生体小腸とおよそ同等の働きを示すもので、食品成分の働きをF-hiSIECで評価できる可能性を示しています。
2. 消化管炎症モデル
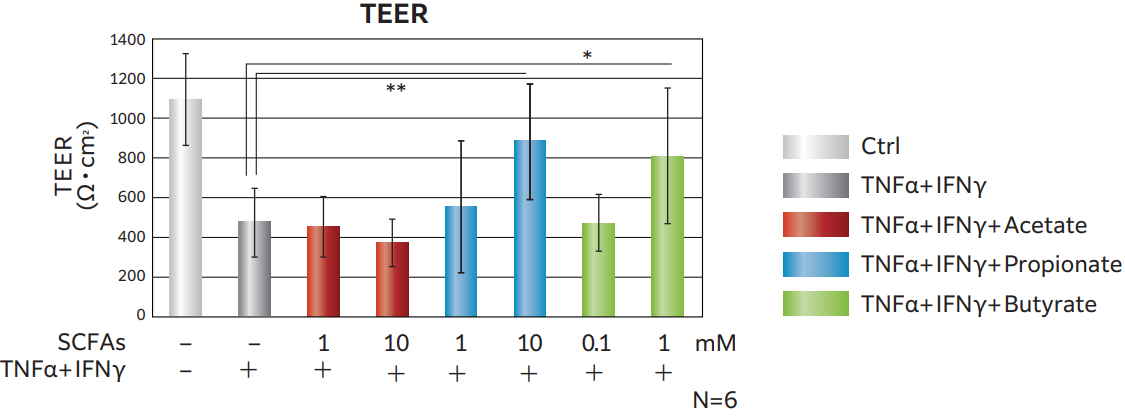
以下より、セルカルチャーインサート上にF-hiSIECを播種し、Basal側にTNFα+IFNγ(炎症性サイトカインの一種)を添加することにより、TEERが低下してバリアが破壊され、炎症性腸疾患の病態を再現できる可能性を示唆しています。
下図はBasal側にTNFα+IFNγ、Apical側に 短鎖脂肪酸を添加した場合の、バリア機能(TEER)を示しています。 TNFα+IFNγ添加により TEER は低下しましたが(グレー色)、同時にプロピオン酸(青色)や酪酸(緑色)を添加するとTEER低下が抑制されました。
TNFα+IFNγ添加により炎症性サイトカインの遺伝子発現が上昇しますが、同時に代表的な腸内細菌代謝物である短鎖脂肪酸(Acetate, Propionate, Butyrate)を添加すると遺伝子発現の上昇が抑制されました。 以上から、短鎖脂肪酸は腸の炎症を抑えてバリア機能を保護する働きがあることを、F-hiSIECで評価できる可能性が示唆されました。
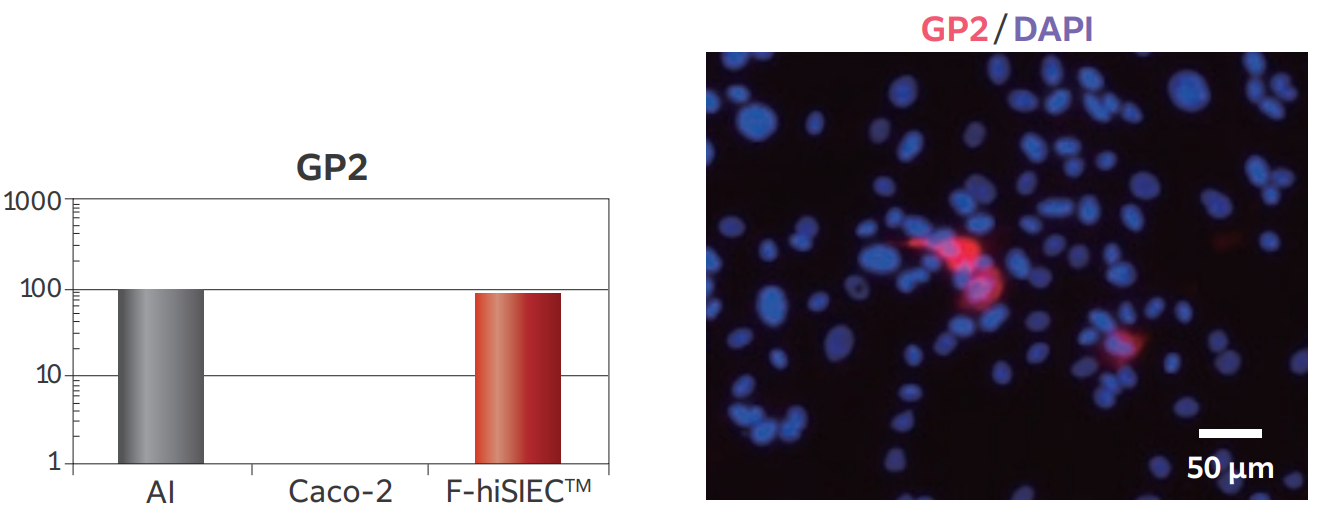
3. M細胞による蛍光粒子の透過能評価
F-hiSIECにおいて、抗原取り込み能を持つM細胞のマーカー(GP2)の発現が生体小腸並みであり、免疫染色でもその存在が確認されました。
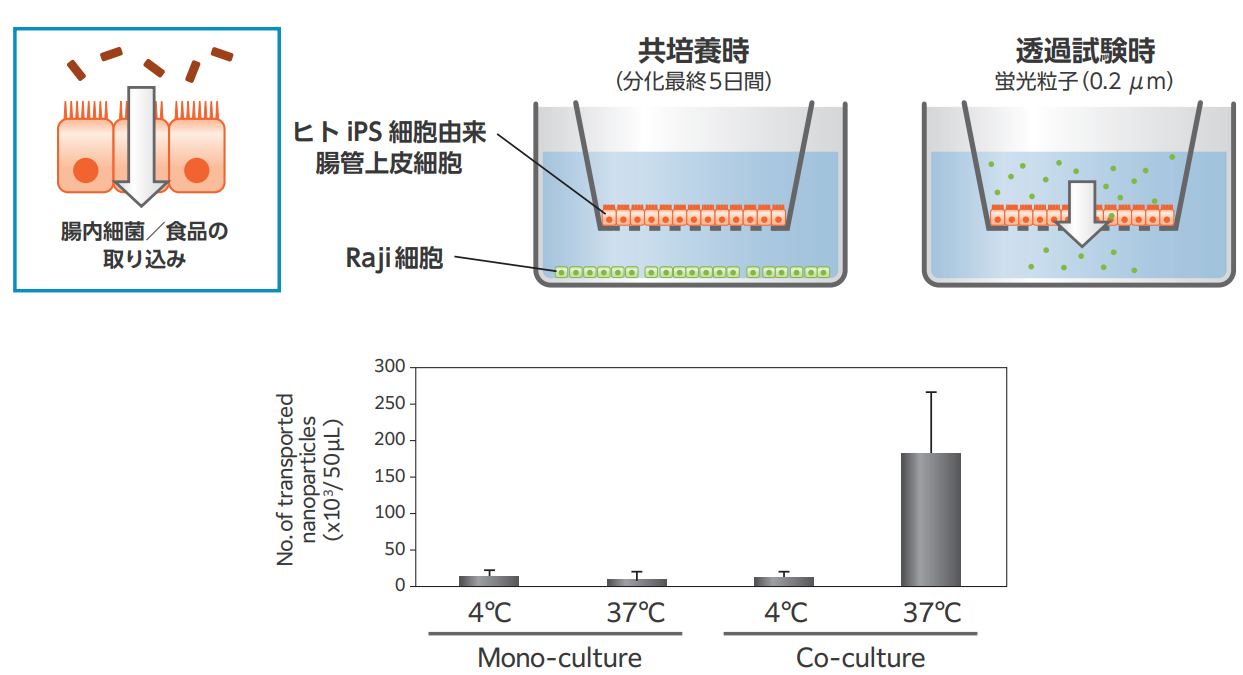
そこで、F-hiSIECを用いて粒子の取り込み能を検討したところ、F-hiSIEC単独培養(Mono-culture)の場合、分子の大きい粒子の透過は見られませんが、F-hiSIECとRaji細胞との共培養(Co-culture)、かつ37°Cの条件下で、粒子の透過が認められました。 4°Cは透過阻害条件、37°Cは透過促進条件を示します。
本データに関して、ご質問のある方はこちらのフォームにてお問い合わせください。
薬物動態評価や毒性評価のアプリケーションは、こちらにて紹介しております。
参考: 第58回日本消化器免疫学会総会ポスター発表、第94回日本細菌学会総会