mRNAワクチン - ワクチン研究の新時代
TriLink BioTechnologesのブログメディア「Zone in with Zon」の”mRNA Vaccines – A New Era in Vaccinology”を許可を得て翻訳・編集した記事です。
CleanCapの製品・サービスはこちら
- mRNAワクチン/医薬品 研究・製造・QC用製品カタログ
- TriLink社 CleanCap® Reagent
- TriLink社 CleanCap® mRNA
- TriLink社 修飾ヌクレオシド三リン酸
- TriLink社 mRNA受託合成サービス(in vitro転写合成)
mRNAワクチン - ワクチン研究の新時代
- 配列の最適化、修飾塩基、デリバリーが鍵となる
- ClinicalTrials.govには現在、mRNAワクチンの臨床試験114件が登録されている
- mRNAワクチンの臨床試験の内訳は、COVID-19のワクチンが37件、種々のがんに対するワクチンが63件である。
はじめに
mRNAワクチンは、2020年にCOVID-19(新型コロナウイルス感染症)のワクチンとして一般の人々に認知されるようになったが、実際にはそれ以前から研究は行われていた。mRNAワクチンに関する最初の論文は、1993年にMartinonらにより報告され、NIHのPubMedデータベースにおいて「mRNAワクチン」という語で索引付けされた。しかし、下図のグラフが示すように、その後しばらくmRNAワクチンの研究論文の報告はなかった。具体的にいうと、次に報告されたのは2004年(Pascolo et al., Cannon and Weissman)であり、その後2010年に1報(Weiss et al.)が報告されたのみであった。2015年頃までは年に数報の論文が発表され、その後年間報告数が顕著に増加した。
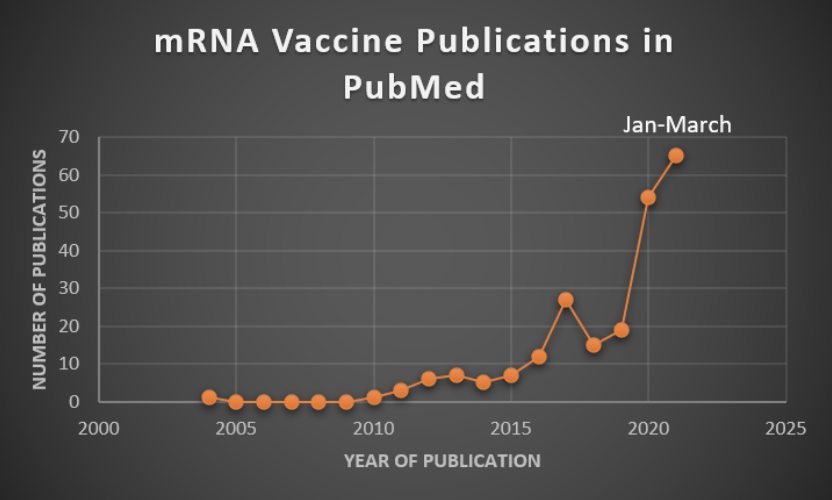
初期の論文には、mRNAワクチンの研究開発に前向きでユニークな考察があり、mRNA研究の歴史を理解するのに有用である。
例えば以下の論文がある。
- mRNA: delivering an antitumor message?(2011, Lint et al.)
- Messenger RNA-based vaccines: progress, challenges, applications(2013, Kramps and Probst)
- Nucleic acid vaccines: prospects for non-viral delivery of mRNA vaccines(2014, Deering et al.)
当初は、in vitroで転写されたmRNAの"免疫原性、不安定性、デリバリーの難しさ"から、実用化に懐疑的な見解が多かった。しかし現在、mRNAワクチンは科学によってもたらされた新しい「希望」と言える。「ゲームチェンジャー」または「パラダイムシフト」とも呼べるだろう。
今回の記事のタイトルは、従来のワクチン学から新たなワクチン学への変化を簡潔に示した、Drew Weissmanらグループによる2018年のレビュー(Pardi et al.)のタイトルを引用したものである。
本記事の内容は、zoneから抜粋した一部の概要であるため、関心のある方は原著文献を参照して全体像を把握していただきたい。
mRNAをワクチンに用いる合理性
弱毒化および不活化した病原体、サブユニットワクチンなど従来のワクチンも、様々な疾患に対して有効である。しかし、Pardiらは「様々な感染症の病原体、特に免疫応答を回避する能力が高い病原体に対するワクチン開発には、依然として大きな壁がある」と述べている。加えて、「in vitroで転写された(IVT)mRNAの使用は、従来の不活化ウイルスおよび弱毒生ウイルス、サブユニット、DNAワクチンに比べて複数のメリットがある」と説明した。
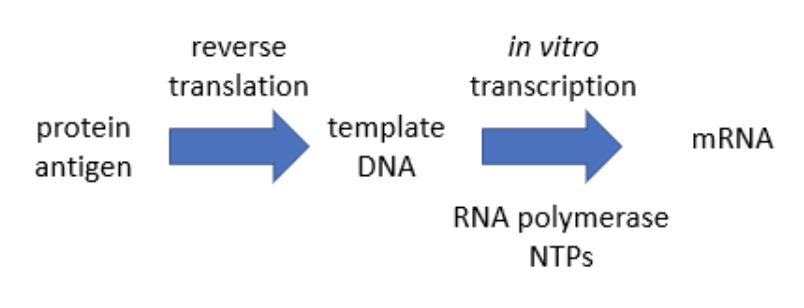
5'キャッピングは示していない。Jerry Zon作成
Pardiらによれば、第1の利点は安全性である。mRNAは非感染性であり、かつゲノムにも組み込まれない。さらに、mRNAは体内で自然に分解され、in vivoでの半減期は様々な修飾やデリバリー方法によって調節できる。安全性をさらに高めるために、mRNAそのものの免疫原性を抑制することも可能である。

第2の利点は有効性である。様々な修飾によってmRNAの安定性と翻訳効率を高めることができる。in vivoでは、mRNAをキャリア分子に封入しすることで、効率的にmRNAがデリバリーされ、細胞質への迅速な取込みと発現が可能になる。また、mRNAは最小の遺伝子ベクターであるため、ベクターに対する免疫反応は回避され、mRNAワクチンは繰り返し投与が可能である。
第3の利点は製造のしやすさである。mRNAワクチンは、収率が高く、迅速、安価、かつスケーラブルに製造できる。
mRNAワクチンの研究
Xuらによる2020年のmRNAワクチンのレビューによれば、in vitro転写合成で作られたmRNAは、自己アジュバント性(self-adjuvant properties)がある。これはウイルスによって作られるmRNAと同様の性質を持つ可能性がある。
mRNAは、抗原提示細胞(antigen-presenting cells)によって認識され、抗原提示細胞はTLR3、TLR7、TLR8などのパターン認識受容体(pattern recognition receptors)を活性化する(下図参照)。二本鎖RNA(dsRNA)は、細胞質においてレチノイン酸誘導遺伝子I(RIG-I)様受容体(RLRs)と結合する。RLRにはRIG-Iやメラノーマ分化関連遺伝子5(MDA5)などがある。RIG-IとMDA5はいずれも、APCの成熟、炎症性サイトカインおよびI型インターフェロン(IFN)のの分泌を促進する。そして最終的に、強力で抗原特異的な液性免疫応答と細胞性免疫応答が生じる。
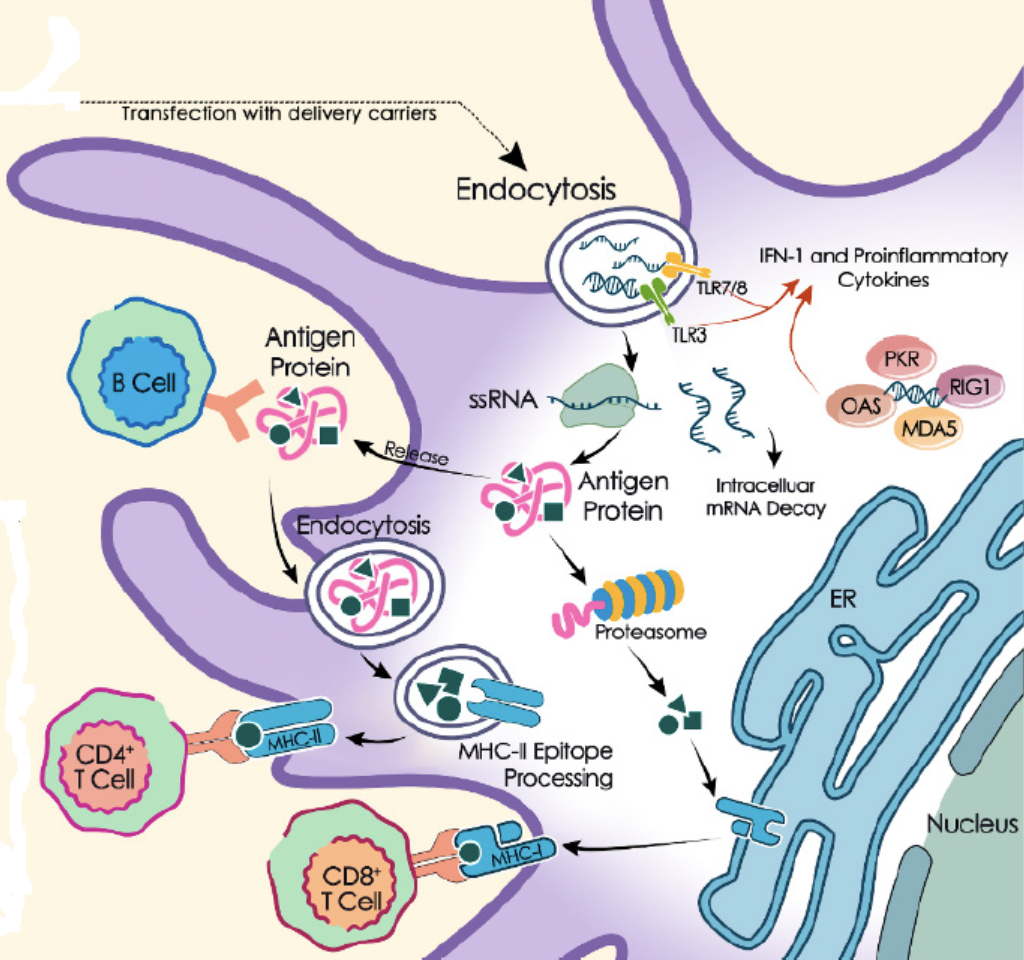
エンドサイトーシスにより、mRNAは細胞質に入る。一部のmRNAは宿主細胞のリボソームと結合し、タンパク質に翻訳される。抗原タンパク質は、細胞質でプロテアソームによって抗原ペプチドに分解され、主要組織適合遺伝子複合体(MHC)I経路を介して細胞傷害性Tリンパ球(CTL)に提示されることもある。あるいは、宿主細胞から放出され、樹状細胞に取り込まれる。その後分解され、MHC-II経路を介してヘルパーT細胞とB細胞に提示される。B細胞は放出された抗原タンパク質を認識することもある。Xuらより転載。
ペプチドまたはタンパク質抗原で構成されるサブユニットワクチンは、通常、PRRを活性化することができないため、適応免疫応答を誘起および補助するためのアジュバントの添加が必要になる。
対照的に、mRNAそのものの強力な適応免疫応答と自己アジュバント性は、mRNAワクチンに大きな利点をもたらしうる。Xuらは、IVT mRNAの一本鎖RNA(ssRNA)領域はTLR7およびTLR8の認識を介して樹状細胞(DC)の抗ウイルス活性化を誘導する可能性があると述べている。また、dsRNA領域/その他夾雑物はTLR3の認識を介して免疫活性化を誘導する可能性もあることも報告している。
mRNAワクチン技術の最近の進歩
配列の最適化
近年、Pardiらによれば、様々なmRNAワクチンプラットフォームが開発され、免疫原性および有効性が検証されている。「RNA配列の操作により、合成mRNAはかつてないほど翻訳効率が上がった」と彼らは述べている。
McCafferyらは、このRNA配列の操作について、TriLinkのCleanCap® Reagent AG (3' OMe)(Cap1)を使った共転写およびウリジン(U)除去戦略という内容で報告した。これらの戦略には、コドン選択とUTPの種々の化学修飾NTP(modNTP)による置換が含まれる。modNTPは現在TriLinkからカタログ製品として入手できる。この独自のCleanCap®技術は、mRNAワクチン開発のパイオニアであるスティーブ・パスコロ教授のレビューにおいて「革命的」と評されている。
CleanCap®とTriLinkのmodNTPライブラリを併用した例として、CleanCap®(Cap1)とウリジン除去/5moU置換が注目されている(下図に示す)。これらは、Jiangらによるアデニン塩基編集(ABE)の論文において利用された。この論文は2020年4月にオンラインで公開されて以来、すでに6,000回以上ダウンロードされている。
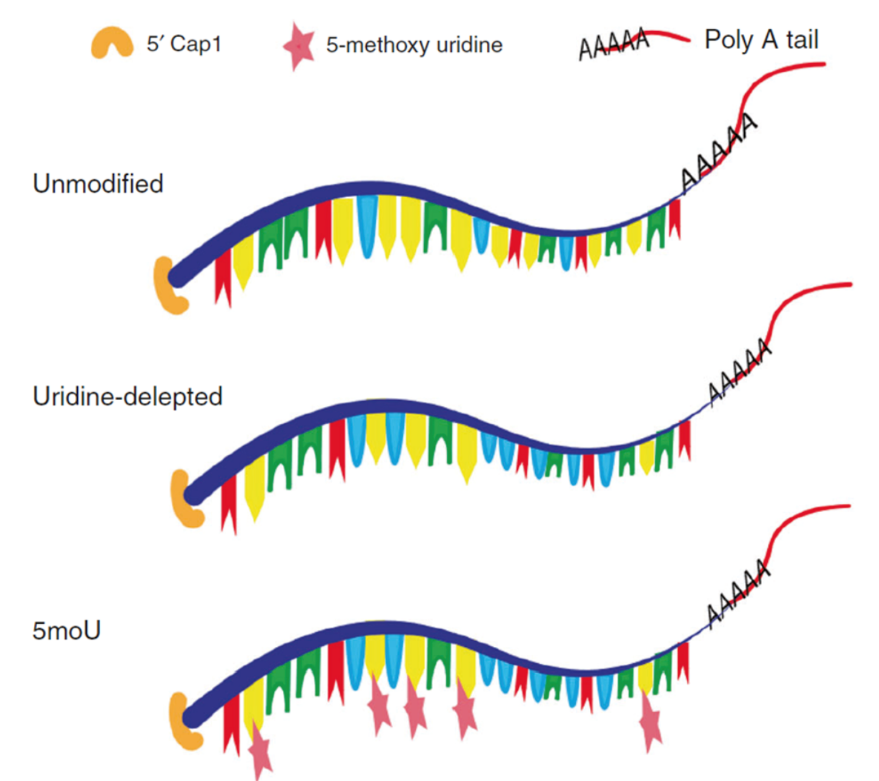
赤:A、黄:U、緑:G、青:C。Jiangらから転載。
世界保健機関(WHO)の"Messenger RNA encoding the full-length SARS-CoV-2 spike glycoprotein"(リンクからダウンロード可能)に明記されているとおり、Pfizer/BioNTechが開発したCOVID-19ワクチンに、CleanCap®(Cap1)とN1-メチルシュードウリジンが使用されている。ここに示すのは、このIVT mRNA製造工程(以下を参照)に使用されるTriLinkのN1-メチルシュードウリジン-5'-三リン酸の構造である。
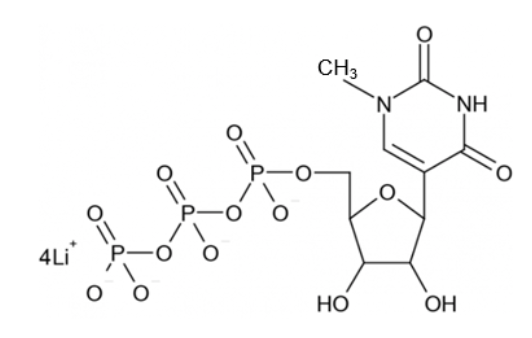
TriLink BioTechnologesから転載
ワクチンや治療薬として、化学修飾されたmRNA(modRNA)を使用することは、1998年にTod WoolfとSequiturのチームが、INEX Pharmaceuticals社とTekmira社に対して提案したことが始まりである。このことについては、彼の最近のYouTubeプレゼンテーション(36:30から)においても言及されている。「センスmRNA療法(Sense mRNA Therapy)」と題する関連特許出願(US Pat Appl 2003/0083272 A1)は、ホスホロチオエート修飾mRNAを用いた一例である。zoneは、この情報を提供してくれたTod Woolfに感謝の意を示している。
mRNAワクチンのデリバリー技術の進歩
効率的なin vivo mRNAのデリバリーもmRNAワクチンの開発に欠かせない。これは、mRNAワクチンに限らず、アンチセンスオリゴヌクレオチドや短鎖干渉オリゴヌクレオチドの臨床開発においても「delivery, delivery, and delivery」と言われ、重要課題とされている。
外来性mRNAが、細胞質に到達して機能性タンパク質に翻訳されるためには、脂質膜を通過しなければならない。最近のzoneによる報告では、裸のmRNAの一部は、膜の「孔」を生成するために使用されるエレクトロポレーションによって、細胞内に輸送されることが述べられている。しかし、他の文献では、in vivoデリバリーの大部は、ある種の脂質(またはリポイド)ナノ粒子(LNP)を利用していることが報告されている(下図を参照)。mRNAの取り込み効率は、mRNA複合体の物理化学的性質と細胞種に依存する。
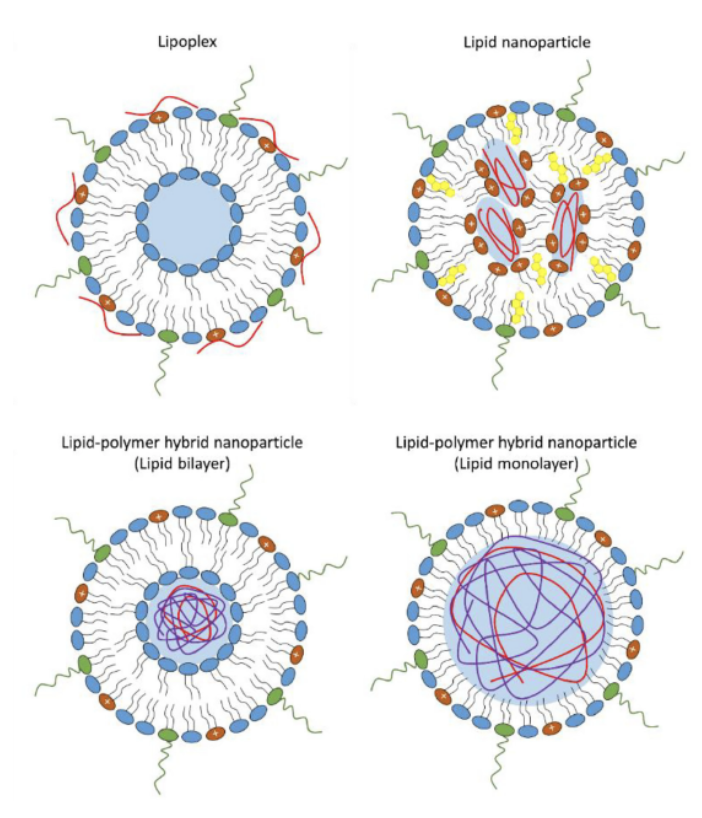
リポプレックス、脂質ナノ粒子、脂質-ポリマーハイブリッドナノ粒子(脂質シェルは二重層または単層として構成される)。Guevaraらから転載。
mRNAワクチンを輸送するための2つの基本的なアプローチがこれまでに報告されている。
ひとつめは、mRNAをex vivoで樹状細胞に提示した後、細胞を体内に投与する方法である。ふたつめは、mRNAを直接非経口的に投与する方法である。Ex vivoでの樹状細胞への抗原提示により、細胞標的、トランスフェクション効率、その他の細胞条件を制御することができるが、これは費用と人手のかかるワクチン接種法である。mRNAの直接注入は比較的迅速で費用対効果が高いが、すべての場合において正確かつ効率的な細胞種特異的な輸送が可能であるわけではない。
その他として、新たな脂質/リポイドのハイスループットスクリーニングを用いる方法(Ulkoski et al.)や、mRNA-LNP複合体を抗体に結合させて標的とする方法(Veiga et al.)が報告されている。
Pardiらによる2018年のレビューでは、以下の種類のLNPが議論されている。
- プロタミン(カチオン性ペプチド)複合体mRNA
- 正荷電した水中油型カチオン性ナノエマルジョンに結合したmRNA
- 化学修飾されたデンドリマーに結合し、ポリエチレングリコール(PEG)脂質と複合体を形成したmRNA
- PEG脂質ナノ粒子中のプロタミン複合体mRNA
- ポリエチレンイミン(PEI)などのカチオン性ポリマーに結合したmRNA
- PEIなどのカチオン性ポリマーおよび脂質成分に結合したmRNA
- 多糖類(例:キトサン)粒子またはゲルに結合したmRNA
- 1,2ジオレオイルオキシ3トリメチルアンモニウムプロパン(DOTAP)またはジオレオイルホスファチジルエタノールアミン(DOPE)脂質などのカチオン性脂質ナノ粒子中のmRNA
- カチオン性脂質およびコレステロールと複合体を形成したmRNA
- カチオン性脂質、コレステロールおよびPEG脂質と複合体を形成したmRNA
とりわけ、これらのmRNA輸送システムについては、XuらおよびGuevaraらによる前述の2020年のレビューで議論されており、詳細については両者を参照するとよい。
mRNAワクチンの効率的、特異的かつ安全な細胞内輸送のための製剤開発には、化学、生物学、毒性学にまたがる多数の知見が不可欠である。
感染症に対するmRNAワクチン
感染性病原体に対する予防ワクチンや治療ワクチンの開発は、予防および感染拡大の抑制に最も有効な手段である。
Pardiらによる2018年のレビューでは、従来のワクチンアプローチでは、HIV-1、単純ヘルペスウイルス(HSV)および呼吸器合胞体ウイルス(RSV)など、慢性または反復感染を引き起こす困難なウイルスに対して有効なワクチンをほとんど生み出せていないことが示唆された。彼らは、この失敗がmRNAワクチン戦略の研究につながったと述べる。
2020年から2021年には、COVID-19のパンデミックに応じて臨床試験の数が劇的に増加し、その結果、Pfizer-BioNTechとModernaが開発したCOVID-19 mRNAワクチンが前例のないほど迅速に承認された。上述したように、Pfizer-BioNTechワクチンは、CleanCap® Reagent AGとTriLinkのN1-メチルシュードウリジン-5'-三リン酸を用いて製造される。
現時点で、ClinicalTrial.govのウェブサイトにおいて、COVID-19に対するmRNAの臨床試験が37件ある。臨床試験の内容はこちらのページで読むことができる。ClinicalTrials.govのウェブサイトに掲載されている試験は、地域および関連する試験数[欧州(11)、米国(11)、東アジア(5)など]を示す地図を使って容易に閲覧できる。
各地域のより詳細な情報は、試験数をクリックすることで閲覧できる。例えば、米国の「11」をクリックすると、以下に示すように各州の試験数が表示される。
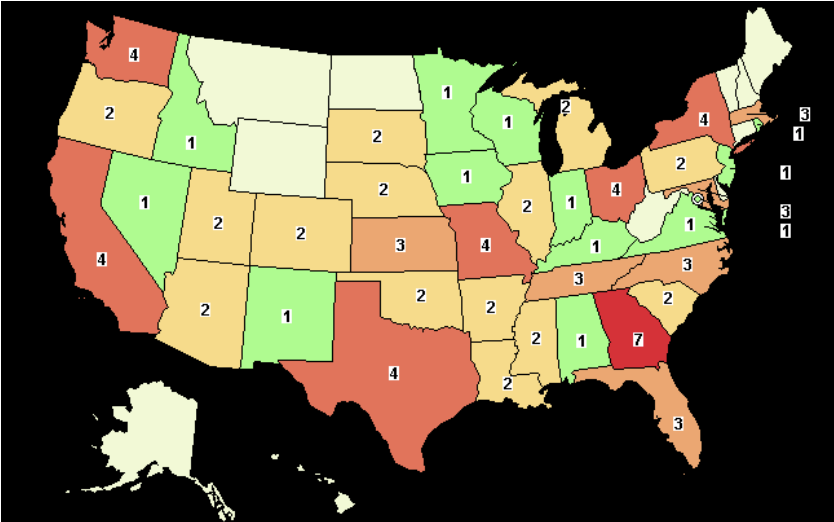
例えば、カリフォルニア州の「4」をクリックすると、すべての関連する詳細が表示される。
mRNAがんワクチン
Pardiらによる2018年のレビューによると、「がんワクチンは、がん細胞が発現している腫瘍抗原に特異性があるように設計できる。例えば、体細胞が変異した悪性細胞に認められる増殖関連因子を標的とするように設計できる。これらの腫瘍関連のネオ抗原、またはそのネオエピトープは、ヒトにおけるmRNAワクチンの標的として利用されている。ほとんどのがんワクチンは、予防を目的とするのではなく、治療を目的とする。腫瘍を除去または減少させることができる細胞傷害性Tリンパ球(CTL)による反応など、細胞性免疫を誘起することを目的とする」と述べられていた。
現在、ClinicalTrials.govによると、がんに対するmRNAワクチンの試験は63件ある。これらのがんは、血液/リンパ疾患、消化器疾患、肺/気管支疾患などの14のカテゴリーに分類される。
オンコロジー領域の前臨床試験に関する最近の企業報告の中で、BioNTech社は、CARVac(BNT211)とRiboCytokines(BNT151)のファースト・イン・ヒューマンの臨床試験において、患者1例に投与を行ったことを発表した。同社のオンコロジーパイプラインの開発は加速しており、現在進行中の14試験に13の製品候補がある。そのうち、少なくとも4件のデータ更新があり、最大3つのプログラムが第II相試験に、6つの前臨床プログラムが第I相試験に移行すると予想される。
治療上の考慮事項と課題
以下は、主にPardiらによる2018年のレビューから引用した概要の要約である。注記箇所はzoneによって加筆されたものである。
製造管理および品質管理の基準(GMP)に基づく製造
mRNAは、組換え酵素、リボヌクレオチド三リン酸(NTP)およびDNAテンプレートを用いたin vitro転写反応によって製造される。したがって、従来のタンパク質サブユニットワクチンや生ウイルスまたは不活化ウイルスワクチンの製造プラットフォームと比較して、迅速かつ比較的容易に製造できる。
収率の高さと簡便さから、比較的小さいGMP施設であってもmRNA製造は可能である。製造工程は配列に依存せず、主にRNAの長さ、ヌクレオチドおよびキャッピングの化学的特性、精製方法によって変わる。しかし、配列が極端に長いなどの場合は、製造が困難にあることがある。現在のところ、mRNAは製造工程を標準化しやすく、ほぼすべてのコードされたタンパク質を製造することができるため、突発的な感染症への迅速な対応に適している。
zone注:SARS-CoV-2変異株の流行にも対応できる。Fauciら(2021年)を参照。

mRNAのGMP製造(Good Manufacturing Practice)は、DNAテンプレートの製造から始まり、続いて酵素を用いてin vitro転写を行う。これは、ラボスケールのin vitro転写合成と同様のプロトコールである。(GMP製造では製品の安全性および品質を担保するための管理が追加される)。
mRNAのGMP製造に必要なすべての酵素や原料は市販されている。化学合成で作られた化合物、または細菌で発現された動物成分を含まない(アニマルフリー)原料があるため、外来性因子に関する安全性上の懸念は低減できる。従来型の細胞培養法でワクチンを製造する場合、生物由来原料を使用せざるを得ないケースがある。
プラスミドDNA、ファージポリメラーゼ、キャッピング試薬/酵素、NTPなどのすべての原料は、GMPグレード品が容易に入手できる。
zone注:詳細な例については、Hendersonらによる最近の論文(タイトル「Cap 1 Messenger RNA Synthesis with Co-transcriptional CleanCap® Analog by In Vitro Transcription」)を参照。
mRNAワクチンの安全性
予防を目的としたワクチンは、不特定多数へ投与されるため、厳しい安全性が求められる。
mRNAの製造工程では、人体に毒性のある化学物質やウイルスは使用されない。そのため、mRNAの製造では、生ウイルス、ウイルスベクター、不活化ウイルス、サブユニットタンパク質ワクチンなど、他のワクチン製造に伴う一般的なリスクを回避できる。また、mRNAの製造に要する期間が短く、微生物が混入するリスクを抑えられる。さらに、理論上、mRNAは宿主細胞のDNAへ組み込みまれるリスクがない。
以上の理由から、mRNAワクチンは比較的安全なワクチンフォーマットと考えられている。
Pardiらによる2018年のレビューでは、「将来、前臨床および臨床試験で起こり得る潜在的な安全性の懸念事項として、局所および全身の炎症、発現した免疫原の体内分布および持続性、自己反応性抗体の誘起、非天然のヌクレオチドおよびデリバリー用分子の潜在的な毒性などがある」と予測されていた。
彼らはまた、「一部のmRNAベースのワクチンプラットフォームが強力なI型インターフェロン(IFN)応答を誘導することが懸念され、これは炎症だけでなく、自己免疫にも関連している可能性がある。したがって、mRNAワクチン接種の前に自己免疫反応のリスクが高い人を特定することで、あらかじめ予防措置を講じることができるだろう」と付け加えた。
zone注:The National Institute of Allergy and Infectious Diseases (NIAID)がCOVID-19ワクチンのアレルギー反応を調べる臨床研究を実施している。
結び
ここまで見てきたように、mRNAワクチン開発は、RNAの自然免疫機能における複雑な相互作用や経路の分子基盤の理解、化学修飾によるRNA塩基の改変、LNPデリバリーシステムの開発によって大きく進展した。
COVID-19のパンデミックは、恐ろしいほどの被害をもたらしたが、一方で様々な組織(学術、企業、政府、社会)が、科学的、技術的、社会的に対応しようとした。
その過程において、in vitro transcription mRNA ワクチンの知見も蓄積された。今後もワクチン研究が継続、発展することを期待する。

CleanCapの製品・サービスはこちら
- mRNAワクチン/医薬品 研究・製造・QC用製品カタログ
- TriLink社 CleanCap® Reagent
- TriLink社 CleanCap® mRNA
- TriLink社 修飾ヌクレオシド三リン酸
- TriLink社 mRNA受託合成サービス(in vitro転写合成)




