【テクニカルレポート】エクソソーム除去FBS中に残存するエクソソーム量の評価 −高感度エクソソーム検出技術が可能にした新たな品質保証−
本記事は、和光純薬時報 Vol.89 No.2(2021年4月号)において、富士フイルム和光純薬 ライフサイエンス研究所 笹本 宏大が執筆したものです。
はじめに
種々の細胞から放出される小胞、エクソソームは生命現象の理解のための基礎研究だけでなく、近年診断や治療といった研究分野でも注目を集めている。培養細胞由来のエクソソームの取得及び解析を行うにあたっては、細胞培養時にエクソソーム除去処理したウシ胎児血清(Fetal Bovine Serum : FBS)を添加した培地が多く用いられているが、その残存の有無の詳細な検証や、その後の実験への影響を議論するようなことはあまり行われていない。そこで、本稿では当社が所有する高感度エクソソーム検出技術を用いて、エクソソーム除去後のFBS における残存エクソソーム量を比較解析した結果を紹介する。
エクソソーム
エクソソームは、細胞から放出される直径30-100nm 程度の膜小胞であり、CD9、CD63、CD81 をマーカータンパク質として有している1)。エクソソームはタンパク質や核酸(DNA、RNA、miRNA)、さらには脂質といった細胞由来成分を含有しており、これらを離れた細胞へ受け渡すことによる細胞間情報伝達を行うと考えられている。細胞外に放出されるという特徴から、血液(血清・血漿)、尿、唾液などの体液にも存在が確認されており、さらにはがんなどの疾患のバイオマーカーを有しているという報告もあることから、ここ数年で注目度が大きく上昇している2, 3)。
エクソソーム研究におけるFBS
エクソソーム研究において、培養上清から精製した細胞由来エクソソームを解析に用いることが一般的に行われている。通常の細胞培養にはFBS を添加した培地が幅広く使用されているが、細胞由来エクソソームの取得を目的とした培養においては、FBS に多量に含まれるウシ由来エクソソームの混入を避けるために無血清培地かウシ由来エクソソームを除去したFBS を添加した培地が使用されている。エクソソームを除去したFBS には、超遠心分離法にてエクソソーム除去を行った自家調製FBS や、ウシ由来エクソソーム除去済みを謳っている市販品が一般的に使われている。そして、これらの品質保証としては、残存エクソソームの粒子数やmiRNA 量の測定、ウエスタンブロットやELISA キットなどによるマーカータンパク質の検出によって残存エクソソーム量の確認が行われている。
PSアフィニティー ELISAによるFBS中ウシ由来エクソソームの高感度検出
当社はエクソソームの表面に存在するホスファチジルセリン(Phosphatidylserine : PS)とカルシウムイオンの存在下で結合するTim4 タンパク質を使用したPS アフィニティー法というエクソソーム精製技術及びこれを応用したPS アフィニティーELISAというエクソソーム定量解析技術を有している4)。PS アフィニティーELISAは、Tim4 タンパク質を固相化したプレートに培養上清や血清などのエクソソーム含有サンプルを添加し、カルシウムイオン存在下でエクソソームを捕捉させ、エクソソーム表面マーカータンパク質に対する抗体反応によりエクソソーム検出を行うものであり、ウエスタンブロットのおよそ1,000倍以上、エクソソーム表面マーカー抗体を固相化した既存のELISA キット(検出感度は数ng ~数μg 程度)のおよそ100 倍以上の検出感度を有することを確認している(図1)。
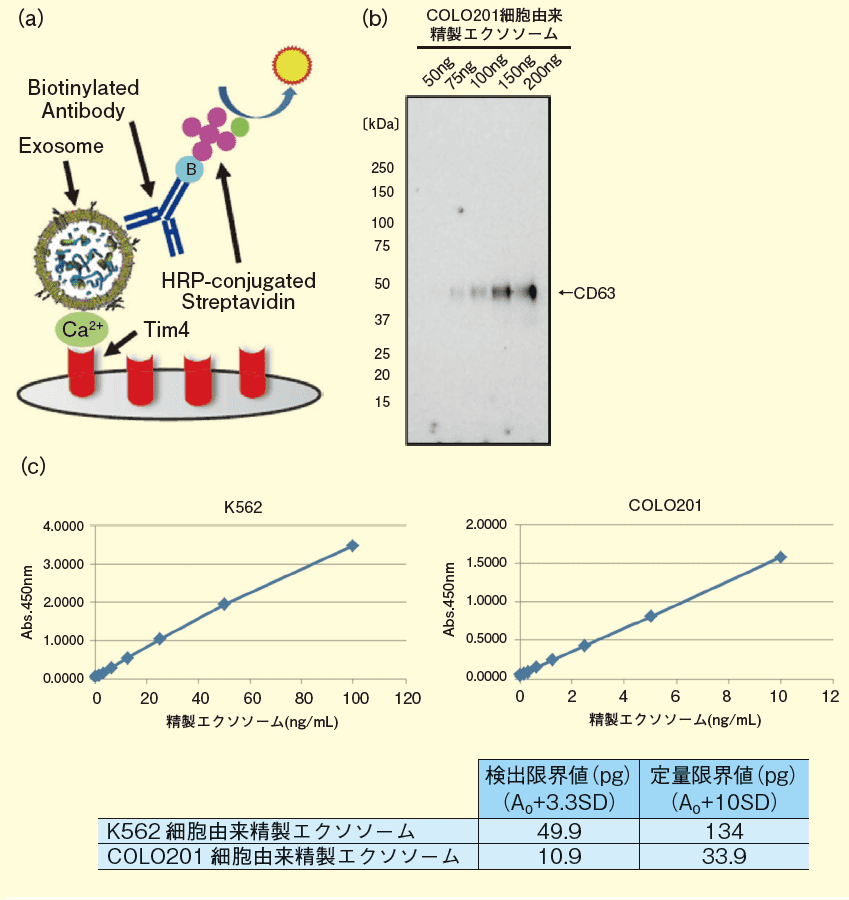
図1. ウエスタンブロットとPS アフィニティーELISA の検出感度比較
(a)PS アフィニティーELISA の原理:固相化したTim4 タンパク質で捕捉したエクソソームを、表面抗原を認識する抗体で検出することで定量解析を行う当社の独自技術。(b)ウエスタンブロットによるエクソソーム検出感度:COLO201 細胞由来精製エクソソーム(MagCapture™ Exosome Isolation Kit PS 使用)をそれぞれ50、75、100、150、200ng 電気泳動し、抗CD63 抗体でウエスタンブロット検出した。検出限界は75ng 程度。
(c)PS アフィニティーELISA による検出限界値:K562 細胞及びCOLO201 細胞由来精製エクソソーム(MagCapture™ Exosome Isolation Kit PS 使用)を段階希釈したサンプル及びバッファーのみのブランク値の活性を測定し、その結果を基に各サンプルの最低検出感度を算出した(各濃度ポイントはn=6 で、A0 ポイントはn=12 で測定した)。検出限界はK562 細胞由来エクソソームが49.9pg、COLO201 細胞由来エクソソームが10.9pg 程度。
さらに、当社ではエクソソーム表面マーカータンパク質であるCD9、CD63、CD81 に対するモノクローナル抗体を樹立・製品化している。そのうちの抗CD9, モノクローナル抗体 (1K)及び抗CD81, モノクローナル抗体(17B1) は共にウシ抗原への交差性を有しており、上述のPS アフィニティーELISA における検出抗体として用いることで、FBS に含まれるウシ由来エクソソームの高感度な検出が実現可能となった。
そこで今回、高感度エクソソーム検出技術を用いて、超遠心処理によりエクソソームを除去したFBS や市販品のエクソソーム除去済みFBS における残存ウシ由来エクソソーム量の比較解析を行った(図2)。すると非常に興味深い事に、一般的に広く論文でエクソソーム除去法として用いられている超遠心処理にて除去を行ったFBS や、エクソソーム除去済みを謳っている2 つの市販品については、依然として多量のウシ由来エクソソームが残存していることが明らかにされた(図2(a))。一方、当社で新たに販売予定であるBioSera 社Exosome-Depleted FBSには、残存ウシ由来エクソソームがほぼ検出されないことが確認された( 図2(a))。
加えて、ヒト胎児肺由来正常二倍体線維芽細胞(TIG3)の培養による細胞増殖能の評価を行ったところ、BioSera 社 Exosome-Depleted FBS は市販品と同等以上の細胞増殖能を持つことも明らかとなっている(図 2( b))。
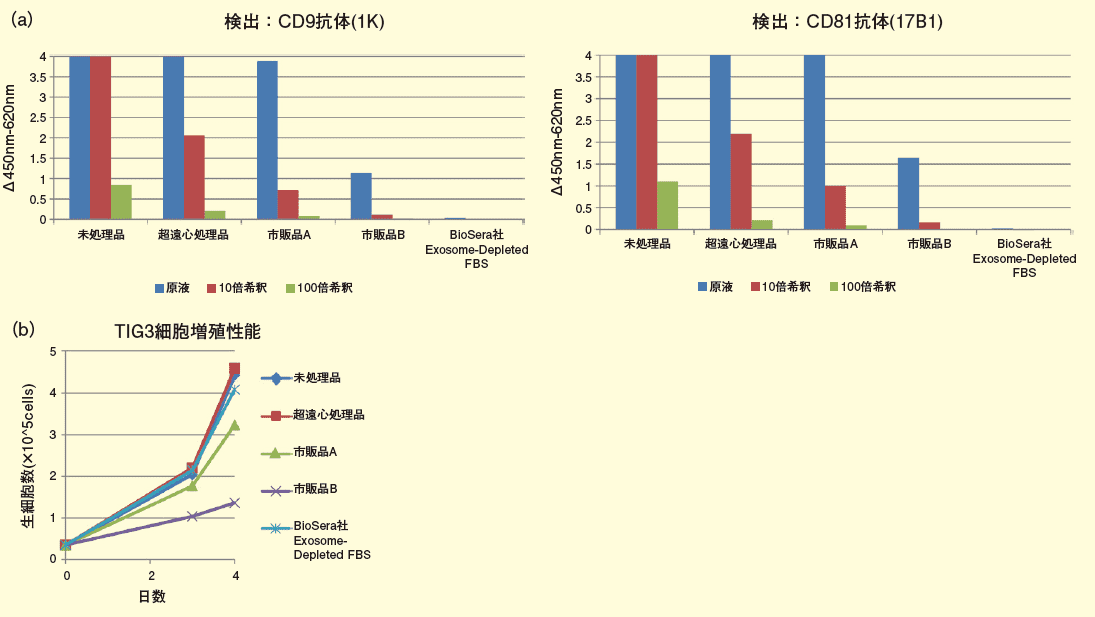
図2.エクソソーム除去FBS の評価
(a)PS アフィニティーELISAによるFBS中のウシ由来エクソソームの検出:抗CD9抗体(1K)[ コードNo. 014-27763]、抗CD81抗体(17B1)[ コード No. 011-27773]をビオチン標識し、PS CaptureTM Exosome ELISA Kit( Streptavidin HRP)[ コード No. 298-80601]の検出抗体と置き換えて実施。FBS は未処理品、超遠心処理品(120,000 × g, 18h)、市販品エクソソーム除去FBS2 種、BioSera 社Exosome-Depleted FBS の原液、10 倍希釈品、100 倍希釈品を使用。シグナル値4 以上は検出限界以上。(b)エクソソーム除去FBS の細胞増殖能評価:D-MEM(低グルコース) [コードNo. 041-29775]に各FBS(未処理品、超遠心処理品、市販品エクソソーム除去FBS2 種、BioSera 社Exosome-Depleted FBS)を10% の濃度で添加した培地でTIG3 を4 日間培養した。播種後3 日後及び4 日後に生細胞数をカウントした。
おわりに
今回我々は高感度な検出が可能なPSアフィニティーELISAとウシ抗原への交差性を持つエクソソーム表面マーカータンパク質抗体を組合せることにより、FBS 中の残存ウシ由来エクソソーム量を高感度に検出できる測定系を確立した。そして、一般的に使用されているエクソソーム除去後FBS においては、多量のウシ由来エクソソームの残存が明らかとなり、既存のエクソソーム検出技術を用いた品質保証ではエクソソーム残存の有無の証明が非常に困難であることが明らかとなった。
当然ながら、細胞培養上清中に混入しているウシ由来エクソソームは、下流の実験や解析におけるバックグラウンドに多大な影響を与えることが懸念される。そのため、高感度検出が可能なPS アフィニティーELISA を用いて確かな品質が保証されたFBS の使用や、エクソソームが限りなく除去されているBioSera 社Exosome-Depleted FBS を用いることで、正確かつ明瞭な研究データを再現性良く取得することが可能になると我々は考えている。
以上、繰り返しになってしまうが、当社が提供する高感度検出が可能なPS アフィニティーELISA や、BioSera 社Exosome-Depleted FBS が有効活用されることで、今後のエクソソーム関連研究の発展に繋がっていくことを大いに期待している。
参考文献
- Colombo, M. et al. : Annu. Rev. Cell Dev. Biol., 30, 255 (2014). DOI: 10.1146/annurev-cellbio-101512-122326
- Tkach, M. et al. : Cell, 164, 1226 (2016). DOI: 10.1016/j.cell.2016.01.043
- Raimondo, F. et al. : Proteomics, 11, 709 (2011). DOI: 10.1002/pmic.201000422
- Nakai, W. et al. : Sci. Rep., 6, 33935 (2016). DOI: 10.1038/srep33935















