MassivEV™ EV Purification Column PS / MassivEV™ Purification Buffer Set
エクソソームに代表される細胞外小胞(EV: Extracellular Vesicles)は細胞が放出する脂質二重膜の微小な小胞で、核酸・タンパク質・脂質などを内包しています。生体では細胞間のコミュニケーションツールとして利用されており、免疫をはじめ、がん・神経・代謝など様々な分野で研究が盛んに行われています。
EVの応用分野は幅広く、治療薬やバイオマーカー、ドラッグデリバリーシステム(DDS)への応用が期待されています。特に間葉系幹細胞(MSC: Mesenchymal stem cell)が分泌するEVは抗炎症や抗線維化、組織修復などの作用があることが報告され1)、医療に限らず化粧品や食品などの分野においても注目が集まっています。
EVの実用化には、高純度なEVを効率良く大量に単離・精製できる技術が必要です。当社では金沢大学医学系免疫学の華山教授と共同開発した、独自のEV単離・精製技術である「PSアフィニティー法」2)を応用し、EVの大量精製用カラム MassivEV™ EV Purification Column PSを開発しました。専用バッファーのMassivEV™ Purification Buffer Setと合わせて用いることで、リッタースケールの細胞培養上清から、エクソソームなどのEVを簡便に単離・精製することができます。

MassivEV™ EV Purification Column PS
MassivEV™ Purification Buffer Set
製品概要
MassivEV™ EV Purification Column PSおよびMassivEV™ Purification Buffer Setは大容量の細胞培養上清からエクソソームなどの細胞外小胞(EV)を単離・精製するためのカラムとその専用バッファーです。EVの膜表面に存在するホスファチジルセリン(PS)に対してカルシウム依存的に結合するTim4タンパク質を使用した「PSアフィニティー法」によって高純度なEVを簡便に精製できます。
特長
- 大容量(10 mL~Lスケール)の細胞培養上清から高純度なEVを効率良く単離・精製可能
- タンジェンシャルフローろ過(TFF)システムのような高価な装置は不要 ※ 別途ペリスタポンプが必要となります
表1 間葉系幹細胞の細胞培養上清 200 mLからEVを単離・精製した場合の比較表 (当社調べ)
| MassivEV™ | TFF+陰イオン交換クロマトグラフィー | TFF+サイズ排除クロマトグラフィー | |
|---|---|---|---|
| 精製できるEV | PS陽性EV | フラクションにより異なる | フラクションにより異なる |
| 純度 | 高い | 低い | 低い |
| 精製段階の工程数 | 1工程 ∟PSアフィニティー法 |
2工程 ∟TFFシステム ∟陰イオン交換クロマトグラフィー |
2工程 ∟TFFシステム ∟サイズ排除クロマトグラフィー |
| 回収したEV粒子数 (参考値) | 1.7x1011 particles | 1.1×1011 particles | 0.7×1011 particles |
| 精製段階にかかる時間 | 8時間 | 10時間 | 10時間 |
適応
細胞培養上清(MSCなど): 10 mL~ L スケール
処理能力
| 1 mL (コードNo. 131-19491) | 5 mL (コードNo. 137-19493) | |
|---|---|---|
| 処理サンプル量※1 | 200 mL | 1 L |
| 動的結合容量※2 | 5×1011 particles/mLレジン | 2.5×1012 particles/5 mLレジン |
原理
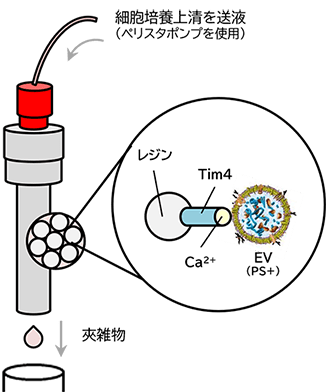
PSアフィニティー法は、EVの表面に存在するホスファチジルセリン(PS)と特異的に結合するTim4タンパク質を利用した当社独自のEV単離手法です。
PS-Tim4結合の高い特異性とキレート剤によるマイルドな溶出で高純度なEVをインタクトな状態で単離できます。
-
結合
-
溶出
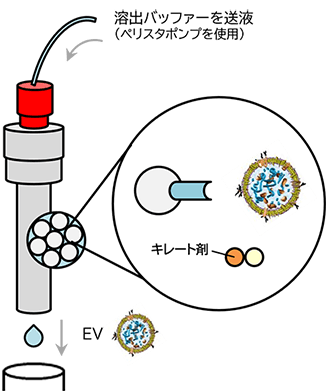
図1 MassivEV™ EV Purification Column PS (PSアフィニティー法)による細胞外小胞の単離・精製の原理
プロトコル
下記は標準的なプロトコルの概要です。詳細な手順は取扱説明書をご確認ください。なおサンプル反応時の流速を 2 倍にして操作時間を短縮する方法もございます。詳細は取扱説明書(時短 Ver.)をご覧ください。
01
任意の細胞を培養し、細胞増殖とEV産生を行い、細胞培養上清を回収する。
(>2時間)
02
細胞培養上清にEV Binding Enhancerを添加する。
03
遠心分離もしくはフィルターによって夾雑物を除去する。
04
室温以上の温度(25-28℃)になるように細胞培養上清を加温し、フィルターでろ過する。
(>7時間)
05
カラムを室温に戻し、Washing Bufferをカラムに流す。
06
細胞培養上清をカラムに流し、EVのPSとレジンのTim4タンパク質を反応させる。
07
EV Binding Enhancer/Washing Bufferをカラムに流し、レジンを洗浄する。
08
EV Elution/EV-Stabilizer Bufferでカラム内のEV Binding Enhancer/Washing Bufferを40%置換する。
その後、EV回収用チューブをセットし、EV Elution/EV-Stabilizer Bufferを流してEVを回収する。
09
Washing Bufferを流した後、20%エタノール/Storage Bufferを流す。カラム上部にパラフィルムを巻いて冷蔵(2-10℃)で保存する。
(30分~ 1時間)
10
ゲルろ過もしくは限外ろ過によってバッファー交換を行う。
【プロトコル】 MassivEV™ EV Purification Column PSを用いた細胞外小胞の大量精製
(Youtube 3:26)
データ
性能データ
従来法との比較
骨髄由来MSCを増殖培地(MSCulture™/ 10% FBS)およびEV産生培地(EV-Up™)で培養し、細胞培養上清を回収後、0.22 μmのフィルターでろ過した。ろ過処理後の細胞培養上清 200 mLをサンプルとして、以下4つの方法でEVを単離・精製した。また精製後のEV溶液はNanoparticle Tracking Analysis (NTA)、ELISA、BCA法にてそれぞれ解析した。
<単離手法>
- MassivEV™
- MassivEV™ EV Purification Column PS / MassivEV™ Purification Buffer Set (本製品, PSアフィニティー法)
- TFF
- タンデンシャルフローろ過(500 kDa)のみ
- TFF+AEX
- タンデンシャルフローろ過(500 kDa)+陰イオン交換クロマトグラフィー
- TFF+SEC
- タンデンシャルフローろ過(500 kDa)+サイズ排除クロマトグラフィー
(1) NTAによる粒子解析
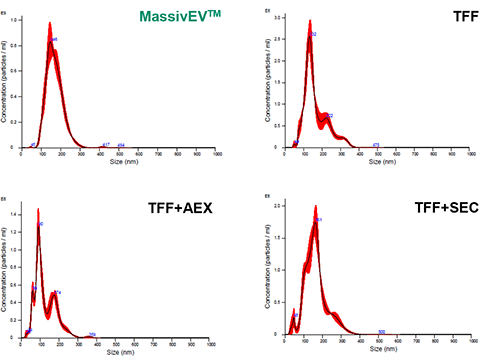
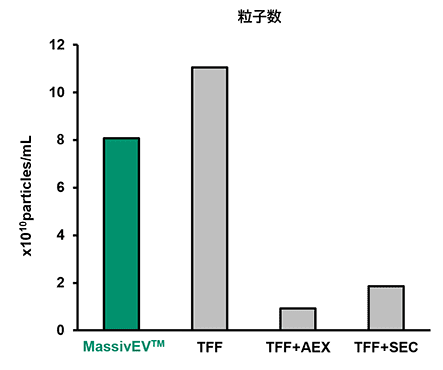
[結果]
MassivEV™はTFFと比較して粒子数は少ないものの、TFF+AEXやTFF+SECと比較して多くの粒子を得ることができた。
(2) CD63 ELISAおよびCD81 ELISAによるEV回収率の比較(n=3)
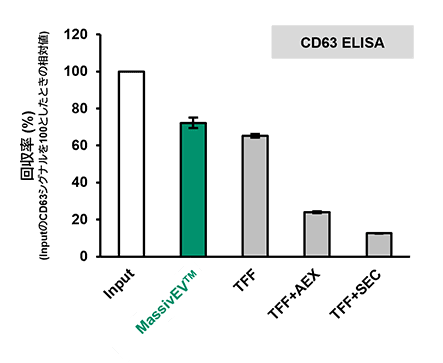
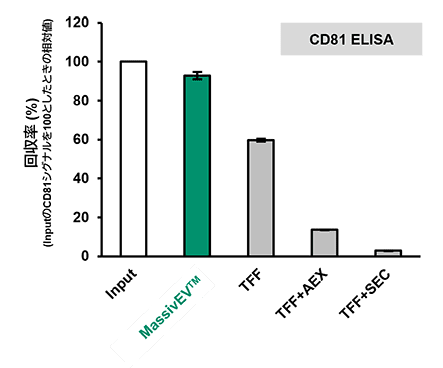
[結果]
MassivEV™は従来法と比較して高いEV回収率を示した。
(3) タンパク質 1μgあたりの粒子数
EVの純度を示す指標の1つとして、タンパク質あたりの粒子数が有効であることが報告されている6)。回収したEV溶液の総タンパク質量をBCA法で、粒子数をNTAでそれぞれ測定し、タンパク質 1μgあたりの粒子数を比較した。
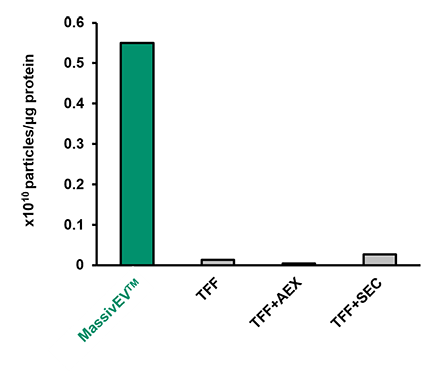
[結果]
MassivEV™は従来法と比較してタンパク質 1μgあたりの粒子数が多く、より純度の高いEVが回収できていることが示唆された。
ライセンスについて
本製品は研究用途でご使用ください。営利・商業目的にご使用される場合には、当社(ffwk-labchem-tec@fujifilm.com)までお問い合わせください。
参考文献
- Phinney, D. G. and Pittenger, M. F.: Stem cells, 35(4), 851(2017).
Concise review: MSC-derived exosomes for cell-free therapy - Nakai, W. et al.: Sci. Rep. 6(1), 1(2016).
A novel affinity-based method for the isolation of highly purified extracellular vesicles - Mansouri, N. et al.: JCI insight, 4(21), e128060(2019).
Mesenchymal stromal cell exosomes prevent and revert experimental pulmonary fibrosis through modulation of monocyte phenotypes - Angioni, R. et al.: Int. J. Mol. Sci., 21(22), 8874(2020).
Administration of human MSC-derived extracellular vesicles for the treatment of primary sclerosing cholangitis: preclinical data in MDR2 knockout mice - Perets, N. et al.: Mol. Autism, 11(1), 65(2020).
Exosomes derived from mesenchymal stem cells improved core symptoms of genetically modified mouse model of autism Shank3B - Théry, C. et al.: J. Extracell. Vesicles, 7(1), 1535750(2018).
Minimal information for studies of extracellular vesicles 2018 (MISEV2018): a position statement of the International Society for Extracellular Vesicles and update of the MISEV2014 guidelines
製品一覧
- 項目をすべて開く
- 項目をすべて閉じる
- 掲載内容は本記事掲載時点の情報です。仕様変更などにより製品内容と実際のイメージが異なる場合があります。
- 掲載されている製品について
- 【試薬】
- 試験・研究の目的のみに使用されるものであり、「医薬品」、「食品」、「家庭用品」などとしては使用できません。
- 試験研究用以外にご使用された場合、いかなる保証も致しかねます。試験研究用以外の用途や原料にご使用希望の場合、弊社営業部門にお問合せください。
- 【医薬品原料】
- 製造専用医薬品及び医薬品添加物などを医薬品等の製造原料として製造業者向けに販売しています。製造専用医薬品(製品名に製造専用の表示があるもの)のご購入には、確認書が必要です。
- 表示している希望納入価格は「本体価格のみ」で消費税等は含まれておりません。
- 表示している希望納入価格は本記事掲載時点の価格です。





