【テクニカルレポート】細胞外小胞の蛍光標識とその問題点
本記事は、和光純薬時報 Vol.86 No.4(2018年10月号)において、富士フイルム和光純薬 ライフサイエンス研究所 請川 亮が執筆したものです。
はじめに
Exosomeを始めとする細胞外小胞はさまざまな細胞から放出される膜小胞であり、細胞間情報伝達のメッセンジャーとしての役割や疾患バイオマーカーとして近年高い関心を集めている1)。それ故に、ここ数年でさまざまな研究分野において exosome 研究が広がってきているが、実験技術は発展途上であり、改善すべき課題が数多く存在する。
その中で、我々は新規アフィニティー単離法である'PS アフィニティー法'を開発し、従来法に比べ、各種サンプルからインタクトかつ高純度な exosome 精製を可能にし、さらに、その技術を exosome 検出に応用した PS アフィニティー ELISA 法の開発にも成功している2, 3)。
Exosome 研究において、単離・精製した exosome の生物活性を評価するため、細胞や動物への添加・投与実験が行われている。一般的な手法は、対象に exosome が取り込まれていることを確認するため、蛍光色素標識による可視化及びトレースが用いられる。しかしながら、先に述べたように exosome 実験技術は依然発展途上であり、蛍光色素標識においても非常に注意を要する問題点が存在している。
本稿では、種々のメーカーから販売されている蛍光標識色素を用いた exosome 標識検討と注意すべき問題点について述べる。
Exosome蛍光標識実験における未標識色素除去時の吸着ロスについて
Exosomeを含む細胞外小胞の蛍光標識試薬には、脂質や核酸、細胞膜を蛍光標識する試薬が転用されており、種々のメーカーから販売されている。その標識方法は、各種サンプルから単離・精製した exosome サンプルと蛍光色素を反応させ、未反応の蛍光色素をゲルろ過や限外ろ過デバイスを用いて除去するものである。
今回、我々はこの蛍光標識の過程で、特に未反応の蛍光色素を除去するステップにおいて、exosome サンプルを著しく吸着ロスすることを明らかにし、同時に我々が開発した EV-Save™ Extracellular Vesicle Blocking Reagent(以下、EV-Saveと略す)を exosome サンプルに添加することで、その吸着ロスを強力に抑制できることが確認できた(図 1)。
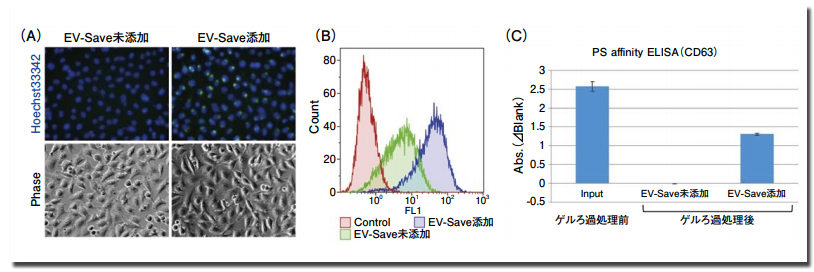
図 1.蛍光標識 exosome サンプルの取り込み確認と EV-Save による吸着ロス抑制効果
MagCapture™ Exosome Isolation Kit PS を用いて単離した COLO201 由来 exosome サンプル(1 x 1010 particles)について、A 社蛍光標識試薬によるラベリングを行った後、HeLa 細胞への取り込みを蛍光顕微鏡(A)とフローサイトメーター(B)で確認した。同上の exosome サンプル(5 x 109 particles )を用意し、ゲルろ過処理前後のロスについて、PS Capture™ Exosome ELISA Kit を用いて CD63 シグナルの比較を行った(C)。
MagCapture™ Exosome Isolation Kit PSを用いて COLO201 細胞培養上清から単離・精製した exosome サンプルについて、A 社蛍光標識試薬を用いて蛍光標識を行い、B 社ゲルろ過カラムを用いて未反応色素の除去を行った。得られた蛍光標識 exosome サンプルを HeLa 細胞へ添加し、24 時間経過時点での細胞への取り込みを蛍光顕微鏡及びフローサイトメーターを用いて検出した。
その結果、蛍光色素標識時に予めサンプルに EV-Save を添加しておくことで、EV-Save 未添加時と比較して細胞内で検出される蛍光シグナルが大きく増強されることが確認された(図 1、A, B)。さらに、PS Capture™ Exosome ELISA Kitを用いて、ゲルろ過前後の exosome サンプルの吸着ロス比較を行ったところ、EV-Save 未添加サンプルではゲルろ過処理後に exosome 表面マーカーである CD63 のシグナルが検出されないのに対し、EV-Save 添加サンプルでは CD63 のシグナルが検出され、EV-Save はゲルろ過処理による吸着ロスを強力に抑制できることが確かめられた(図 1、C)。
各蛍光標識試薬を用いたExosome染色手法とその特異性における問題点
次に各蛍光標識試薬を用いた exosome 蛍光標識及び細胞への取り込み性能の比較を行った。今回、A、B 及び C社の蛍光標識試薬を用いた。COLO201細胞培養上清から MagCapture™ Exosome Isolation Kit PS により精製した exosome サンプルを各蛍光標識試薬を用いて蛍光標識し、HeLa 細胞への取り込み確認を行った(図 2、A, B)。
結果、蛍光顕微鏡観察において各蛍光標識試薬により標識された exosome が細胞内に取り込まれていることが確認され(図 2、A)、さらに、フローサイトメーターによる解析においても、コントロールの無添加及び Elution bufferを標識したネガティブコントロールと比較してピークが大きくシフトしていることから、蛍光標識された exosome がレシピエント細胞に取り込まれていることが確認できた(図 2、B)。
しかしながら、ネガティブコントロールとして用いた 1% BSA 溶液を各試薬で標識し、他のサンプルと同様に細胞へ添加したところ、蛍光標識された exosome サンプルと同様に、フローサイトメーター解析においてピークシフトが観察された(図 2、B)。
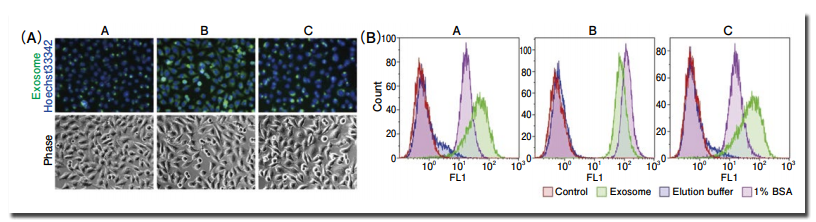
図 2.各蛍光標識試薬を用いた exosome 標識と HeLa 細胞への取り込み確認
MagCapture™ Exosome Isolation Kit PS を用いて単離した COLO201 由来 exosome サンプル(1 x 1010 particles)について、各蛍光標識試薬による標識を行った後、HeLa 細胞への取り込みを蛍光顕微鏡(A)とフローサイトメーター(B)で確認した。また、コントロールとして同様に蛍光標識処理を行ったキット添付の Elution buffer 及び 1% BSA 溶液も用意し、細胞へ添加した(B)。この事から、各蛍光色素標識試薬は、その原理上 exosome のみならずタンパク質に対しても標識作用があり、exosome標識試薬として用いる目的においては特異性に大きな問題点が存在することを示唆している。この結果を鑑みると、市販の蛍光標識試薬を用いて標識・細胞への取り込み確認実験を行う場合は、レシピエント細胞内で検出される蛍光シグナルが exosome に由来するシグナルなのか、または exosome 単離時にコンタミネーションしたタンパク質などの不純物に由来するシグナルなのか、結果の解釈には細心の注意を払う必要があり、それ故に細胞への取り込み確認検証を行う際は、調製した exosome サンプルの純度が非常に重要になり得るといえる。
そこで、我々の PS アフィニティー法と超遠心分離法で同量の培養上清サンプルから単離・精製した exosome サンプルを A 社蛍光標識試薬を用いて標識し、細胞への取り込み確認実験を行った(図 3)。蛍光顕微鏡解析の結果、超遠心分離法で単離・精製した exosome サンプルの方が PSアフィニティー精製 exosome サンプルよりレシピエント細胞へ多く取り込まれていることが明らかとなった(図 3、A)。
しかしながら、精製 exosome サンプルの詳細な解析を行ったところ、タンパク質濃度や粒子数解析からは超遠心分離サンプルの方がよりexosome 量が多いことが示されているにもかかわらず、exosome マーカーであるCD63 シグナルをPS Capture™ Exosome ELISA Kitを用いて測定すると、粒子当たりの CD63シグナル強度は PS アフィニティー法で単離・精製したサンプルの方が圧倒的に高く、超遠心法で単離・精製した exosomeサンプルより高純度であることが明確に示されている(図 3、B)。
このことから、夾雑物が非常に多くコンタミネーションする単離・精製手法である超遠心分離法で調製された exosome サンプルを用いた場合、レシピエント細胞における取り込みシグナルの実体は exosome のみならず、夾雑タンパク質などに由来している可能性が強く示唆される。
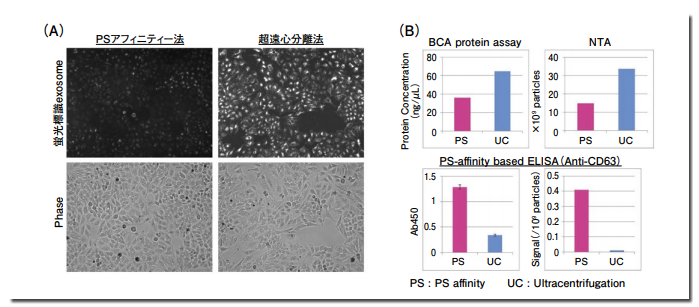
図 3.PS アフィニティー精製と超遠心精製 exosome の取り込み効率比較
MagCapture™ Exosome Isolation Kit PS と超遠心法を用いて単離した COLO201 由来 exosome サンプル(8 x 109 particles)について、A 社蛍光標識試薬による標識を行った後、HeLa 細胞への取り込み効率を蛍光顕微鏡にて比較した(A)。各精製法で調製した exosome サンプルについて、BCA assay 及び NanoSight を用いた NTA にてタンパク質濃度と粒子数を測定し、同時に PS アフィニティー ELISA 法にて CD63 のシグナル測定を行った(B)。おわりに
以上、exosome の蛍光標識法及び細胞への取り込み確認を行う上で注意すべきポイントとして、exosome が有する吸着特性によって大きな収量低下に繋がる可能性があること、現状市販されている蛍光標識試薬は exosome の染色を目的としたものではなく、exosome への特異性が低いことを挙げた。そして、高純度な exosome サンプルを如何にして調製するか、その単離・精製手法の重要性を指摘した。
しかしながら、これまで(現在も)exosomeを含む細胞外小胞の単離・精製法のゴールドスタンダードは超遠心精製法とされてきており、最も主たる方法として数多くの論文報告で採用されているが、実際は非細胞外小胞由来の夾雑タンパク質が多く混入するexosome サンプル調製手法であり、夾雑物が下流の実験結果に与える影響を十分に精査しているとは言い難い状況が続いている。
なお、International Society for Extracellular Vesicles の機関誌「Journal of Extracellular Vesicles」においてもこの問題は提起されている 4)。その中で、我々が開発した'PSアフィニティー法'をベースとした MagCapture™ Exosome Isolation Kit PS は、現状改善の余地を残しているが、超遠心分離法や各単離・精製キットと比較して、簡便かつ高純度な exosome サンプルの取得を可能にしている。
今後、当社製品が exosomeを始めとする細胞外小胞研究の更なる発展に貢献できることを切に願う。
参考文献
- Tkach, M. et al. : Cell, 164, 1226 (2016). DOI: 10.1016/j.cell.2016.01.043
- Nakai, W. et al. : Sci. Rep., 6, 33935 (2016). DOI: 10.1038/srep33935
- Saito, S. et al. : Sci. Rep., 8, 3997 (2018). DOI: 10.1038/s41598-018-22450-2
- Gardiner C. et al. : J. Extracell. Vesicles, 5, 32945 (2016). DOI: 10.3402/jev.v5.32945















