【総説】プロテインシーケンサ PPSQ™-50 グラジエントシステムの開発
本記事は、和光純薬時報 Vol.86 No.4(2018年10月号)において、株式会社島津製作所分析計測事業部グローバルアプリケーション開発センター 栗木 智子様、株式会社島津製作所分析計測事業部ライフサイエンス統括事業部バイオ臨床ビジネスユニット 秋永 伸幸様、安藤 英治様、富士フイルム和光純薬株式会社 試薬化成品事業部 楠本 美紀、山田 裕子、水井 浩司、早川 昌子に執筆いただいたものです。
はじめに
ゲノムデータベースに登録されているタンパク質は、多くは前駆体タンパク質として登録されているため、成熟タンパク質の N 末端配列を同定することは、タンパク質の機能を解明する上で重要となる。質量分析装置の技術的発展に伴い、質量分析装置を用いたタンパク質の末端解析方法 1)や、データベースに依存せずに行う方法 2)等が報告されている。
一方、プロテインシーケンサの特長としては、配列結果の信頼性が高く、確実なアミノ酸配列決定が可能、タンパク質の酵素消化等を行わずそのまま分析可能、同じ質量数を有するIleとLeuを区別できる、ジスルフィド結合(S-S 結合)の有無とその位置を決定できる、操作が容易であることなどが挙げられ、タンパク質の N 末配列解析を行う上で欠かせないものになっている。

図1.プロテインシーケンサ PPSQ-50グラジエントシステム
近年、バイオ医薬品の開発が進み、多くのバイオ医薬品が販売されている。タンパク質性医薬品、抗体医薬品はその特性解析に N 末端部アミノ酸配列解析が必要とされており、研究・開発の分野だけでなく品質管理の分野においても、プロテインシーケンサは不可欠な装置となっている。また、タンパク質の前処理技術の進歩により、微量の未知のタンパク質を精製することが可能になった。
その結果、微量サンプルのアミノ酸配列を同定するためにプロテインシーケンサの高感度化が期待されている。著者らは、研究分野、生産分野における様々な需要に対応するため、従来のイソクラティックシステムの特長を活かし、グラジエント溶離により、疎水性の高い PTH-アミノ酸の検出の改善を行い、より高感度化を実現した「PPSQ50グラジエントシステム」を開発した(図1)。
本稿では、PPSQ-50グラジエントシステムの特長とその応用例について紹介する。
島津プロテインシーケンサの歴史
タンパク質の一次構造決定方法として、1950 年にペール・エドマンが、タンパク質・ペプチドの N 末端より、逐次的にペプチド結合を切断するエドマン分解 3)を提唱した。その後、1967 年にエドマンらにより、液相でエドマン分解を自動処理する装置が開発された 4)。1980 年代に気相式でエドマン分解を自動処理し、高速液体クロマトグラフィー(HPLC)により PTH- アミノ酸をイソクラティック溶離し分析する国産初の気相式プロテインシーケンサ PSQ-1 が開発された 5)。
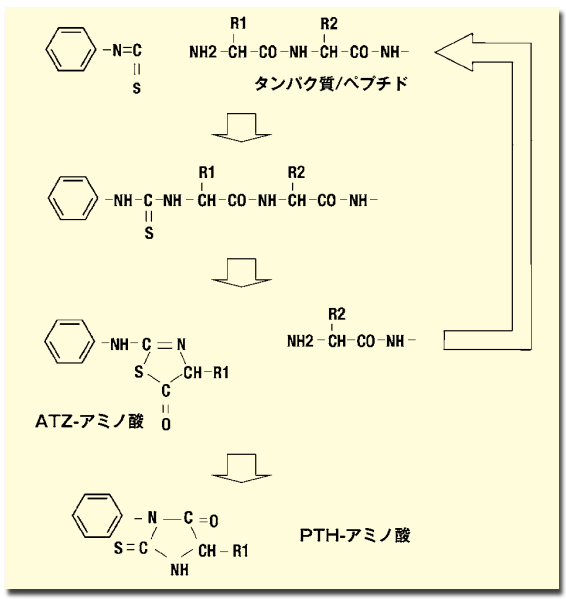
図2.エドマン分解のスキーム
ATZ ; 2- アニリノ -5- チアゾリノン、PTH ; 3- フェニル -2- チオヒダントイン
エドマン分解の原理を図 2 に、自動分析処理のフローを図 3 に示す。本システムでは、フェニルイソチオシアネート(PITC)、N 末端部のアミノ基とカップリングするための塩基性雰囲気下を作り出すために用いるトリメチルアミン(TMA)、およびペプチド結合を切断するためのトリフルオロ酢酸を気相状態でリアクタに供給し、サンプルへのダメージ、副反応の軽減を可能にしている。
エドマン分解で得られたアニリノチアゾリノン(ATZ)- アミノ酸の転換反応を行い、安定なフェニルチオヒダントイン(PTH)- アミノ酸を生成させ、HPLC で同定する。PTH- アミノ酸の同定は、移動相をリサイクルするイソクラティック溶離とし、各 PTH-アミノ酸の安定した溶出時間、低ランニングコストを実現した。
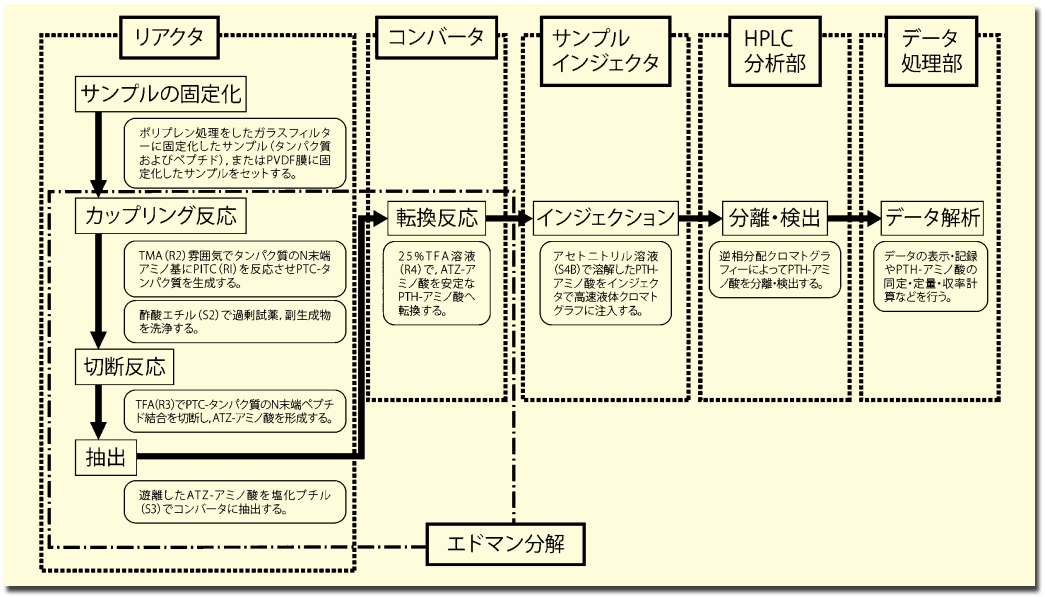
図3.アミノ酸配列分析のフローチャート
PITC ; フェニルイソチオシアネート、TMA ; トリメチルアミン、TFA ; トリフルオロ酢酸、PTC ; フェニルチオカルバミル、PVDF ; ポリフッ化ビニリデン島津製作所プロテインシーケンサは、初代モデル PSQ-1 から始まり、コストダウンの実施、分析部の改良に取り組み、1996 年に発売した PPSQ-20 シリーズでは、エドマン分解を行うシーケンサ本体の設計を一新し、本体の小型化、複数のリアクタの搭載、ワークステーションでの制御を可能にした。さらに、分析部およびデータ処理ソフトウエアの開発を行い、PPSQ-30 シリーズ、PPSQ-50 シリーズへと進化してきた。
PTH-アミノ酸のグラジエント分離
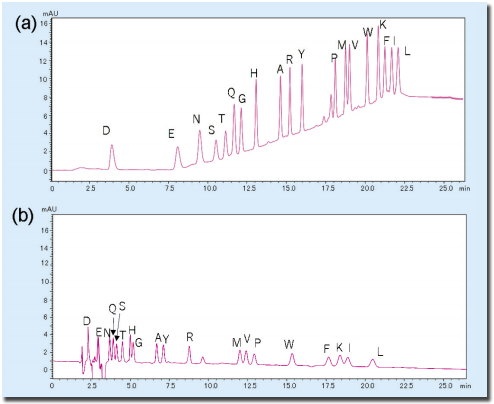
図4.PTH- アミノ酸標準混合品の分析(2 pmol)
(a)グラジエントシステム、(b)イソクラティックシステムPPSQ-50 では、エドマン分解終了後に分析カラムに注入するサンプル容量は 50μL である。この点を変更することなくグラジエント溶離を行うために、セミミクロカラムを用いている。移動相には、A 液に、酢酸緩衝液/アセトニトリル、B 液に、酢酸緩衝液/メタノール/2- プロパノールを使用した。
PTH- アミノ酸標準混合品 2 pmol のグラジエント溶離によるクロマトグラムを図 4(a)に、イソクラティック溶離によるクロマトグラムを図 4(b)に示す。PTH- アミノ酸が溶出される順番は若干異なるが、グラジエント溶離で得られるPTH-アミノ酸のピークの高さは、イソクラティック溶離よりも、全体的に 3 〜 5 倍程度高く検出された。
プロテインシーケンサは、当該サイクルとその前サイクルとのPTH-アミノ酸ピークの増減を比較し、特異的に検出されているPTH- アミノ酸の同定を行う。
イソクラティック溶離は、移動相の組成が一定のため、遅い溶出時間の疎水性アミノ酸はピークの高さが低くなる。一方、グラジエント溶離では、分析時間が経つにつれ、溶出力の高い移動相 B の濃度が高くなるため、疎水性の高い PTH-アミノ酸の分離が改善される(図 4 a)。
グラジエント溶離では、500 fmol のPTH-アミノ酸の分離および検出も可能となり(図 5)、微量のサンプルをプロテインシーケンサで分析を行う場合でも、特異的に増加しているPTH-アミノ酸を容易に検出することが可能となった。
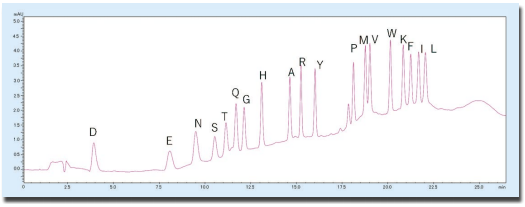
図5.PTH- アミノ酸標準混合品の分析(500 fmol)
バックグラウンドの軽減
クロマトグラム上に現れるバックグラウンドは、主にエドマン分解の副生成物であるジメチルフェニルチオウレア(DMPTU)、ジフェニルチオウレア(DPTU)とジフェニルウレア(DPU)、および、エドマン試薬に含まれている物質が挙げられる。これらは、カップリング試薬であるPITCと塩基性雰囲気下をつくるTMA から生成される。
サンプルが微量になると、この副生成物であるDMPTU のピークが PTHHis のピークの検出を妨害し、同定することが困難になる。また、転換反応に用いる25 %トリフルオロ酢酸の中に含有されている試薬の酸化防止剤、ジチオスレイトール(DTT)のピークは 4.1 分付近に検出され、PTH-Asp の検出を妨げる。
これらの問題点を解決するために、塩基性雰囲気下を作る試薬をTMA からNメチルピペリジンに、さらに DTTを含まない 25 %トリフルオロ酢酸を採用した。その結果、微量分析におけるPTH-Asp および PTH-His の検出の問題、さらにクロマトグラム全体のベースラインの軽減を実現できた(図 6)。
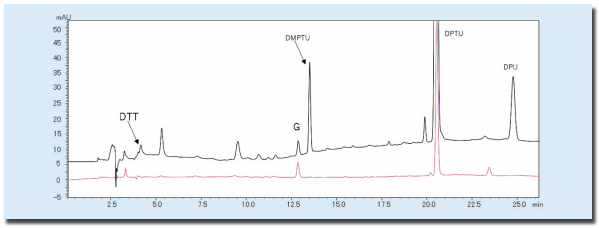
図6.改良試薬を用いた 1 サイクル目のクロマトグラム(ウマミオグロビン 10 pmol)
黒色;既存エドマン試薬、赤色;改良エドマン試薬微量サンプルのシーケンス分析
ウマミオグロビン(SIGMA cat#A8673)5 pmol のアミノ酸配列結果を図 7 に示す。すべてのサイクルとも生クロマトグラムを表示している。生クロマトグラムでは、特異的に増加しているPTH- アミノ酸だけでなく、エドマン分解で生成される副反応物も検出され、PTH-アミノ酸の同定が容易ではない場合がある。その場合には、差クロマトグラム表示にすることで、バックグラウンドとして前のサイクルに検出されているPTH-アミノ酸および副反応物を取り除くことができ、特異的に増加しているPTH-アミノ酸を容易に確認することが可能となる。
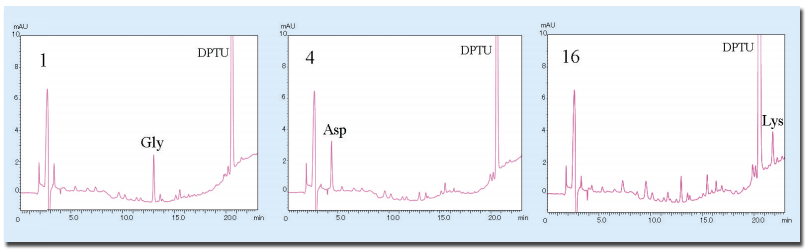
図7.ウマミオグロビン(5 pmol)のアミノ酸配列分析
クロマトグラム左上の数字はサイクル数を示す。さらに、本グラジエントシステムでは、ソフトウエアにクロマトグラムを上下移動させる新しい機能を搭載した。同定したいクロマトグラムとその前のクロマトグラムを重ね合わせて、特異的に増加しているピークを容易に探すことができる。
システイン含有サンプルについて
タンパク質の三次元構造の形成に関与する要因の一つに、分子内のシステインによるジスルフィド結合の分子内架橋がある。ジスルフィド結合は、タンパク質の立体構造を安定にするという働きがあると考えられており、タンパク質の一次構造解析において、システインの位置を同定することが重要とされている。
ジスルフィド結合が形成されているタンパク質をそのままアミノ酸配列分析を行うと、N 末端側の半シスチン残基は、エドマン分解によりATZ半シスチンに変換された後も、C 末端側の半シスチンとジスルフィド結合を有しているため溶出されず、特異的に増加するピークを検出することができない。そのため、アミノ酸配列分析では、分析前に前処理としてシスチンの還元アルキル化を行うことが一般的である。
本システムでは、従来のプロテインシーケンサと同様に還元アルキル化としてピリジルエチル化を推奨している。ピリジルエチル化されたシステインは、他の PTH-アミノ酸、エドマン分解の副生成物の溶出位置と異なり、容易に同定することが可能である。
むすび
プロテインシーケンサによるタンパク質のアミノ酸配列分析は、操作性が優れていることから広く普及してきた。最近のPPSQを利用した応用例では、32P 標識とプロテインシーケンサを用い、リン酸化部位を決定した報告もある6)。近年では質量分析装置の技術的な進化とプロテインデータベースの充実化に伴い、タンパク質の高感度アミノ酸配列解析が可能となりつつある。
著者らは、2015 年に検出部に高感度フローセルを搭載し、分析・制御部ソフトウエアを一新し、FDA21 CFR Part 11 にも対応できるPPSQ-50イソクラティックシステムを発売した。今回、グラジエント溶離を用い、より高感度分析が可能なPPSQ-50グラジエントシステムを開発した。
プロテインシーケンサの高感度化を実現できたことにより、質量分析装置を利用したアミノ酸配列分析のさまざまな問題点を補うことが可能であると考えている。質量分析装置およびプロテインシーケンサを補完的に利用することにより、タンパク質の一次構造解析のさらなる発展を期待している。
最後に、本共同開発は、試薬開発を富士フイルム和光純薬株式会社、装置開発を株式会社島津製作所の担当で実施された。
PPSQは株式会社島津製作所の商標です。本書に記載されている会社名、製品名/サービスマークおよびロゴは、株式会社島津製作所、その関連会社または各社の商標および登録商標です。
参考文献
- Nakazawa, T. et al. : Proteomics, 8, 673-685 (2008). DOI: 10.1002/pmic.200700084
- Yamaguchi, M. et al. : Rapid Commun. Mass Spectrom., 22, 3313-3319 (2008). DOI: 10.1002/rcm.3735
- Edman, P. et al. : Acta Chem. Scand., 4, 283-293 (1950). DOI: 10.3891/acta.chem.scand.04-0283
- 上田 昭 他:島津評論,46 (4), 207-215 (1989).
- Kazlauskaite, A. et al. : Biochem. J., 460, 127-139 (2014). DOI: 10.1042/BJ20140334




