【総説】エクソソームによる腫瘍悪性化機構
本記事は、和光純薬時報 Vol.85 No.3(2017年7月号)において、東海大学総合医学研究所造血腫瘍分野 東海大学医学部血液腫瘍内科 樋口 廣士先生、幸谷 愛先生に執筆いただいたものです。
はじめに
腫瘍の形成・悪性化の過程では、腫瘍細胞同士だけでなく、腫瘍細胞と正常細胞から構成される微小環境との、相互作用が必要である。例えば、多くの腫瘍組織には正常な免疫細胞が浸潤することが古くから観察されており、慢性炎症が腫瘍発生のリスクを増加させることは臨床的に認められる。その他にも、線維芽細胞や内皮細胞といった細胞が腫瘍微小環境を構成し、腫瘍細胞の増殖を助長することが報告されている。
腫瘍細胞そのものの根絶を目的とする多くの治療法は、正常細胞への毒性も強く、副作用など身体への負担が極めて大きい。加えて、染色体が不安定な腫瘍細胞は薬剤耐性を獲得しやすく、再発した場合に奏功しないことも大きな問題である。そこで、正常細胞から構成される微小環境を破壊、あるいは適切に制御することで腫瘍の根絶を目指した治療戦略が注目されている1)。
本稿では、細胞外小胞エクソソームを介した腫瘍の転移・悪性化に関連する報告を紹介し、さらに、著者らが対象とするEpstein-Barr ウイルス(EBV)陽性悪性リンパ腫におけるエクソソームの働きについて概説する。
細胞外小胞エクソソームとは
生体内のあらゆる細胞は、直接接触あるいはサイトカイン・ケモカインといった分泌タンパク質を介して、情報を伝達している。近年、このような細胞間の情報伝達を担う新たな因子として、細胞外小胞が注目を集めている。細胞外小胞は、細胞と同様に脂質二重膜から構成され、タンパク質・核酸・脂質などを内包しており、これらの分子が有する包括的な情報を同時に伝達することが可能であると考えられている2)。
エクソソームは、細胞外小胞の中でも直径50 〜200nm 程度の比較的小さな集団であり、多胞体(MVB : multivesicular body) と呼ばれるエンドソームから放出される。従来、エクソソームの分離には、超遠心法や密度勾配遠心法などが用いられてきたが、これらの手法では細胞由来の夾雑物を完全に取り除くことが困難であった。
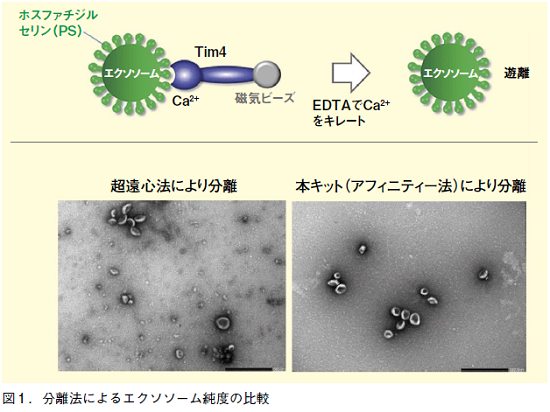
そこで、エクソソーム研究の高まりを受け、エクソソームをより高純度で分離する手法が求められた。著者らは、和光純薬が開発した新しいエクソソーム精製キットを利用して、エクソソームの分離を試みた。この試薬はエクソソーム表面に表出しているホスファチジルセリンに対するアフィニティーを利用してエクソソームを分離する手法である。
従来法である超遠心により分離したエクソソームと、本キットを用いて分離したエクソソームの電子顕微鏡下での観察画像を図1に示した。超遠心法ではエクソソーム以外に多くの夾雑物が混入しているが、本キットを使用することにより純度良くエクソソームを分離することに成功している。今後、このようなアフィニティーを利用した精製法がエクソソーム分離の新たな標準手法となることが期待される。
エクソソームと腫瘍の転移・悪性化
2007 年にエクソソーム中にmiRNAが内包されていることが報告されて以来3)、エクソソームによる生体分子の輸送と、その生物学的意義に関して多くの研究が行われた。特に腫瘍細胞はエクソソームを活発に分泌することや、エクソソーム中には腫瘍特異的な抗原が内包され、それらがエクソソームによって輸送されうる可能性などから、エクソソームは、新しい診断・治療のターゲットとして注目を集めている。本稿では腫瘍由来エクソソームが微小環境に働きかけ、腫瘍転移・悪性化を促すことを示したいくつかの報告を紹介する。
腫瘍は他の組織に転移する際、間質細胞の間を移動して血管に到達する必要がある。このステップにおいてエクソソームは、フィブロネクチンを介した腫瘍細胞の運動性の促進や、プロテアーゼMT1-MMP を介した細胞外マトリックスの分解、血管新生や血管透過性の促進などにより、腫瘍転移を助長することが報告されている4-7)。
また、多くの腫瘍細胞は転移する組織に指向性を持つことが知られているが、エクソソーム表面のインテグリンがその指向性を決定する因子であることが報告されている。この報告中では、αvβ5 インテグリンは肝臓、α6β4・α6β1 インテグリンは肺への指向性を決定することが明らかにされた8)。これらの報告は、腫瘍細胞- 微小環境の複雑なコミュニケーションを、エクソソームを中心として理解する上で極めて重要な報告である。
上記の報告を踏まえた上で、以下の項目では著者らが独自に研究を進めている EBV 陽性リンパ腫におけるエクソソームの役割について概説する。
Epstein-Barr ウイルス(EBV)と悪性リンパ腫
Epstein-Barr ウイルス(EBV) は Burkitt リンパ腫培養細胞から分離された最初のヒトがんウイルスである。感染受容体として CD21 が同定されており、試験管内で容易にB 細胞の形質転換を引き起こす。その際、EBV がコードする LMP(latent membrane protein)や EBNA(EBV nuclear antigen)といった 9 種類の遺伝子が、細胞内シグナルや転写因子の活性を制御することにより、感染細胞の不死化や形質転換を誘導することが知られている。
現在、世界人口の 90% 以上は既に EBV に感染しており、潜伏感染状態であると言われているが、様々な原因で免疫力が低下した場合に、B 細胞性・T/NK 細胞性リンパ腫、稀に上咽頭がんや胃がんなど上皮細胞腫瘍なども引き起こす。一部の B 細胞性リンパ腫では、EBV 陽性の症例の場合、EBV 陰性の症例に比べて既存の治療の効果が得られにくく、予後不良であることが報告されているため、現行の治療法に代わる、EBV 陽性リンパ腫に特異的な新規治療法開発が強く望まれている。著者らは EBV 陽性疾患治療におけるこの様な現状を鑑み、EBV 陽性リンパ腫の発症・悪性化の機序に焦点を当てて、研究を行ってきた。
重要なことに、EBV 陽性リンパ腫組織中には多くの免疫細胞の浸潤が認められ、腫瘍細胞の生存は炎症性微小環境に依存していると考えられている。著者らはこの点に着目し、EBV 陽性リンパ腫由来エクソソームの微小環境への影響、ならびにリンパ腫悪性化を促進する因子として EBV 由来 miRNA の働きを解析している。
EBV 由来miRNA のエクソソームによる輸送
EBV は自身のゲノム上の BART(BamHI-A rightward transcripts)と呼ばれる領域に miRNA をコードしたクラスターを有している。このクラスターには約 40 種類の miRNA がコードされており、BART miRNA と表記されることもあるが、本稿では EBV miRNA と統一する。これら EBV miRNA のリンパ腫発症・悪性化における役割には、大きな議論の余地が残されているのが現状である。例えば、EBV miRNA はアポトーシス抑制などにより、腫瘍の生存を助けるという報告もあれば、EBV の潜伏状態を維持し、腫瘍化を抑制するという報告もある9)。
そのような中、Pegtel らのグループにより、EBV 陽性リンパ腫細胞がエクソソームを分泌しており、その中にEBV miRNA が含まれていることが報告された10)。この報告中で、エクソソームはヒト単球由来樹状細胞(MoDC) に選択的に取り込まれ、EBV miRNA を輸送していることが明らかにされた。この結果から、EBV 陽性リンパ腫由来のエクソソームは、腫瘍組織に浸潤する非腫瘍細胞の活性に何らかの影響を与え、微小環境構築を誘導する可能性が示唆された。
エクソソームのリンパ腫発症への影響
Pegtel らの報告を受け、著者らも同様の実験を試みたところ、リンパ腫由来エクソソームは単球/ マクロファージに選択的に取り込まれることが明らかになった。さらに EBV miRNA を多量に含むエクソソームは、マクロファージにおけるTNFα、IL-10 などの遺伝子発現を促進するという結果が得られた。このような遺伝子発現パターンは腫瘍微小環境に浸潤する TAM (Tumor-associated macrophage) によく似ているため、EBV miRNA を含むエクソソームを取り込んだマクロファージが微小環境を構成する重要な機能を担う可能性が示唆された。
次に、EBV 陽性リンパ腫由来エクソソームが微小環境の構築を促進する可能性を確認するため、著者らは EBV 感染マウスモデルを利用した。本来、EBV はヒトをはじめとした霊長類にしか感染しないが、免疫不全 NOG マウスへヒト臍帯血由来 CD34 陽性造血幹細胞を移植し、その後 EBV 感染によりリンパ腫を発症するマウスモデルが既に確立されている。
このマウスモデルに、野生型 EBV 株(Akata)と EBV miRNA 欠損株(B95-8)を感染させたところ、野生株感染マウスは著しく予後不良であった。ここで、著者らは miRNA 欠損株感染マウスに、miRNA 内包エクソソームの静脈内投与を試みたところ、驚くべきことにリンパ腫の発症が観察され、さらに腫瘍組織中へのマクロファージのおびただしい浸潤が認められた。
最後に、クロドロネートリポソーム投与により、腫瘍中のマクロファージを除去したところ、同時に腫瘍細胞も減少することが見出された。
以上の結果より、EBV 陽性リンパ腫悪性化の過程において、エクソソームはマクロファージを利用して腫瘍細胞に有利な微笑環境を構築することが示唆された。
おわりに
発見された当初、エクソソームは不要なタンパク質や核酸を細胞外に放出するために仕組みであると考えられていた。ところが今や、腫瘍をはじめとした様々な疾患の診断・治療のターゲットとして注目を集めている。本稿では、特に腫瘍由来エクソソームの機能に関わるいくつかの報告を紹介したが、エクソソームはあらゆる生命現象に関与すると思われる。
多くの研究によりエクソソームの生物学的意義が明らかにされつつあるが、その機能の詳細には未解明の部分も多く残されている。著者らの研究が今後のエクソソーム研究の一助となることを願う。
参考文献
- Quail, D. F. and Joyce, J. A. : Nat. Med., 19(11), 1423 (2013). DOI: 10.1038/nm.3394
- Tkach, M. and Thery, C. : Cell, 164, 1226 (2016). DOI: 10.1016/j.cell.2016.01.043
- Valadi, H. et al. : Nat. Cell Biol., 9(6), 654 (2007). DOI: 10.1038/ncb1596
- Sung, B. H. et al. : Nat. Commun., 6, 7164 (2015). DOI: 10.1038/ncomms8164
- Hoshino, D. et al. : Cell Rep., 5, 1159 (2013). DOI: 10.1016/j.celrep.2013.10.050
- Kosaka, N. et al. : J. Biol. Chem., 285 (23), 17442 (2010). DOI: 10.1074/jbc.M110.107821
- Zhou, W. et al. : Cancer Cell, 25, 501 (2014). DOI: 10.1016/j.ccr.2014.03.007
- Hoshino, A. et al. : Nature, 527, 329 (2015). DOI: 10.1038/nature15756
- Ok, C. Y. et al. : Blood, 122(3), 328 (2013). DOI: 10.1182/blood-2013-03-489708
- Pegtel, D. M. et al. : PNAS, 107 (14), 6328 (2010). DOI: 10.1073/pnas.0914843107















