MagCapture™ Exosome Isolation Kit PS Ver.2
ホスファチジルセリンとTim4 を用いた新規エクソソーム精製法:PSアフィニティー法
エクソソーム膜は分泌細胞由来のタンパク質や脂質を含んでいますが、その中でもホスファチジルセリン (PS) は生細胞ではフリッパーゼという酵素の働きによって細胞膜の内側に配向しているのに対して、エクソソームでは膜の外側にも露出していることが知られています3)。また、マクロファージによるアポトーシス細胞の貪食受容体として知られる T-cell immunoglobulin domain and mucin domain-containing protein 4(Tim4)タンパク質は、細胞外領域にある IgV ドメインを介してカルシウムイオン依存的に PS と結合することがわかっています4)。
以上の知見をもとに、当社はTim4 を固相化した磁気ビーズを用い、カルシウムイオン存在下で培養上清や血清などのサンプル中のエクソソームを捕捉し、キレート剤を添加することによってエクソソームを精製することができる、既存の手法とは一線を画す新たなエクソソーム精製法を金沢大学医学系免疫学の華山教授と共同で開発し、キット化に成功しました5)。
エクソソーム精製キット「MagCapture™ Exosome Isolation Kit PS Ver.2」は、従来のエクソソーム精製法よりも高純度なエクソソームをインタクトな状態で簡便に精製することを実現しており、これまでゴールドスタンダードとされてきた超遠心法に置き換わる新たなエクソソーム精製法です。
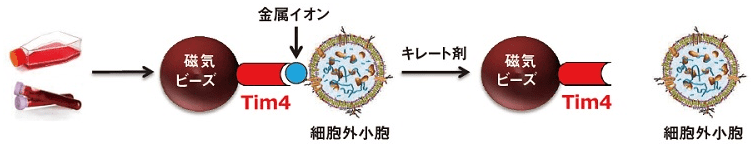
PSアフィニティー法による細胞外小胞/エクソソームの抽出・単離
-
新規アフィニティー精製法採用
- PSアフィニティー分子による回収※
- 低バックグラウンド
- キレート剤により中性条件下でマイルドに溶出

高純度・インタクトエクソソームを単離
-
超遠心分離不要
- マグネティックビーズによる操作性アップ
- 最適化されたプロトコール

高い実験再現性
他の精製方法との比較
| 方法 | 純度 | エクソソーム回収量 | インタクト粒子の取得 | 総タンパク量 |
|---|---|---|---|---|
| MagCapture™ (PSアフィニティー法) | ■ ■ ■ ■ | ■ ■ ■ | ○ | ■ |
| 超遠心分離法 | ■ ■ | ■ ■ | ○ | ■ ■ ■ |
| ポリマー沈殿法 | ■ | ■ ■ | ○ | ■ ■ ■ ■ |
| 密度勾配遠心分離法 | ■ ■ ■ | ■ | ○ | ■ ■ |
| サイズ分画法 | ■ ■ ■ | ■ ■ | ○ | ■ ■ |
| 表面抗原アフィニティー法 (抗体使用) | ■ ■ ■ | ■ ■ | × | No data |
※本比較表は当社独自調査によるものです。サンプル、検出対象および手法によって結果が変化いたしますので、各方法の性能を保証するものではございません。
MagCapture™ Exosome Isolation Kit PS Ver.2
MagCapture™ Exosome Isolation Kit PS Ver.2:PSアフィニティー法x磁気ビーズ
細胞培養上清、血清、血漿などのサンプルから高純度な細胞外小胞/エクソソームを簡便に精製できます。細胞外小胞の膜表面に存在するホスファチジルセリン(PS)にカルシウム依存的に結合するTim4タンパク質を応用することで、キレート剤によるインタクトな細胞外小胞の精製を実現しました。
特長
- 新規アフィニティー法(PSアフィニティー法)により高純度な細胞外小胞が取得可能
- 従来の超遠心分離法よりも高い収量で高純度なエクソソームが取得可能
- インタクトな細胞外小胞が取得でき、様々なアプリケーションに利用可能
- 磁気ビーズによる簡便操作
操作フロー
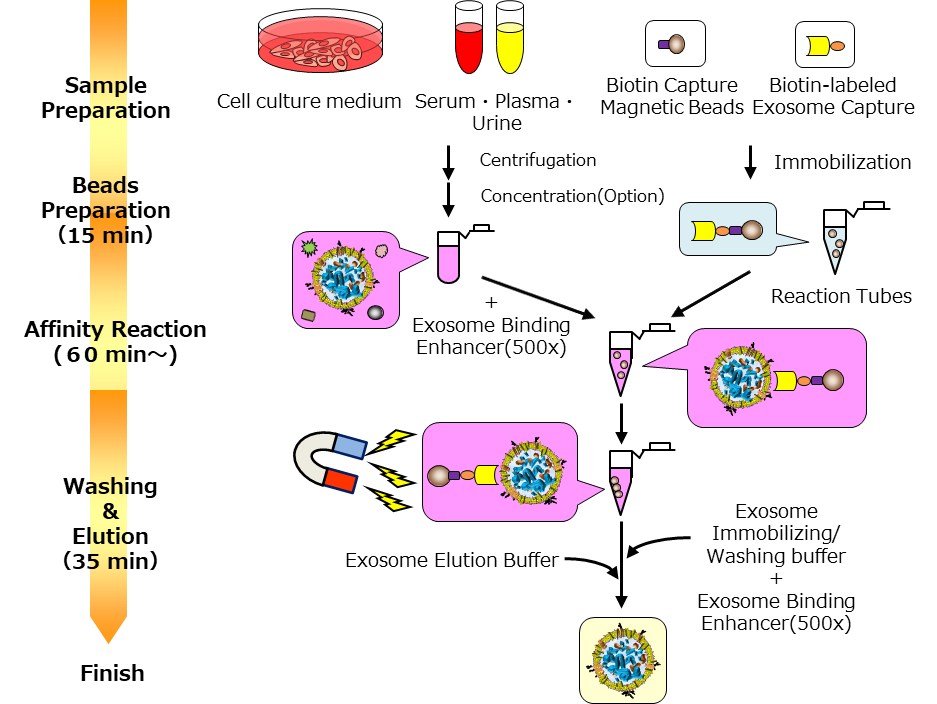
キット構成
| 2回用 | 10回用 | |
| Biotin Capture Magnetic Beads | 120 μL | 600 μL |
| Biotin-labeled Exosome Capture | 20 μL | 100 μL |
| Exosome Immobilizing / Washing Buffer (10×) | 5 mL | 25 mL |
| Exosome Binding Enhancer (500×) | 300 μL | 1500 μL |
| Exosome Elution Buffer (10×) | 300 μL | 1500 μL |
| Reaction Tubes | 4本 | 22本 |
PSアフィニティー法のアプリケーションデータ集
PSアフィニティー法で抽出・精製したエクソソームのアプリケーションデータです。
- 培養上清サンプルから精製した細胞外小胞の解析
- 血清・尿サンプルから精製した細胞外小胞の解析
- 従来の沈殿法と性能比較実験
- 健常ヒト血清由来エクソソームからのmiRNAおよびmRNAの回収量比較
- エクソソームのプロテオミクス解析
- Protein Assay BCA Kitを用いたエクソソームのタンパク質濃度定量
- エクソソームの標識とHeLa細胞への取り込み実験
1. 培養上清サンプルから精製した細胞外小胞の解析
PSアフィニティー法と超遠心分離法で単離したエクソソームを透過型顕微鏡を用いて、電子顕微鏡解析を行った。

①本キットで精製したサンプル
サンプル:COLO201 細胞培養上清10 mL
粒子数:3.69 x 1010 particles/mL
②超遠心分離法で精製したサンプル
サンプル:COLO201 細胞培養上清10 mL
粒子数:1.68 x 1010 particles/mL
PSアフィニティー法で単離したエクソソームは、超遠心分離法で単離したエクソソームと比べ、約100 nmの小胞をより多く観察でき、夾雑物が少なかった。
2. 血清・尿サンプルから精製した細胞外小胞の解析
ヒト血清から単離したエクソソームの収量比較
ヒト血清サンプル 1mL から本キット、超遠心分離法および表面抗原に対する抗体アフィニティー法によりエクソソームを回収し、ウェスタンブロット (抗CD9抗体、抗CD63抗体) により検出を行った。
 |
レーン1:超遠心分離法 レーン2:PSアフィニティー法 レーン3:A社 Exosome抽出キット (CD9) レーン4:A社 Exosome抽出キット (CD63) レーン5:A社 Exosome抽出キット (CD81) レーン6:A社 Exosome抽出キット (CD9, CD63, CD81, EpCAM抗体ビーズ混合) |
WBのデータについて各サンプル結果は、150 μLの血清サンプルに相当します。抽出物 (100 μL) から15 μL抜き取り、4 x SDSサンプルバッファーを5 μL添加し、全量アプライしました。 |
PSアフィニティー法は、超遠心分離や抗体を用いたアフィニティー法よりもエクソソームの回収率が高い
ヒト尿サンプルから単離したエクソソームの収量比較
ヒト尿サンプル 1 mL から本キット、ポリマー沈殿法、超遠心分離法によりエクソソームを回収し、ウェスタンブロット (抗 CD9 抗体) により検出を行った。
マーカータンパク質回収量比較
 |
レーン1:ポリマー沈殿法 レーン2:超遠心分離法 レーン3:PS アフィニティー法 |
検出抗体抗 CD9 ウサギポリクローナル抗体 (System Biosciences 社)使用サンプル量各 1 mLWB のデータについて各サンプル結果は、150 µL の尿サンプルに相当します。抽出物 (100 µL) から 15 µL 抜き取り、4 x SDS サンプルバッファーを5 µL 添加し、全量アプライしました。 |
粒子径比較
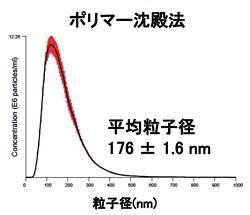 |
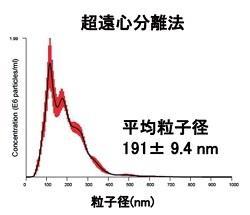 |
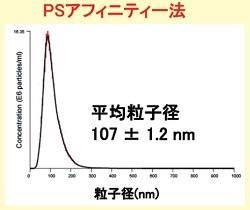 |
||
Size DistributionMean: 176 +/- 1.6 nmMode: 117 +/- 4.5 nm SD: 96 +/- 5.8 nm |
Size DistributionMean: 191 +/- 9.4 nmMode: 113 +/- 2.8 nm SD: 88 +/- 7.4 nm |
Size DistributionMean: 107 +/- 1.2 nmMode: 86 +/- 1.2 nm SD: 42 +/- 1.0 nm |
尿サンプルからもエクソソームを高純度に回収することができた
3. 従来の沈殿法と性能比較実験
K562 (ヒト慢性骨髄性白血病) 細胞培養上清 (無血清培地または10%Exosome-depleted FBS添加培地) から本キット、超遠心分離法およびポリマー沈殿法を用いてエクソソームを回収し、回収量および純度を比較した。
PSアフィニティー法
遠心分離 (10,000 x g, 30分間) 前処理したK562細胞培養上清 (無血清培地または10%Exosome-depleted FBS添加培地) 1 mLからキットプロトコール (反応時間:3時間) に従ってエクソソームを回収した。
超遠心分離法
遠心分離 (10,000 x g, 30分間) 前処理したK562細胞培養上清サンプル (無血清培地または10%Exosome-depleted FBS添加培地) 10 mLから超遠心分離 (110,000 x g, 70分間) し、沈殿をTBSで懸濁後、再び超遠心分離 (110,000 x g, 70分間) した沈殿画分を回収した。
ポリマー沈殿法
遠心分離 (10,000 x g, 30分間) 前処理したK562細胞培養上清 (無血清培地または10%Exosome-depleted FBS添加培地) 1 mLから市販のA社製品を用いて製品プロトコール (静置時間:終夜) に従いエクソソームを回収した。
取得エクソソームの電子顕微鏡解析およびNTA (ナノサイト) 比較
K562細胞培養上清サンプル (無血清培地) から本キット、超遠心分離法、ポリマー沈殿法によって回収したエクソソーム画分の粒子径をナノサイトLM-10を用いて測定した。また、回収したエクソソーム画分 (2~4 x 1010particles) を終濃度2%パラホルムアルデヒドで固定化し、電子顕微鏡にて解析した。
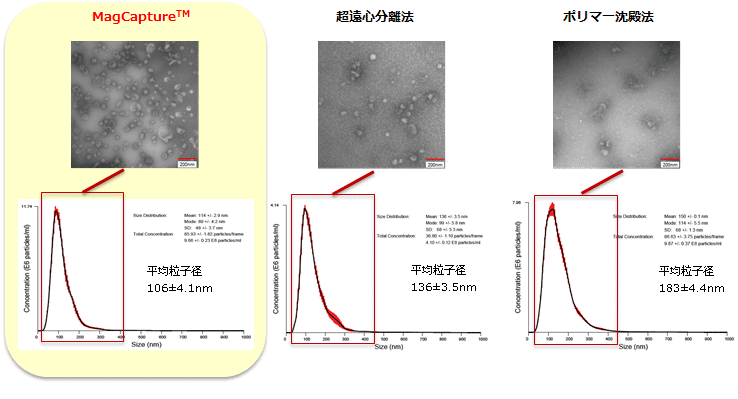
電子顕微鏡画像 データ提供元:金沢大学 医学系 華山教授、大阪大学 iFReC 中井先生
MagCapture™(PSアフィニティー法)は100 nm前後の粒子が回収でき、電子顕微鏡でも多くの細胞外小胞が確認できた
K562細胞培養上清 (無血清培地) からの回収量と純度の比較
K562細胞培養上清 (無血清培地) から本キット、超遠心分離法、ポリマー沈殿法でエクソソームを単離した。単離したエクソソームを電気泳動した後、銀染色およびウエスタンブロット (抗CD63抗体、抗Flotillin-2抗体、抗Lamp-1抗体) により検出した。
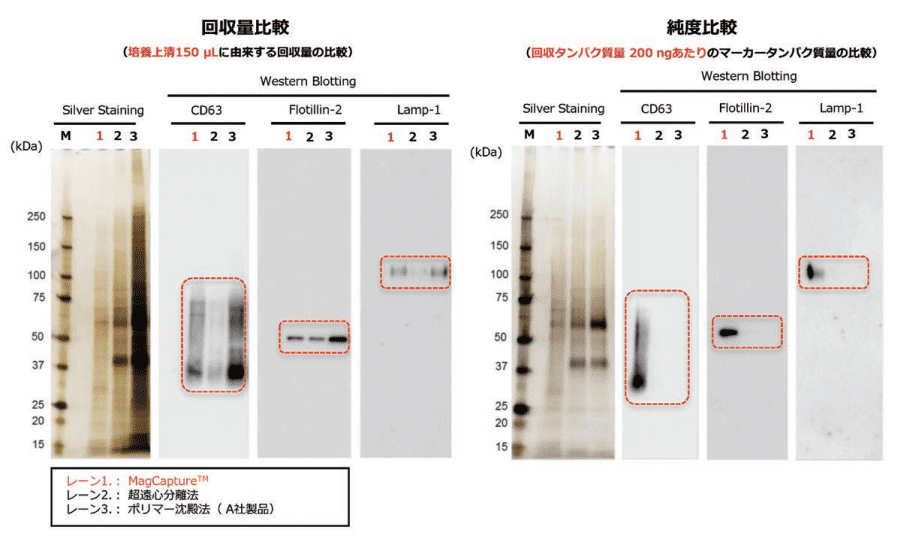
銀染色結果では、MagCapture™(PSアフィニティー法)と比べて超遠心分離法とポリマー沈殿法の方が多くのエクソソームを単離できているように見える。しかし、ウエスタンブロットでは本キットのみエクソソームマーカータンパク質のバンドを検出できた。
このことから、本キットが最も高純度にエクソソームを単離できていることがわかった。
K562細胞培養上清 (10%FBS添加培地) からの回収量と純度の比較
K562細胞培養上清 (10%Exosome-depleted FBS添加培地) から本キット、超遠心分離法、ポリマー沈殿法で回収したサンプルを電気泳動した後、銀染色およびウェスタンブロット (抗CD63抗体、抗Lamp-1抗体、抗Flotillin-2抗体) により検出を行った。また、各回収画分をMS解析し、同定した全ペプチドのうちK562細胞に由来するヒトペプチドの割合を比較した (培地に添加したFBSに由来するウシタンパク質凝集体が混入するほど、ヒト由来ペプチドの割合は低下する)。
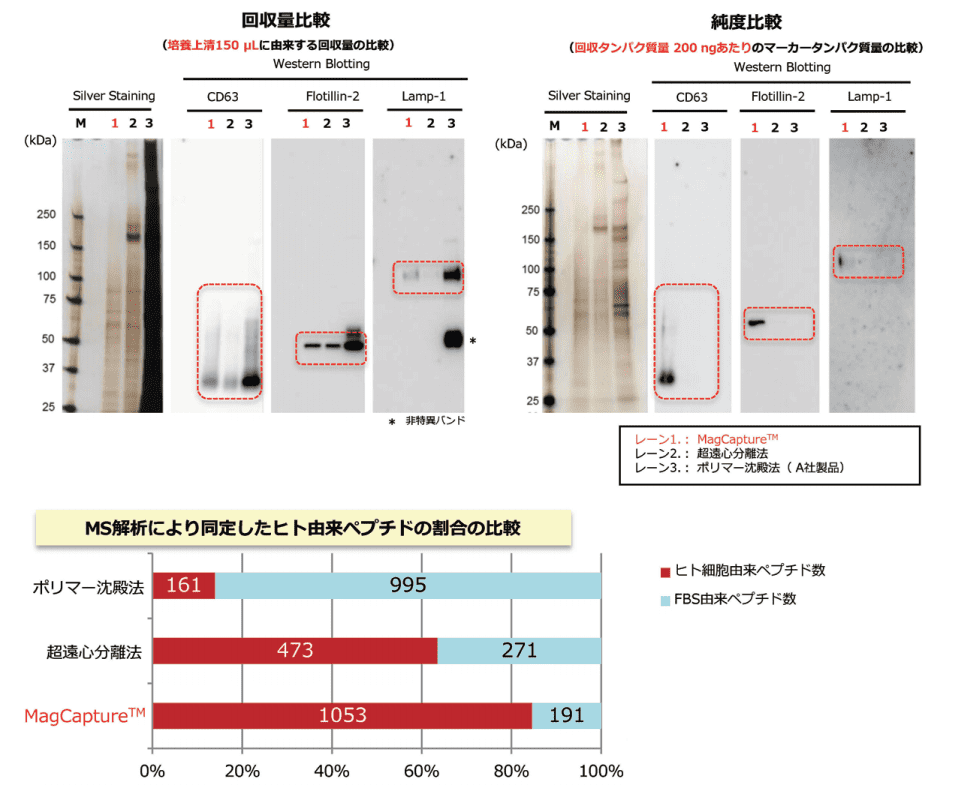
MS解析 データ提供元:金沢大学 医学系 華山教授、大阪大学 iFReC 中井先生
MagCapture™(PSアフィニティー法)は、FBS 添加培地からも高純度なエクソソームが回収できるため低いバックグラウンドで MS 解析が可能
4. 健常ヒト血清由来エクソソームからのmiRNAおよびmRNAの回収量比較
各手法で調製したエクソソームからのmicroRNAおよびmRNAの回収量比較
超遠心分離法とPSアフィニティー法で健常ヒト血清サンプルからエクソソームを単離した後、microRNA Extractor® SP Kit (コードNo.:295-71701) を用いてRNAを回収し、定量PCR法によりmicroRNA量 (let-7a, muR-16, miR-92a, miR-142-3p) およびmRNA量 (GAPDH, PIK3CB) をCt値で比較した。
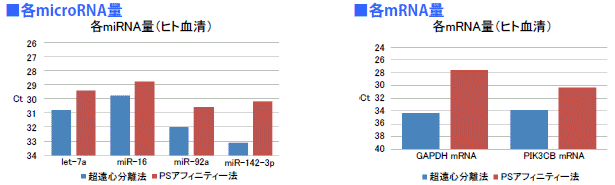
超遠心分離法よりPSアフィニティー法で回収したエクソソームの方が効率良くmicroRNAおよびmRNAを回収できた。
PSアフィニティー画分からのRNA抽出法の比較
PSアフィニティー法によって健常ヒト血清サンプルからエクソソームを単離した後、microRNA Extractor SP® Kit (コードNo.:295-71701)、またはAGPC法によってRNAを回収し、定量PCR法によりmicroRNA量 (let-7a, muR-16, miR-92a, miR-142-3p) とmRNA量 (GAPDH, PIK3CB) をCt値で比較した。
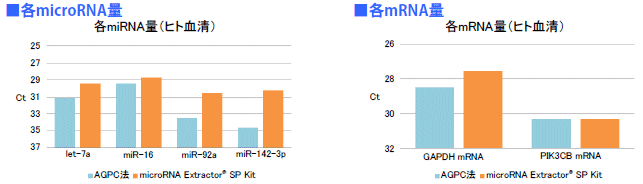
AGPC法よりmicroRNA Extractor® SP Kitを用いることでエクソソームから効率良くmicroRNAおよびmRNAを回収できた。
5. エクソソームのプロテオミクス解析
実験内容および結果
PSアフィニティー法、超遠心分離法、ポリマー沈殿法を用いて、K562 細胞培養上清 (10% Exosome-depleted FBS 添加培地) からエクソソームを精製した。精製したサンプルを 10% ポリアクリルアミド電気泳動で分離し、タンパク質バンド全体を切り出した。その後、ゲル内消化を行い、LC-MS でタンパク質を同定した。また、各手法で精製したエクソソーム (n=3) における同定タンパク質の pair-wise 相関の比較も行った。
同定したタンパク質の含有量トップ 10 比較
白カラム:エクソソーム由来ヒトタンパク質
灰色カラム:ウシ血清由来ウシタンパク質
赤字:エクソソームマーカータンパク質
サンプル:K562 細胞培養上清 (エクソソーム除去済み 10% FBS 添加培地)
| PS アフィニティー法 | 超遠心分離法 | ポリマー沈殿法 | |
|---|---|---|---|
| 1 | Heat shock cognate 71 kDa Protein | DNA-dependent protein kinase catalytic subunit | Complement C3 |
| 2 | Annexin A6 | Transferrin receptor protein 1 | Alpha-2-macroglobulin |
| 3 | Transferrin receptor protein 1 | Serum albumin | Fibronectin |
| 4 | V-type proton ATPase catalytic subunit A | ATP-dependent RNA helicase A | Serum albumin |
| 5 | Flotiillin-2 | Tubulin beta-5 chain | Thrombospondin-1 |
| 6 | Programmed cell death 6-interacting protein | Heat shock cognate 71 kDa protein | Complement C4 |
| 7 | 4F2 cell-surface antigen heavy chain | Fatty acid synthase | Alpha-1-antiproteinase |
| 8 | Annexin A1 | 4F2 cell-surface antigen heavy chain | Apolipoprotein B-100 |
| 9 | Kinase D-interacting substrate of 220 kDa | U5 small nuclear ribonucleoprotein helicase | Hemoglobin fetal subunit beta |
| 10 | Annexin A2 | Tubulin beta-4B chain | Tubulin beta-5 chain |
ポリマー沈殿法ではウシ血清由来タンパク質が多く混入しているのに対し、PS アフィニティー法ではエクソソームマーカータンパク質を多く同定できた
Pair-wise 相関を比較
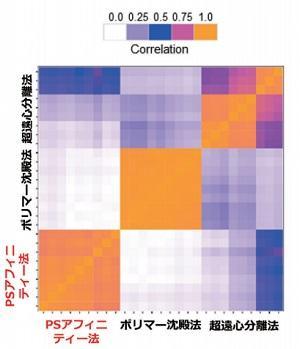
サンプル:K562 細胞培養上清 (10% Exosome-depleted FBS 添加培地)
| 再現性 | |
|---|---|
| 超遠心分離法 | △ |
| ポリマー沈殿法 | ○ |
| PSアフィニティー法 | ○ |
同じ手法間の相関性を確認したところ、ポリマー沈殿法とPSアフィニティー法は相関性が高く超遠心分離法は少し相関性が低いことが分かった。
各手法間の相関性は低い結果となった。→抽出・精製手法によって回収されるエクソソームの集団が異なる可能性が示唆された。
6. Protein Assay BCA Kitを用いたエクソソームのタンパク質濃度定量
Protein Assay BCA Kit は、溶液中のタンパク質濃度をビシンコニン酸 (BCA) を用いて定量するキットで、タンパク質定量法の中でも最も汎用されています。原理は、塩基性条件下でタンパク質が Cu2+ を Cu+ に還元することに基づいています。Cu+ が BCA と錯体を形成すると紫色のキレートが生じ、タンパク質濃度に依存して紫色が濃くなるため、この紫色を 562 nm の吸光度で測定、標準曲線と比較することで溶液中のタンパク質濃度を定量します。
MagCapture™(PSアフィニティー法)を用いて細胞培養上清から精製したエクソソームのタンパク質濃度を、Protein Assay BCA Kit の高感度プロトコールにより測定しました。
実験内容および結果
96 ウェルプレート上にMagCapture™(PSアフィニティー法)で精製したエクソソーム溶液 25 μL を分注し、Protein Assay BCA Kit 付属の試薬 A と試薬 B の混合液を 200 µL 添加した。その後、60℃で 30 分間インキュベーションし、560 nm の吸光度を測定した (図 1)。この結果から、Protein Assay BCA Kit の高感度プロトコールで、精製エクソソームのタンパク質濃度を測定できることが示された。
BCA Assay プロトコール概要
エクソソームのタンパク質濃度はかなり薄いため、BCA 測定の場合はサンプルを希釈せず実施してください。
- スタンダード BSA 溶液 250、125、62.5、31.25、15.625 µg/mL およびスタンダード BLANK を 25 μL ずつ 96 ウェルプレートに添加する。
- エクソソーム精製品および Elution Buffer(BLANK) を 25 µL ずつ 96 ウェルプレートに添加する。
- Protein Assay BCA Kit (コードNo.:297-73101) の試薬 A と試薬 B の混合液 (A:B=50:1) を上記1. および2. に 200 µLずつ 添加する。
- 60 ℃で 30 分間インキュベートする。
- 室温でプレートを冷ます。
- 吸光度 560 nm を測定する。
7. エクソソームの標識とHeLa細胞への取り込み実験
実験概要
MagCapture™(PSアフィニティー法)で精製したエクソソームを PKH67 (Sigma 社)で標識し、HeLa 細胞への取り込み能を確認した。
PKH67 を用いたエクソソーム標識
- MagCapture™(PSアフィニティー法)でエクソソームを精製する。(実験当日に COLO201 細胞培養上清からエクソソームを精製。)
* 工程6-7 のゲル濾過処理時において、標識サンプルの吸着ロスを抑制したい場合は、キット添付の溶出液にEV-Save™ Extracellular Vesicle Blocking Reagent を添加してサンプル調製をしてください。 - BCA Assay および NanoSight を用いてサンプルのタンパク質濃度と粒子濃度を測定する。
- 1.5 mL チューブにエクソソームサンプル溶液を分注する。
*今回は、タンパク質量で3 µg 相当のエクソソームを使用しましたが、標識に必要なエクソソーム量は、適宜調節してください。 - 2.0 µL の PKH67 linker を 0.25 mL の DiluentC (PKH67 キット添付) に溶解させる。…4 × Dye solution*
*標識に必要な量を適宜調製してください。 - サンプルに対して 1/3 量の 4 x Dye solution を添加し、混合後に室温で 5-10 分間インキュベーションする。
- Exosome Spin Columns (MW 3000) (Thermo 社 #4484449) を添付プロトコルに沿って PBS で平衡化する。
- 上記平衡化済みカラム*に 100 µL ずつ各サンプルをアプライし、750 x g、2 分間遠心する。
*カラム一本への最大添加量は100 µL のため、サンプル量が100 µL 以上の場合は必要本数用意してください。 - 前日ディッシュに播種しておいたHeLa細胞に溶液を全量添加し、24 時間後に顕微鏡観察およびフローサイトメーター解析を実施する。
*添加するエクソソーム量を適宜調節してください。
-
顕微鏡観察結果
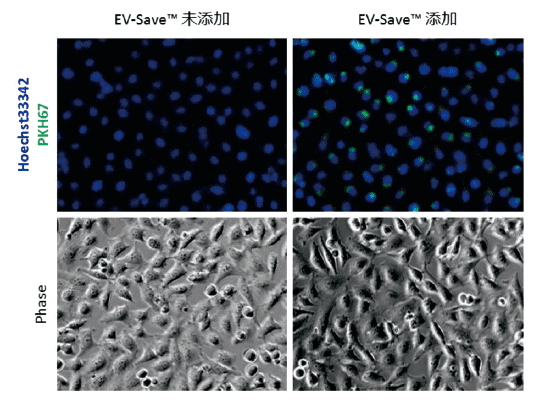
-
フローサイトメーター解析結果
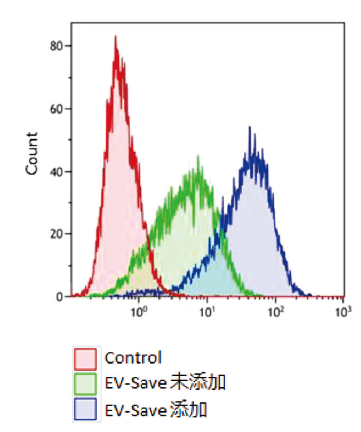
図1.PKH67 標識エクソソームの取り込み確認
MagCapture™(PSアフィニティー法)を用いて単離したCOLO201 由来エクソソームサンプル (総タンパク質量 3 µg、粒子数 1 x 1010個) について、PKH67 Green Fluorescent Cell Linker Kit (Sigma 社) による標識を行った後、HeLa 細胞への取り込みを蛍光顕微鏡 (左) とフローサイトメーター (右) で確認した。
PKH67標識されたエクソソームがエンドサイトーシスで取り込まれていることが、顕微鏡でもフローサイトメーターでも確認できた。また、EV-Save™ Extracellular Vesicle Blocking Reagent を添加したサンプルは、Dye を除去する時のゲルろ過カラムへの吸着ロ スを大きく抑制できている。
各種サンプルの前処理プロトコール
本工程はサンプルの前処理ステップです。エクソソームとその他の細胞外小胞 (マイクロベジクルなど) を回収したい場合は下記プロトコールに従い1,200 x g 遠心分離上清画分※ 1 を調製してください。またエクソソームをより高純度に回収したい場合は下記プロトコールに従い10,000 x g 遠心分離上清画分※ 2 を調製してください。
下記では、細胞培養上清および血清・血漿サンプルを用いる場合の前処理フローを記載しています。その他の体液サンプルを用いる場合は血清・血漿サンプルのプロトコールを参考に、適宜前処理プロトコールをご検討ください。
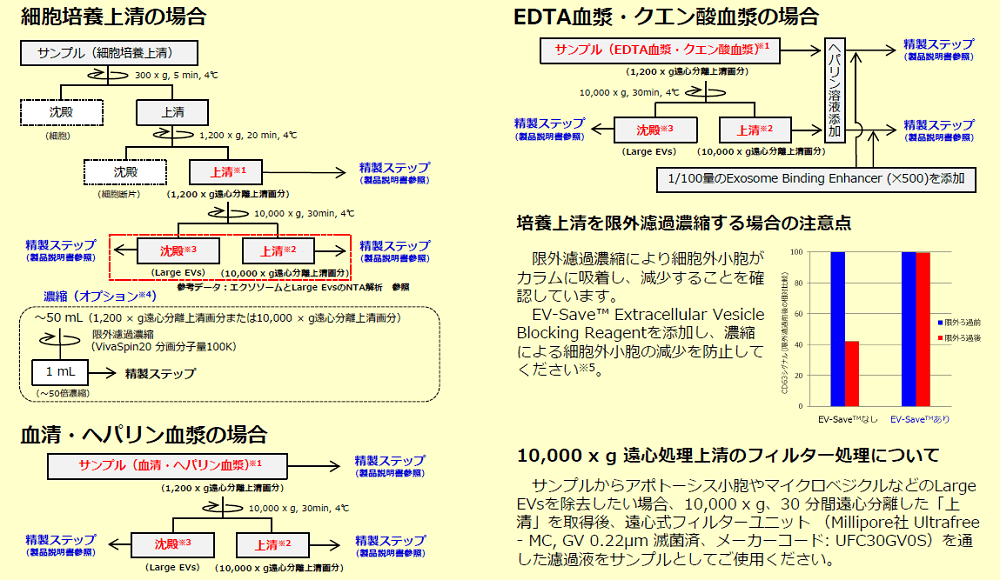
※2 エクソソームを回収したい場合、10,000 x g上清を精製用サンプルとして使用してください。
※3 Large EVsを回収したい場合、10,000 x gで遠心分離して得られる「沈殿」をTBSに懸濁してサンプルとして使用してください。
※4 濃縮ステップは大容量 (~50 mL) の細胞培養上清を精製用サンプルとして使用する場合のオプションですが、回収効率が向上するため、可能な限り実施してください。
※5 EV-Save™はポリマーを含むため、プロテオミクス解析用サンプルへの使用は推奨しません。
多量または少量サンプルの場合の注意点
多量サンプルの場合
大容量 (〜50 mL) の細胞培養上清から精製する場合に濃縮作業をオプションで推奨しています。回収効率が向上するため、可能な限り実施してください。
少量サンプルの場合
サンプル容量が0.5 mL 未満の場合、Exosome Capture 固定化ビーズとサンプルがローテーターにより上手く撹拌できない場合があるため、必要に応じてTBS Bufferを添加してサンプル量を0.5 mL 以上にスケールアップしてください (例:100 〜200 μL → 500 μL)。
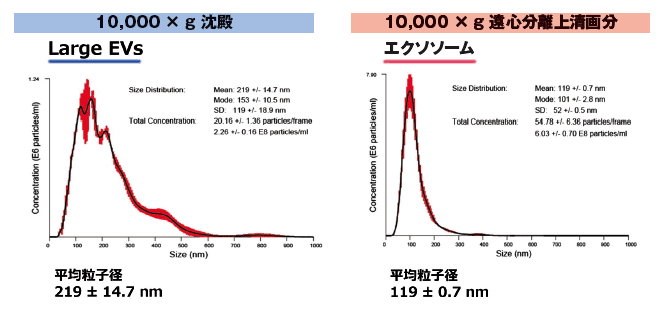
参考データ:エクソソームとLarge EVs のNTA 解析
モネンシンナトリウムでエクソソーム分泌を亢進させたK562 培養上清 1 mL を用意し、そこから10,000 x g 遠心分離上清画分サンプルおよび10,000 x g 沈殿サンプル (TBS 1 mL で懸濁) を調製した。
続いて、両サンプルからMagCapture™ Exosome Isolation Kit PS で細胞外小胞を精製し、NanoSight LM10 により解析した。
Ver.2と旧キットの違い
MagCapture™ Exosome Isolation Kit PS Ver.2(コードNo. 290-84103)は、MagCapture™ Exosome Isolation Kit PS(コードNo. 293-77601;旧キット)の改良版です。
1. エクソソーム回収効率が向上
→同じ操作でより多くのエクソソームを回収!
2. 作業時間の大幅短縮可能
→サンプルとのアフィニティー反応が1時間で完了!(旧キットは3時間)
3. 細胞毒性の改善
→溶出バッファーの細胞毒性を低減!
| キット | MagCapture™ Exosome Isolation Kit PS Ver.2 | (旧キット)MagCapture™ Exosome Isolation Kit PS |
| エクソソーム 回収性能 | 培養上清:■■■■ 血液サンプル:■■■■ |
培養上清:■■■ 血液サンプル:■■■ |
| サンプル反応時間※1 | 1時間以上 | 3時間以上 |
| ビーズ 再利用可能回数※2 |
5回 | 5回 |
| 溶出バッファーの 細胞毒性 |
低い※3 | 細胞種による |
※1 サンプルのボリュームにより反応時間は異なります。
※2 通常使用1回、再利用4回を合計した5回を使用可能回数して設定しています。
抽出するサンプルの由来が異なる場合やコンタミのリスクが予想される場合、新規に調整した磁気ビーズの使用を推奨しています。
※3 溶出サンプルのバッファー交換をすることなく、In VitroやIn Vivoでの投与実験が可能です。
溶出バッファー中のEDTAが問題の場合、バッファー交換が必要となります。
旧キットとVer.2キットの性能比較
- エクソソーム回収率の比較(血清・血漿)
- エクソソーム回収率の比較(間葉系幹細胞(MSC)培養上清)
- 精製エクソソームの細胞毒性試験
1. エクソソーム回収率の比較(血清・血漿)
各種ヒト血液検体において、MagCapture™ Isolation Kit PS Ver.2(コードNo. 290-84103)および旧キットを用いてエクソソーム(EV)を単離・精製した。
その後、得られたEVに対し、
①PS Capture™ Exosome ELISAキットによるEVマーカーの比較
②ウエスタンブロットによるEVマーカーの比較
③ナノサイトを用いた粒子数測定
を行った。なお、溶出条件として、キットに含まれる溶出バッファーを通常のプロトコル通りに希釈した「1x Elution buffer(1xEB)」と5倍希釈で調製した「2xElution buffer(2xEB)」の2通りの条件で比較した。
その結果、Ver.2キットは旧キットと同等以上の性能を示した。特に2×Elution bufferを用いることで血漿サンプルの回収効率が顕著に改善した。
① PS Capture™ Exosome ELISAキットによるEVマーカーの比較
②ウエスタンブロットによるEVマーカーの比較
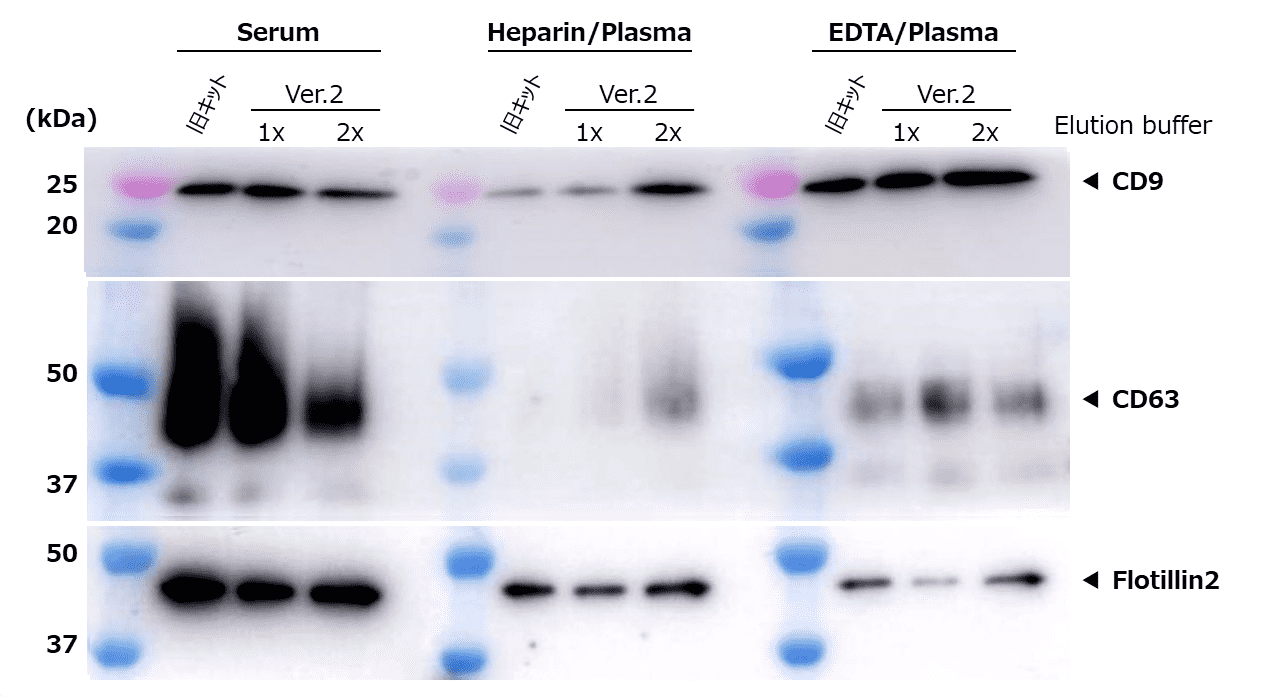
検出抗体:
抗CD9, ラットモノクローナル抗体(77B)[コードNo. 019-28173]
抗CD63, モノクローナル抗体(3-13)[コードNo. 012-27063]
抗Flotillin2,モノクローナル抗体(BD Biosciences)
③ナノサイトを用いた粒子数測定
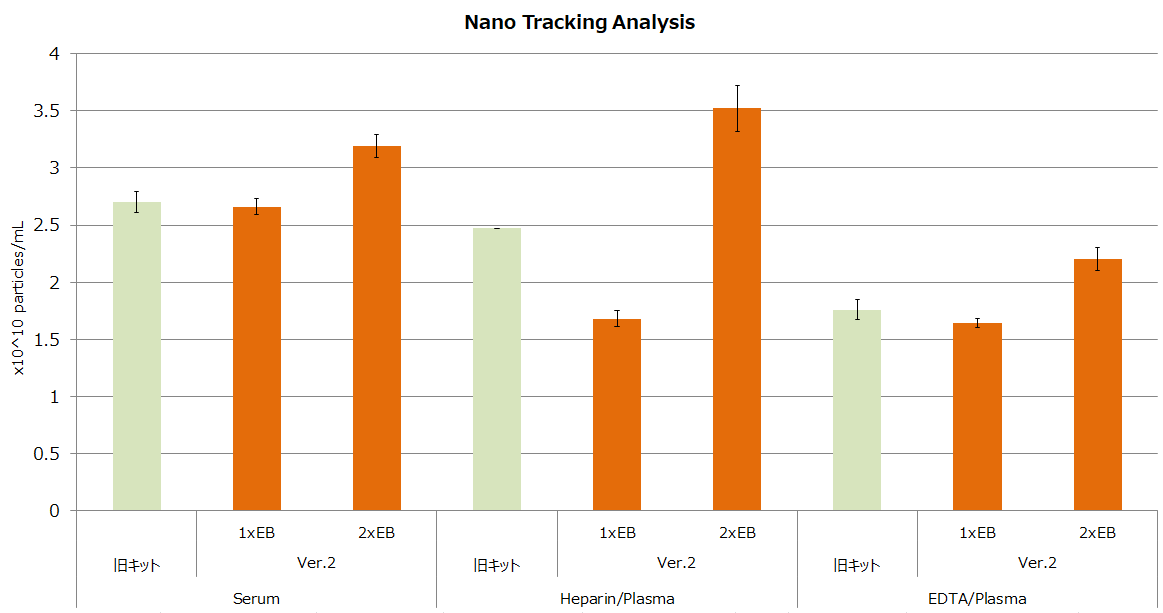
2. エクソソーム回収率の比較(MSC培養上清)
MSC培養上清において、旧キットおよびVer.2キットを用いてEVを単離・精製した。その後、得られたEVサンプルについて、
①PS Capture™ Exosome ELISAキットによるEVマーカーの比較
②ウエスタンブロットによるEVマーカーの比較
③ナノサイトを用いた粒子数測定を行った。
その結果、Ver.2キットは旧キットよりも回収効率が向上することが示された。
① PS Capture™ Exosome ELISAキットによるEVマーカーの比較
②ウエスタンブロットによるEVマーカーの比較
③ナノサイトを用いた粒子数測定
3.精製エクソソームの細胞毒性試験
COLO201細胞培養上清において、旧キットおよびVer.2キットをそれぞれ用いてEV単離・精製を行った後、同量の溶出サンプルとコントロールの溶出バッファーを、予め播種しているヒト正常線維芽細胞へ添加し、48時間経過時点での細胞形態変化を測定した。
旧キットではElution bufferおよび精製エクソソーム添加後48時間経過時点で細胞死が起こるが、Ver.2キットでは顕著な細胞死は観察されなかった。Ver.2キットでは旧キットで問題であった細胞毒性が改善され、Elution bufferを交換することなくIn VitroやIn Vivoでの投与実験が可能※になった。
※ Elution buffer中のEDTAが問題の場合、バッファー交換は必要です。
ライセンスについて
富士フイルム和光純薬株式会社の製品(以下、本品)をご購入後は、研究用途でご使用ください。本品を営利・商業目的にご使用される場合には、弊社お客様相談室(ffwk-labchem-tec@fujifilm.com)までお問い合わせください。
参考文献
- Tkach, M. et al.: Cell., 164(6), 1226-1232 (2016).
Communication by Extracellular Vesicles: Where We Are and Where We Need to Go - Raimondo, F. et al.: Proteomics., 11(4), 709-20 (2011).
Advances in membranous vesicle and exosome proteomics improving biological understanding and biomarker discovery - Trajkovic,K. et al.: Science., 319(5867), 1244-7 (2008).
Ceramide triggers budding of exosome vesicles into multivesicular endosomes - Miyanishi, M. et al.: Nature., 450(7168) , 435-9 (2007).
Identification of Tim4 as a phosphatidylserine receptor - Nakai, W. et al.: Sci.Rep., 6 (33935) (2016).
A novel affinity-based method for the isolation of highly purified extracellular vesicles - Ren, Y. et al.: Biosens Bioelectron., 199, 113870 (2021).
Rapid enrichment and sensitive detection of extracellular vesicles through measuring the phospholipids and transmembrane protein in a microfluidic chip - Lim,K. et al.: J Extracell Vesicles., 10(14), e12170 (2021).
Millisecond dynamic of SARS-CoV-2 spike and its interaction with ACE2 receptor and small extracellular vesicles - Leilei, Shi.: University of Cincinnati, (2021).
A Rapid and Label-free Method for Isolation and Characterization of Exosomes - Mwase, C. et al.: Cells., 11(2), 256 (2022).
Mechanical Compression of Human Airway Epithelial Cells Induces Release of Extracellular Vesicles Containing Tenascin C - Petrouskova, P. et al: Life (Basel)., 12(4), 524 (2022).
Non-Exosomal and Exosome-Derived miRNAs as Promising Biomarkers in Canine Mammary Cancer - Bertkova, A. et al.: Biomed Pharmacother. 151, 113093 (2022).
Exosomes from prostate cancer cell lines: Isolation optimisation and characterisation - Inagaki, M. et al.: Chem. Pharm. Bull., 70, 324-329 (2022).
Transport Characteristics of Placenta-Derived Extracellular Vesicles and Their Relevance to Placenta-to-Maternal Tissue Communication - Zhang. M. et al.: Environ Sci Technol., 56(12), 8475-8484 (2022).
Vesicle-Cloaked Rotavirus Clusters are Environmentally Persistent and Resistant to Free Chlorine Disinfection - Kaneko, K. et al.: IEEE (2022).
Detection of nanoparticles in a minute sample using the vibration induced flow - Shi, Y. et al.: Front Biosci (Landmark Ed)., 27(7) , 205 (2022).
Exosomes in Liquid Biopsy: A Nanotool for Postradiotherapy Cancer Monitoring - Ghosh, S. et al.: Nature, 607, 345-350 (2022).
Enteric viruses replicate in salivary glands and infect through saliva - Kahrizi, M. et al.: Nanomed Res J., 7(2), 189-194 (2022).
Serum amyloid P component and pro-platelet basic protein in extracellular vesicles or serum are novel markers of liver fibrosis in chronic hepatitis C patients - Shirai, K. et al.: PLoS One., 17(7) (2022).
Serum amyloid P component and pro-platelet basic protein in extracellular vesicles or serum are novel markers of liver fibrosis in chronic hepatitis C patients - Mahmoudi, H. et al.: Nanomed Res J., 7(3), 294-300 (2022).
Extracellular Vesicles isolated from mesenchymal stem cell (MSCs) negatively regulates human T cell survival by inducing caspase cascade and inhibiting anti-apoptotic proteins - Peng, Y. et al.: BMC Immunol., 23(1), 37 (2022).
Blockade of exosome generation by GW4869 inhibits the education of M2 macrophages in prostate cancer - Yamashita, T. et al.: Ophthalmology Science, (2022).
Cellular Interplay through Extracellular Vesicle miR-184 Alleviates Corneal Endothelium Degeneration - Watanabe, Y. et al.: Scientific Reports, 12(13344) (2022).
Extracellular vesicles derived from GMSCs stimulated with TNF-α and IFN-α promote M2 macrophage polarization via enhanced CD73 and CD5L expression - Zhang, Y. et al.: Mol Biol Rep., 49(10), 9275-9281 (2022).
Exosomal mir-625-3p derived from hypoxic lung cancer cells facilitates metastasis by targeting SCAI - Watanabe, S. et al.: PNAS Nexus, 1(4) (2022).
Skeletal muscle releases extracellular vesicles with distinct protein and microRNA signatures that function in the muscle microenvironment - Lyu, X. et al.: Pharm Res., 1-9 (2022).
Preventing SARS-CoV-2 Infection Using Anti-spike Nanobody-IFN-β Conjugated Exosomes - Sajidah, E. et al.: J Extracell. Vesicles, 11(11), (2022).
Spatiotemporal tracking of small extracellular vesicle nanotopology in response to physicochemical stresses revealed by HS-AFM - Muraoka, S. et al.: ACS Omega, 7(45), 41472-41479 (2022).
Automated Proteomics Sample Preparation of Phosphatidylserine-Positive Extracellular Vesicles from Human Body Fluids - Takizawa, K. et al.: iScience, 25(11), 105416 (2022).
Urinary extracellular vesicles signature for diagnosis of kidney disease - Shibata, C. et al.: Biochem. Biophys. Res. Commun., 637, 314-321 (2022).
Smaller extracellular vesicles are released from pancreatic cancer cells by the alteration of the lipid composition under low glucose conditions - Wang, Y. et al.: Physiol. Int. (2022).
Exosomes from bone mesenchymal stem cells alleviate mifepristone-induced human endometrial stromal cell injury by inhibiting TLR3 via delivering miR-941 - Saigusa, D. et al.: Medical Mass Spectrometry, 6(2), 126-137 (2022).
Lipidomic and metabolic profiling of plasma and plasma-derived extracellular vesicles by UHPLC-MS/MS - Kawasaki, T. et al.: Inflammation and Regeneration, 42(53) (2022).
Next-generation proteomics of serum extracellular vesicles combined with single-cell RNA sequencing identifies MACROH2A1 associated with refractory COVID-19 - Suzuki, K. et al.: Pharm. Res. (2022).
Activation of Inflammation by MCF-7 Cells-Derived Small Extracellular Vesicles (sEV): Comparison of Three Different Isolation Methods of sEV - Giancaterino, S. et al.: Biotechnol. Adv., 63 (2023).
Alternative biological sources for extracellular vesicles production and purification strategies for process scale-up - Soupir, A. et al.: Int.J. Mol. Sci., 24(3) (2023).
Detectable Lipidomes and Metabolomes by Different Plasma Exosome Isolation Methods in Healthy Controls and Patients with Advanced Prostate and Lung Cancer - Cano, A. et al.: Pharmaceutics, 15(1), 298 (2023).
Exosomes-Based Nanomedicine for Neurodegenerative Diseases: Current Insights and Future Challenges - Misawa, T. et al.: Int. J. Mol. Sci., 24, 2421 (2023).
Identification of Novel Senescent Markers in Small Extracellular Vesicles - Zhao, Y. et al.: Heliyon. 9(2) (2023).
Extracellular vesicles from hypoxia-pretreated adipose-derived stem cells regulate hypoxia/reoxygenation-induced human dermal microvascular endothelial apoptosis and autophagy in vitro - Ishibashi, A. et al.: Nutrients, 15(6), 1472 (2023).
Molecular Mechanisms for the Carnosine-Induced Activation of Muscle–Brain Interaction - Takeda, A. et al.: Analytical Biochemistry, 115130 (2023).
An in vitro lipid-mixing assay to investigate the fusion between small extracellular vesicles and endosome - Sonohara F. et al.: Anticancer Research, 40(4) (2020).
Exploration of Exosomal Micro RNA Biomarkers Related to Epithelial-to-Mesenchymal Transition in Pancreatic Cancer - Farhana Y. et al.: Scientific Reports, 13(4987) (2023).
Extracellular vesicles released from ganglioside GD2-expressing melanoma cells enhance the malignant properties of GD2-negative melanomas - Andari S. et al.: Biomedicines, 11(4), 1053 (2023).
Plant-Derived Exosome-like Nanoparticles for Biomedical Applications and Regenerative Therapy - Peter B. Gahan. et al.: Cancer Screening and Prevention, 2(1) (2023).
A Comparative Review of the Detection of Early-stage Lung Cancer by Exosomal and Free Nucleic Acids and Standard Screening Methods - Kaneko K, et al.: ChemRxiv Home (2023).
Vibration Induced Flow Facilitating Affinity-Based Aggregation for Rapid Detection and Quantification of Nanoparticles - Jie H. , et al.: Anal. Chem(2023).
Homogeneous, Simple, and Direct Analysis of Exosomal PD-L1 via Aptamer-Bivalent-Cholesterol-Anchor Assembly of DNAzyme (ABCzyme) for Tumor Immunotherapy - Klara H , et al.: Cell Communication and Signaling, 21(120) (2023).
Autophagy modulators influence the content of important signalling molecules in PS-positive extracellular vesicles - Bruno Moises de Matos Matos, et al.: World J Stem Cell, 15(5) (2023).
Human pluripotent stem cell-derived extracellular vesicles: From now to the future - Bardia M, et al.: Nanomed Res J, 8(2) (2023).
Mesenchymal stem cell derived exosome promotes the viability of ameloblast-like cells - Smrity S. et al.: Biosensors, 13(8) (2023).
Biogenesis, Isolation, and Detection of Exosomes and Their Potential in Therapeutics and Diagnostics - Ling K. et al.: Ecotoxicology and Environmental Safety, 262 (2023).
PM2.5 induces alterations in gene expression profile of platelet-derived extracellular vesicles and mediates cardiovascular injury in rats - Taku K. et al.: CANCER GENOMICS & PROTEOMICS, 20(456) (2023).
H19 in Serum Extracellular Vesicles Reflects Resistance to AR Axis-targeted Therapy Among CRPC Patients - Haruka K. et al.: MolecularMedicineReports, 28(4) (2023).
Serum levels of vault RNA significantly varied in patients with haematological malignancies - Maki Y. et al.: Indones Biomed J., 15(4) (2023).
Electric Field Stimulation of Stem Cell Culture Media Increases Oxygen Radical Uptake Capacity - Yasufumi T. et al.: Analytical Chemistry, 95(34) (2023).
https://pubs.acs.org/doi/abs/10.1021/acs.analchem.3c01010 - Eisuke K. et al.: Analytical Chemistry, 95(38) (2023).
Rapid and Highly Efficient Purification of Extracellular Vesicles Enabled by a TiO2 Hybridized Spongy-like Polymer - XINCHAN J. et al.: EXPERIMENTAL AND THERAPEUTIC MEDICINE, 26(526) (2023).
Endometrial cell‑derived exosomes facilitate the development of adenomyosis via the IL‑6/JAK2/STAT3 pathway - Wakako W.: 静岡理工科大学紀要Vol.31 (2023).
エクソソーム中の糖化ストレス誘導性 miRNA の網羅的解析 - Takuya Y. et al.: Biological and Pharmaceutical Bulletin, 46(11) (2023).
Extracellular Vesicles Derived from the Serum of Seriola quinqueradiata Induce Human Umbilical Vein Endothelial Cell Proliferation through Angiogenic Signaling
製品一覧
- 項目をすべて開く
- 項目をすべて閉じる
Exosome 抽出・精製試薬
Exosome 抽出・精製試薬(大容量サンプル用)
- 掲載内容は本記事掲載時点の情報です。仕様変更などにより製品内容と実際のイメージが異なる場合があります。
- 掲載されている製品について
- 【試薬】
- 試験・研究の目的のみに使用されるものであり、「医薬品」、「食品」、「家庭用品」などとしては使用できません。
- 試験研究用以外にご使用された場合、いかなる保証も致しかねます。試験研究用以外の用途や原料にご使用希望の場合、弊社営業部門にお問合せください。
- 【医薬品原料】
- 製造専用医薬品及び医薬品添加物などを医薬品等の製造原料として製造業者向けに販売しています。製造専用医薬品(製品名に製造専用の表示があるもの)のご購入には、確認書が必要です。
- 表示している希望納入価格は「本体価格のみ」で消費税等は含まれておりません。
- 表示している希望納入価格は本記事掲載時点の価格です。








