【総説】超高速アミノ酸分析用試薬の開発と応用
本記事は、和光純薬時報 Vol.79 No.1(2011年1月号)において、味の素株式会社 イノベーション研究所 宮野 博様に執筆いただいたものです。
アミノ酸の発見と背景
1806年、アスパラギンがアスパラガスの芽から抽出された。これがアミノ酸の最初の発見である1)。東京帝国大学理科大学(現・東京大学理学部)の教授であった池田菊苗博士が、L-グルタミン酸塩に特徴的な呈味「うま味」があることを発見したのは、それから約100年後の1908年であった。グルタミン酸は、日本では昆布出汁で馴染み深いが、トマトやチーズにも多く含まれている。
アミノ酸は食品栄養素として重要であるが、人の身体は約20%がアミノ酸で構成されていて、そのほとんどはタンパク質として存在している。体内に存在するアミノ酸単体(遊離アミノ酸)は「アミノ酸プール」と称され、細胞内に約45g、細胞間に約5g、血漿中に約1gが、それぞれ含まれる2)。
血液(血漿)中のアミノ酸濃度は、通常、かなり正確に制御されている。アミノ酸代謝が活発な臓器は、筋肉、肝臓、脳、腎臓、小腸などであり、各臓器でのアミノ酸代謝の増減の結果が、血液中での濃度に反映される。つまり、各臓器の代謝バランスが大きくずれると、血液中のアミノ酸バランスの変化となってあらわれる。
そのため、生体液中のアミノ酸の変動は、身体の代謝や疾患の指標として利用されている。新生児の先天性の代謝異常症スクリーニング(newborn screening)は代表的な例である。生後数日(3~7日程度)の新生児を対象として、フェニルケトン尿症(検査項目:フェニルアラニン)、ホモシステイン尿症(検査項目:メチオニン)、メープルシロップ尿症(検査項目:ロイシン)が検査されている。分岐鎖アミノ酸は主に肝臓で産生され、芳香族アミノ酸は主に肝臓で代謝を受ける。
血液中の分岐鎖アミノ酸(Branched Chain Amino Acid:BCAA)と芳香族アミノ酸(Aromatic Amino Acid: AAA)のモル比(フィッシャー比)は、肝機能との相関性があり、肝機能不全の重症度判定や治療の指標である3)。また、血液中のアミノ酸濃度は、栄養状態不良の患者の病態把握などに用いられることも多い。さらに、種々の疾患、肝細胞癌、冠状動脈性心臓病、腎不全、糖尿病、複数の悪性腫瘍などで、血液中のアミノ酸濃度が特徴的な変化を示すことが報告されている2)。
一方、アミノ酸プロファイリングの変化から疾病の有無を知る可能性についても研究されている。最近、複数のアミノ酸濃度を変数とした多変量解析によって、健康状態や疾患の判別が可能であることが、臨床データからも明らかになってきた4,5)。
さて、このようにアミノ酸は生理学的に重要であるが、そのほとんどに特徴的な可視または紫外での吸収域がないため、アミノ酸相互を区別し、感度よく測定することは容易ではない。そのため、アミノ酸分析法の開発は、研究者の格好の研究題材であり、さまざまなアプローチがなされてきた。
アミノ酸分析の歴史
アミノ酸分析の歴史は、誘導体化HPLCの歴史ともいえる。
誘導体化とは、試薬と分析対象物を反応させ、特徴的な化合物を生成させる、たとえば、発色させる、蛍光性物質に変化させることで、選択性と感度を向上させる手法である。アミノ酸の代表的な誘導体化試薬は、1910年にRuhemannらにより発見されたニンヒドリンであり、アミノ酸と反応することで鮮やかな紫色(Ruhemann's purple)を呈する6)。1958年には、Stein、Mooreらは、アミノ酸を陽イオン交換樹脂で分離した後に、ニンヒドリン試薬と混合し、可視光領域の波長で検出する方法(ポストカラム誘導体化法)の自動化に成功した7)。両名はのちにノーベル賞を受賞することになる。
現在、市販されている自動アミノ酸分析装置は、未だにこの原理を用いている。
当初、たんぱく質加水分解アミノ酸の分析に、約1日を要していたが、液体クロマトグラフィーの発展やコンピュータの進歩により、分析時間は格段に短縮され、現在では1時間以内での測定が可能である。また、生体中のアミノ化合物も含めた約40成分を約2時間で測定することができる。
また、アミノ酸のアミノ基をあらかじめ誘導体化したのちにカラム分離に供するプレカラム誘導体化法の研究も盛んに行なわれ、アミノ酸分析の高感度化を図るという視点で、数多くの蛍光検出用の試薬が開発されてきた。
LC/MS アミノ酸分析用試薬の開発
さて、アミノ酸は、H2N-CH(R)-COOHで表されるように、アミノ基とカルボキシル基、及び、Rで表される側鎖からなり、Rが異なるだけの類似した構造を有する化合物群である。誘導体化試薬の構造に由来する吸光度や蛍光で検出するかぎりにおいて、ポストカラム誘導体化ではアミノ酸そのものを、プレカラム誘導体化ではアミノ酸と試薬の反応体を、それぞれカラムで完全に分離しなければ、個々のアミノ酸を区別して定量することはできない。
側鎖のわずかな構造的差異を利用してカラム分離することは容易でなく、特に生体内の遊離アミノ酸の分析時間は、長くならざるをえなかった。分析時間が長ければ、集められるデータの数は少なくなり、このことは、アミノ酸の生理学的研究が進まないひとつの原因であった。逆にいえば、今後の生命科学研究の更なる発展のためには、アミノ酸分析法は、高感度であるだけでなく、高速である必要がある。
アミノ酸分析の高速化を実現する全く新しいアプローチとして、質量分析計の利用とそれに適したプレカラム誘導体化試薬3-アミノピリジル-N-ヒドロキシスクシンイミジルカルバメート(APDS;図1)、アミノタグ法が開発された8)。
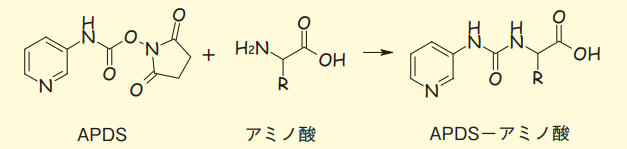
図1. APDSの構造とアミノ酸との反応スキーム
近年の高速液体クロマトグラフと質量分析計とのインターフェース部の発展は、高速液体クロマトグラフィーの検出方法として、質量分析計の利用を可能にした。質量分析計は、不連続な質量電荷比(mass-to-charge ratio:m/z)により化合物を検出することから、選択性の非常に高い方法である。新たに、質量電荷比の軸が加わることで、保持時間が同一であっても、質量電荷比が異なれば、それぞれを区別することができるので、分析時間の大幅な短縮にもつながることになる。
また、アミノ基誘導体化試薬APDSは、逆相LC/MSを前提に、以下の考えにもとづいてデザインされた。
- アミノ基と特異的に温和な条件で反応する活性基を有すること。
- 逆相HPLCで保持・分離が容易とするため、誘導体はアミノ酸そのものに比べて疎水性を高めること。
- カラム分離では、アミノ酸の側鎖(R)の差異をできるだけ活かせるように、誘導体の構造が、嵩高くならないこと。
- 質量分析計での高感度化をはかるため、試薬にはイオン化効率を高める部分構造を持たせること。
APDSには、アミノ基と反応する活性基として活性カルバメートを導入した。弱アルカリ性条件、55 ~ 60℃の加温でほぼ瞬時にアミノ酸誘導体が生成する。試薬母核には、アミノ酸に比べ、誘導体の疎水性が高められるもので骨格の小さいアミノピリジル基を導入した。また、アミノピリジル基はイオン化効率が高く、質量分析計でのイオン化に有利であるため、アミノ酸の検出能も高くなり、分析に必要な血漿量は数μLであり、新生児や老齢者など、採血量に制限のある被験者の検体測定が可能となる。
APDSプレカラム誘導体LC/MS法では、さらに移動相と溶出条件を工夫することで、生体内に含まれる主なアミノ酸をわずか7分間で、すなわち従来のアミノ酸分析計の約1/ 15の分析時間で測定できる9)。
ヒト血漿に含まれる代表的なアミノ酸についてのバリデーション結果を表1と図2に示した。良好な結果であり、また、既存の方法との定量値の比較においても、よい相関を示した。また、尿検体においても同様の結果が示されている。
表1. APDSプレカラム誘導体化LC/MSによる血漿中アミノ酸の測定範囲と最小検出感度
| 測定範囲(μmol/L) | 最小検出感度(μmol/L) | |
|---|---|---|
| セリン | 30 ~ 300 | 0.27 |
| プロリン | 50 ~ 500 | 0.05 |
| チロシン | 20 ~ 200 | 0.07 |
| イソロイシン | 20 ~ 200 | 0.02 |
| ヒスチジン | 20 ~ 200 | 0.36 |
島津製作所LCMS 2020を使用した場合
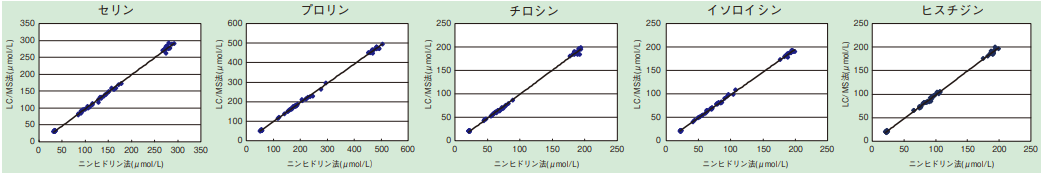
図2. APDS(アミノタグ法)と既存品(ニンヒドリン法)との相関性試験
新生児の先天性代謝異常症の検査で検討が進められているフローインジェクションによるタンデムマス法は、さらに短時間でのアミノ酸分析が可能であるが、血漿中のアミノ酸の一斉分析には適当でない。質量分析計を検出器として利用しているが、カラムでの分離をおこなわないため、分子量の同一のアミノ酸、たとえば、ハイドロキシプロリン、ロイシン、イソロイシンやザルコシン、βアラニン、アラニンなどを区別して定量することができない。
APDSによるプレカラム誘導体化LC/MSは、質量分析計を三連四重極型(Triple quadrupole)MS/MSに し た場合、さらにその威力を発揮する。この装置は二つの四重極質量フィルターと衝突室(コリジョンセル)を有する構造を取っており、特定の質量を持つ分子から生じる特徴的な断片イオンのみを検出し、定量することができる。
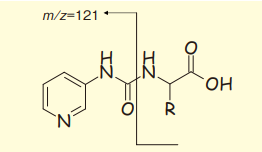
図3. APDS-アミノ酸の特異的開裂
APDSの第5の特徴は、その誘導体、活性カルバメートとアミノ基が反応して生成したウレア結合体が、三連四重極質量分析計で、きわめて選択的にその結合部位が開裂し、規則的なプロダクトイオンが生成することにある(図3)。すなわち、APDSに由来する共通のフラグメントイオンm/z =121をきわめて選択的に検出することができるのが、この試薬によるアミノ酸分析の特徴である。
第二マスフィルターにm/z =121を設定し、プリカーサーイオンスキャンで測定すれば、APDSアミノ酸誘導体だけをすべてMS上に検出することができる。新たに他のアミノ酸を測定したい場合でも、APDSで誘導体化しておけば、衝突誘起解離(Collision-induced dissociation:CID)によるマススペクトルを取得する必要がなく、分析メソッドの開発も簡便である。
105種のアミノ基を有する化合物の一斉分析を試みた結果を図4に示した。分析時間は約10分である。この測定で、親イオン(第一マスフィルター)には、分析対象化合物のAPDS誘導体化物の質量電荷比を入力し、フラグメントイオン(第二マスフィルター)には、すべてm/z =121を入力している。
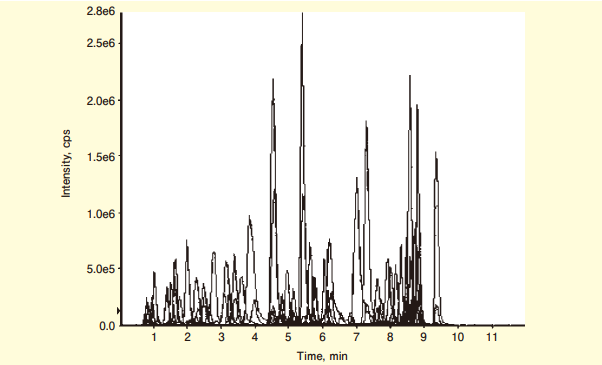
図4. APDSプレカラム誘導体化LC/MS/MSによる105種類のアミノ化合物の一斉分析
Shimbo, K. et al. : Rapid Commun. Mass Spectrom., 23, 1483 (2009). より転載今回紹介したプレカラム誘導体化試薬APDSによるLC/MS分析法では、従来のニンヒドリンによるアミノ酸分析計と同等の結果を、1桁以上の処理速度で得ることができるため、臨床的な意義が大きいと考える。
また、MS/MSを利用すれば、発酵、創薬、食品などの各分野での研究の新たな展開を期待できる。興味のある方は、参考文献10, 11)を参照いただきたい。
参考文献
- 味の素株式会社編:「アミノ酸ハンドブック」(工業調査会)(2003).
- 杤久保修、安東敏彦:「アミノ酸と生活習慣病―最新アミノグラムで探る「いのち」の科学」(女子栄養大学出版部)(2010).
- Freud, H. et al. : Ann. Surg., 190, 571- 576 (1979).
- Zhang, Q. et al. : Hepatol. Res., 34, 170- 177 (2009).
- Okamoto, N. et al. : Int. J. Med. Sci., 1, 1- 8 (2009).
- Ruhemann, S. : J. Chem. SOC., 97, 2025- 2031 (1910).
- Spackman, D. H. et al. : Anal. Chem., 30, 1190-1206 (1958).
- Shimbo, K. et al . : Rapid Commun. Mass Spectrom., 23, 1483- 92 (2009).
- Shimbo, K. et al. : Biomed. Chromatogr., 24, 683- 91 (2010).
- Shimbo, K. et al. : Anal. Chem., 81 , 5172- 9 (2009).
- Iwatani, S. et al. : J. Biotechnol., 128 , 93- 111 (2007).




