【連載】エクソソームと生命現象「第7回 エクソソームとがん」
本記事は、和光純薬時報 Vol.87 No.4(2019年10月号)において、東京医科大学 医学総合研究所 分子細胞治療研究部門 小坂 展慶様に執筆いただいたものです。
がん細胞は、微小環境に存在する細胞と常にコミュニケーションをとっており、それによってがんの悪性化が進展している。このがん細胞と周辺細胞の細胞間コミュニケーションを明らかにすることは、Nivolumab のような画期的ながんの治療薬の開発につながる。
これまでの研究では、細胞間コミュニケーションに関わる因子として、接着分子、細胞外基質、サイトカインやケモカインなどが中心に研究されてきたが、最近、エクソソームが新たな細胞間コミュニケーション因子として注目されてきている。細胞外に分泌される小胞であるエクソソームは、脂質の二重膜で構成されており蛋白質や核酸が含まれている。
エクソソームは、様々な生理活性物質の複合体であるという点において、これまでに報告されてきた他のコミュニケーション因子と違っている。特にこれまでコミュニケーションツールとして考えられてこられなかった細胞内蛋白質や、核酸分子などがエクソソームにより運搬される。
発見当初、細胞内の不要物を排出するゴミ袋のような機能を果たしていると考えられてきた。しかし多くの研究により、生体の様々な生理機能や、その破綻による疾患に関わることが明らかとなってきた。特にがんにおいては、がんの悪性化のすべての段階において重要な役割に関わっている1)。以下に当研究室がこれまでに報告してきたがんの悪性化におけるエクソソームの機能に関して簡単に紹介する。
がん細胞は非常に速く分裂するため、生存のために栄養を必要としている。そのためがん細胞は、腫瘍内に血管を誘導することで、栄養を獲得している。我々は、がん細胞から分泌されるエクソソームが、腫瘍血管を誘導することを明らかにした2)。また、セラミド合成酵素の一つである nSMase2(中性スフィンゴミエリナーゼ2)の発現を抑えることによりがん細胞のエクソソームの分泌を減少させた結果、腫瘍内の血管が誘導されなくなり、結果的にがんの転移が抑制された。
卵巣がんは、がんの悪性化が進行すると、腹部にがんが広がる腹膜播種を生じ治療が困難となる。この卵巣がんによる腹膜播種にもエクソソームが関わっている3)。卵巣がんから分泌されたエクソソームは、腹膜を形成している中皮細胞に取り込まれ、それらの細胞にアポトーシスを誘導する。これにより腹膜に穴が開き、がん細胞の腹膜膜播種が促進される3)。
一方、同じように治療が困難ながんの転移であるがんの脳転移に関してもエクソソームが関係している。血液脳関門と呼ばれる生体バリアーは、栄養以外の物質の脳への自由な移行を制限しているが、がん細胞はこのバリアーを突破し転移を成立させている。我々は、脳転移性乳がん細胞株のエクソソームが、血液脳関門を形成する細胞の一つである血管内皮細胞に入り込み、血管内皮細胞同士の強い細胞間相互作用を緩めることにより、がんの転移を成立させることを示した4)。
また乳がんは、5年や10年と長期にわたる再発リスクが存在することが知られている。その理由の一つとして、乳がん細胞が骨髄中に入り、長期間の休眠に入るというメカニズムが提唱されているがその分子機構に関しては不明な点が多い。我々は、骨髄中の間葉系幹細胞のエクソソームによって、乳がん細胞が休眠することを明らかにし、乳がんの再発におけるエクソソームの重要性を示した5)。
このようにこれまでに紹介してきた我々の研究だけでなく、世界中の多くの研究者によりがんの悪性化におけるエクソソームの役割が報告されている(図1)。
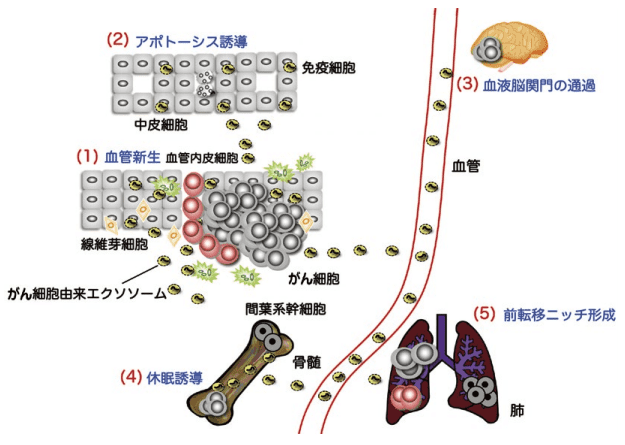
図1.がんの悪性化におけるエクソソームの役割
エクソソームは、がんの悪性化の多段階に関わる。がん細胞は増殖を繰り返すため、絶え間なく変化する環境に適応するために、自身の利益になるような微小環境に作り変える。この際、サイトカインやケモカインの他にエクソソームが関わっている。例えば栄養の摂取や低酸素環境下の場合には血管新生を促すために血管内皮細胞にエクソソームを送り込み腫瘍血管を作成する(1)。がん転移においては、生体バリアーとなっている腹膜の中皮細胞のアポトーシスを誘導し、自身の遠隔転移を可能にする(2)。さらに同じように生体バリアーとして重要な血液脳関門における血管内皮細胞の細胞間結合を緩めるようなエクソソームを送っている(3)。また骨髄中に存在するがん細胞は、間葉系幹細胞のエクソソームを受け取ることで休眠状態になり、がんの長期再発の一因になっていると考えられている(4)。さらにがん細胞由来のエクソソームが前転移ニッチ形成に関わっていることも報告されている(5)。もちろんがんの悪性化には、がん細胞から分泌されるエクソソームだけではなく、がん微小環境に存在するがん以外の細胞から分泌されるエクソソームも、がんの悪性化に関わっている。これまでのサイトカインやケモカインといった分泌因子や接着分子なども含めると、がん細胞とその微小環境に存在する周辺細胞との細胞間コミュニケーションは非常に複雑であると言える。
しかし、がん細胞のエクソソームによって、がんの悪性化が進展するのであれば、そのエクソソームを標的とした治療法が、がんの転移の抑制に有効である可能性がある。そこで以下にがんの悪性化に関わるエクソソームを標的にしたがん治療法の例に関して概説する(図2)。
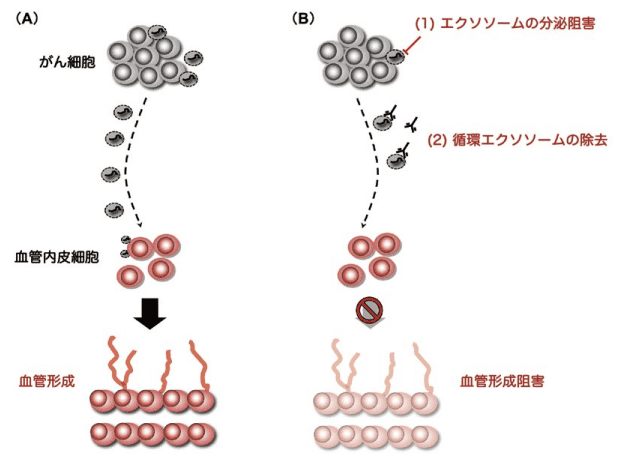
図2.がん細胞由来エクソソームに対する新規のがん治療
がん細胞から分泌されたエクソソームを標的とした新規のがん治療として以下の2通りを例示する。例えば、がん細胞のエクソソームを受け取った血管内皮細胞は、血管新生を誘導し、がん細胞への酸素と栄養の供給に関わっている(A)。この時、(1)エクソソームの分泌の阻害、(2)循環エクソソームの除去、を行い、がん細胞由来のエクソソームを血管内皮細胞に届かなくすることで、新規の血管新生阻害剤の開発へとつながる。1.がん細胞のエクソソーム分泌を抑える
我々や他のグループの研究により、がん細胞のエクソソーム分泌を阻害することでがんの転移が抑制される可能性が示された1)。そのためがん細胞におけるエクソソームの分泌を抑制する方法が研究されている。
しかし、エクソソームは生体内の多くの細胞から分泌されており、免疫細胞由来のエクソソームのように、がんの悪性化に抑制的に働くエクソソームも存在するため、全てのエクソソームを抑制するような方法では、有効ながんの治療法にならない。またエクソソームは様々な生理学的な機能も持っているため、全てのエクソソームの分泌を抑制する方法では、思わぬ副作用が出る可能性もある。
そこで、がん細胞といった疾患特異的なエクソソームの分泌経路を明らかにすることで、その疾患特異的なエクソソーム分泌経路を標的とした治療法を確立する必要がある。エクソソームの分泌経路はわからないことが多いが、がん細胞は正常細胞に比べてエクソソームの分泌量が明らかに多い。このことからもがん細胞のエクソソームの分泌は正常細胞と違う分子機構が存在すると考察される。そのためそれらの分子を同定し、その分子を標的としてエクソソームの分泌を抑制することがこのアプローチによる治療の実現に向けて重要である。
2.がん細胞由来の血中のエクソソームを除去する
血中に存在するがん細胞由来のエクソソームを除去するというアプローチは、前転移ニッチ形成や薬剤耐性などに関わるエクソソームの機能を阻害する方法である。前転移ニッチ(pre-metastatic niche)は、がん細胞が転移予定の臓器に転移する前に、がん細胞が生存しやすいように予め整備された環境のことである。
これまでの研究により、様々なサイトカインやケモカインが前転移ニッチ形成に重要であることが報告されてきたが、がん細胞由来のエクソソームも前転移ニッチ形成に関わっていることが報告されている6, 7)。
血液中のエクソソームによるがん悪性化の他の例として、トラスツズマブのようにHER2を標的とした抗体医薬が血液中に循環しているHER2陽性のエクソソームに結合してしまい、腫瘍まで届かず薬効を示せない可能性も示唆されている8)。そこで、このような血液中に循環しているエクソソームを除去するがん治療の可能性が研究されている。
我々のグループでは、ヒト乳がん細胞株をマウスに移植し、エクソソーム上のCD63もしくはCD9を標的とする抗体を投与した結果、乳がん細胞株の転移を有意に抑制した9)。これにより、血液中のエクソソーム除去によるがん治療の可能性が示唆されたが、本論文ではCD63やCD9といった多くのエクソソームで発現が確認されている分子を標的としているため、正常細胞のエクソソームにも結合する可能性が存在している。そのため実際の臨床の現場では、がん細胞特異的なエクソソームの抗原を同定し、その分子を標的にする必要がある。
エクソソーム研究が世界中で盛んになってから、まだ10年ほどであるため、エクソソームにはまだわからないことが多い。エクソソームは、複数の分子から成り立つ複合体であり、また細胞や細胞の置かれている環境によって分泌されるエクソソームの質が変わる。さらにエクソソームが100 nmという大きさであるため、これまでの生命科学の研究で用いられてきた機器や技術を、そのままエクソソームの解析に用いることができない。
これらの背景により、エクソソーム研究は複雑かつ困難な状況にある。しかし、がん細胞の情報を多く持ち、がんの悪性化に関わっているエクソソームは、新規のがん診断・治療の非常に魅力的な研究対象であり、今後のさらなる研究の発展が期待されている。
参考文献
- Kosaka, N. et al. : J. Clin. Invest., 126 (4), 1163-72 (2016). DOI: 10.1172/JCI81130
- Kosaka, N. et al. : J. Biol. Chem., 288 (15), 10849-59 (2013). DOI: 10.1074/jbc.M112.446831
- Yokoi, A. et al. : Nat. Commun., 8, 14470 (2017). DOI: 10.1038/ncomms14470
- Tominaga, N. et al. : Nat. Commun., 6, 6716 (2015). DOI: 10.1038/ncomms7716
- Ono, M. et al . : Sci. Signal., 7 (332), ra63 (2014). DOI: 10.1126/scisignal.2005231
- Peinado, H. et al. : Nat. Med., 18 (6), 883-91 (2012). DOI: 10.1038/nm.2753
- Hoshino, A. et al. : Nature, 527 (7578), 329-35 (2015). DOI: 10.1038/nature15756
- Ciravolo, V. et al. : J. Cell. Physiol., 227 (2), 658-67 (2012). DOI: 10.1002/jcp.22773
- Nishida-Aoki, N. et al. : Mol. Ther., 25 (1), 181-191 (2017). DOI: 10.1016/j.ymthe.2016.10.009















