【総説】「生体暗証番号」解読のための共培養研究とエクソソーム
本記事は、和光純薬時報 Vol.87 No.4(2019年10月号)において、株式会社ギンレイラボ 島崎 猛夫様に執筆いただいたものです。
はじめに
近年、生物学においてエクソソームを含めた細胞外小胞が各種細胞のコミュニケーションに大きな役割を果たしていることが明らかになり、論文数は劇的に増加してきている。現在のエクソソーム研究の主流は、各種疾患に関係すると思われるエクソソームを抽出・解析する手法であり、LiquidBiopsy と表現されている手法の一つである。しかし、エクソソームは細胞間相互作用のキープレーヤーであり、真にエクソソームを介した細胞が持つ機能や疾患の特性を解析するには、エクソソームを抽出し解析するといった体力測定的な研究だけでなく、練習試合のように生体内で起きている現象をin vitro でも再現し、相互作用研究を行う必要がある。

Fig 1.生体暗証番号の概念図
というのも、これまでのエクソソームに関する機能解析を目的とした基礎研究では、大雑把に表現すれば、例えば、がん細胞から抽出したエクソソームを他の細胞に投与して、その細胞の挙動を観察・解析し、そのエクソソームが持つ機能を論じていることが多い。その上で、そのエクソソームに含まれる内包物を解析し、その内包物の機能について分子生物学的手法を駆使してさらに解析する。このような手法のメリットは、まさに基本的な機能解析であり、機械に例えればスイッチを押すとどうなるか試してみたということである。
しかし、このような研究手法は、ただスイッチを押すだけであり、実際の生体では、多量の抽出エクソソームが投与されたのと同じことが起こるのか?言い換えれば、それ程の強いスイッチが押されているかも不明である。また、この研究手法では生体に「暗証番号のような仕組み」(Figure 1.)があり、その強さ、順番などが大きく関係している場合には、全く役に立たない。
論文投稿を予定しているため詳細は割愛するが、我々は生体には「生体暗証番号のような仕組み」が存在していることを確認している。エクソソームを抽出し、他の細胞に投与する研究は単独のスイッチ機能の解析には有用であり、これからも基本的な解析手法であることに変わりはない。しかし、「生体暗証番号」を解析するには、抽出手技を伴わず、細胞同士の自然な相互作用観察を可能とする共培養研究が有用である。
これまでに共培養を利用した研究は多く行われているが、現時点で共培養技術を利用したエクソソーム研究は比較的少ない。エクソソームの本態である相互作用を解析するためには、共培養技術の活用は重要であり、エクソソームについての詳細な解説は多くの総説をご一読いただくとして、本稿では、生体における暗証番号を解読するためのエクソソーム研究手法における注意点と解読ツールとしての共培養システムについて解説する。
エクソソーム研究の注意点について
これまでには、エクソソーム研究では、血液などの生体由来の検体や細胞培養上清に含まれるエクソソームを抽出して解析する研究が主流を占めており、Liquid Biopsy として数多くの報告がある 1-5)。これらは、エクソソーム内に含まれる機能性物質の解析により、疾患マーカーとして、治療ターゲットとして、治療応用としての研究が盛んになっている。特に miRNA がエクソソームに含まれ細胞間を移動する可能性が示されて以来 6, 7)、エクソソーム内 miRNA の解析研究が盛んになっており、疾患をスクリーニングできるとする報告が相次いでいる。
エクソソーム研究は、主に3つのアプローチで行われていることが多い。①エクソソームを取り出し、内包物を解析する研究、②取り出したエクソソームを他の細胞などに投与して反応を確かめる研究、③エクソソームをラベルして細胞内での動態解析及び①~③の組み合わせの研究である。これらの手法をもっと単純に分類すると、エクソソームを抽出するか否かで大分類が可能である。
ここで重要な点は、エクソソームを抽出・精製し、別の細胞に添加し、細胞への取り込みや細胞の変化を解析する実験において、1)抽出する際の手法によるエクソソーム集団の特徴に注意が必要であり、2)抽出した多量のエクソソームによる現象が生体内での現象をシミュレーションしているかどうかは明らかでない、ということである。
1)抽出手法による影響について
エクソソームを抽出した解析を行う場合は、回収されたエクソソームは抽出方法により性質の偏った集団になる場合がある。というのも、各種抽出手法は、その回収効率について議論されることが多いが、そもそも回収したエクソソームの性質も抽出方法に影響を受けたものしか集められていないという点に注意が必要である。
エクソソームの抽出法には、超遠心を利用したサイズ分画、あるいは、フィルターや微細孔をもつ構造物による分画、ゲルろ過を用いた抽出速度の違い、表面に発現している蛋白質やテトラスパニンを利用した抗体や親和性物質による分離など、エクソソームの抽出方法は乱立している。
抽出方法が乱立している理由は、エクソソームの何たるかがわかっていないことである。エクソソームを含めた細胞外小胞は、初期の報告では、血小板や赤血球から分泌され、細胞のゴミとして理解されていた 8, 9)。1983年にJohonstone博士が羊の網状赤血球から分泌された小胞に対してエクソソームと命名した 10)。
多くの細胞がエクソソームを分泌し、血液などの体液にも存在する。エクソソームは、多くの機能が未知で、蛋白質や核酸などを内包している。脂質二重膜を持ち細胞膜を 4 回貫通する構造を持つ膜蛋白質ファミリーであるテトラスパニン、膜輸送蛋白質、インテグリンなどの接着分子を持つ。エクソソーム以外に、細 胞が分泌する細胞外小胞には、エクソソームよりやや大型サイズで形質膜由来のマイクロベシクルや、細胞がアポトーシスを起こす際に放出されるアポトーシス小体なども含まれる 11)。
用語の定義が研究者間で統一されていなかったため、混乱していた時期もあるが、近年は、国際細胞外小胞学会を中心にエクソソームの概念が統一されつつある。細胞外小胞は、現在主に3つのグループに分けられている。
(1)直径 50nm-150nm のサイズの脂質二重膜を含むエクソソーム、(2)100nm1000nm の細胞から直接分泌された小胞のマイクロベシクル、(3)アポトーシスを起こした細胞から生じるアポトーシス小体である 11)。
特にブレイクスルーな出来事として、2006年から2007年にかけて miRNA や RNA がエクソソームに含まれており、エクソソームを介して細胞間を移動する可能性が示されたことである 6, 7)。以後世界中の研究者が細胞外小胞に注目し、様々な分野におけるエクソソーム研究が飛躍的に発展した。
しかし、依然としてエクソソームは、脂質二重膜を持つ何かであり、表面に CD9 や CD63 などのテトラスパニンが検出される小胞であること以外の絶対的な指標は存在せず、それゆえ、これまでは超遠心を用いてある一定のサイズ分画に検出される小胞であるか、あるいは、各種市販抽出キットで処理を行った小胞で、そのサイズを確認して、テトラスパニンが検出されることをもって「エクソソームを抽出した」としている研究が多い。
我々の解析では、表面のテトラスパニン量は一定ではなく、細胞種や細胞の状態によって発現の有無、発現量は大きく異なっており、さらには薬剤によってその発現量も変化する。そのため、CD9 や CD81 などのテトラスパニンに対する抗体反応を利用して定量するキットの場合は、そのようなことを念頭に置いた解析をお勧めしたい。
つまり「見たいものしか見ていない」可能性に注意を払う必要がある。我々は、出来るだけ表面マーカーが特定の集団のエクソソームにならないように、超遠心法あるいは脂質への接着を利用した簡便なキット(MagCapture™エクソソームアイソレーションキットPS)を用いて解析を行っている。
2)エクソソームの投与実験における注意点
抽出したエクソソームを標識して他の細胞や動物に投与して解析する手法も用いられている。蛍光プローブを用いて標識し、エクソソームのイメージングによる解析 12, 13)や、酸化鉄ナノ微粒子をプローブとしたエクソソームの標識方法 14, 15)も用いられている。しかし、精製されたエクソソームが大量に投与されたことによる結果は、本来の生理的な機能とは異なる結果を導き出している可能性に注意が必要である。
量が多いと逆の反応を示す経路も存在するため、濃度的な確認も重要な要素である。しかし、これまでに多く行われている投与実験である「スイッチを押したらどうなるか?」的な解析研究は、一つの確立したエクソソーム研究方法であることは間違いない 16-21)。
「生体暗証番号」解読のための共培養研究
これまでに注意点として述べたエクソソーム研究の課題をクリアする研究手法が存在する。それは、抽出を行わず、細胞が分泌したものをそのまま間接的に相互作用させる系である細胞共培養である。細胞共培養は、それぞれの細胞の自然な相互作用を観察することができる。また、細胞同士の自然な相互作用は、あたかも細胞同士で「生体暗証番号」を押しあっている研究であり、単なるスイッチを押しただけのような現象とは異なる現象が観察されることも多い。つまり、「生体暗証番号」を解読するためには、まずは細胞同士の相互作用研究である共培養研究をお勧めしたい。
共培養研究は細胞間コミュニケーション研究として 1980 年代に広まり、以後各領域研究において使用されてきた。共培養システムを研究に用いる主な動機は、細胞や微生物間の相互作用を研究することや 22)、そのような相互作用を利用した新たな細胞工学の手法を開発するためである 23, 24)。エクソソームに関する共培養研究において、エクソソームの表面マーカーである CD63 や CD81、CD9 などを蛍光標識し、細胞内動態や細胞への取り込みを研究する方法がある。
これらの研究の利点は、エクソソームを介した自然な作用を観察することができる点にある。しかし、CD63 などの表面マーカーの発現は、細胞の種類や状態によっても異なり、一部の表面マーカーは発現していない細胞も存在する。また、蛍光標識を使った研究についても、標識分子の識別精度といった光学特性上の課題も残っている。しかしこれらの手法は、生体内で行われている細胞間相互作用を研究するための重要な研究手法である。
共培養システムを利用したエクソソーム研究は増えてきており、例示すると、エクソソーム表面に局在する蛋白質である CD63 とGFP との融合蛋白質を利用して、エクソソームの挙動の可視化を試みた報告 11)、Mesenchymal stroma stem cells(MSC)由来のエクソソームが乳がん細胞に取り込まれ、MSC 由来の細胞能力を獲得した報告 25)、MSC 由来のCD90 が共培養で発現したことを明らかにした報告 25)、蛍光標識を用いた実験として、エクソソームの交換・移行を確認した報告 25-27)がある。
これまでにも、細胞を混ぜない培養研究として、上下タイプの共培養容器を使用した実験は、一つの重要なモデルである。糖尿病モデルラット心筋細胞とマウス心筋内膜細胞との共培養で血管増生が抑制され、エクソソーム及びエクソソーム中の miR-320 が関与していることを証明した報告 27)や、Virus由来の miRNAs がエクソソームを介して、他の細胞に伝達されることを証明した報告もある 28)。また、Transwell® co-culture plate の膜の上下で細胞を培養し、直接細胞が接触しない条件で、エクソソームを介して細胞の性質が変化することも報告されている 29, 30)。
In vitro BBB モデルでは、Transwell® co-culture plate を使用した報告がある 13)。脳血管内皮細胞、ペリサイト、アストロサイトの 3 種類の細胞を共培養したモデルであり、血液脳関門(BBB)を模擬している。これらは、co-culture plateを上手に利用している。
共培養研究の方法について
既存の共培養システムは、一般的に細胞同士の接着の状態により、接触型の直接共培養と非接触型の間接共培養の2つのグループに分けられる。細胞を混ぜる方法は、直接共培養であり、細胞同士は直接接触している。直接共培養は一般的によく行われるが、一つ一つの細胞を解析するのが困難であり、細胞集団として解析することができるのみである。また接触による直接の作用だけでなく、実際には、液性因子による影響も混ざっている点に注意が必要である。そのため、手軽ではあるが、結果の解釈が難しくなる。
一方、間接共培養は、細胞を別々の環境におき、細胞間相互作用は、液性因子を介して行われる。培養容器やフィルター、ゲルなどを用いて細胞が直接物理的に接触しない状態に置いてから細胞同士の作用を観察するため、間接的な液性因子による作用を明らかにすることができる。
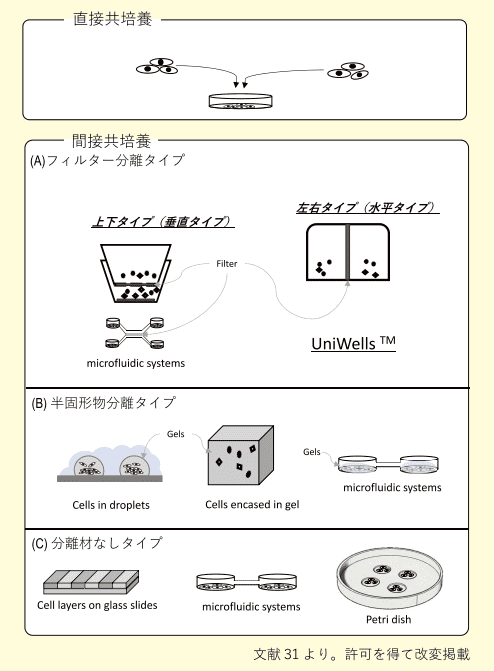
Fig 2.共培養方法の概略
間接共培養の技術は、主に3つの方法に分けられる 31)(Figure 2.)。①フィルターで分離するタイプ、②ゲルなどの半固形物を利用して細胞同士を分離し、ゲルを介して因子を交換するシステムタイプ、③完全な分離はできないが、段差や水滴などを利用して細胞をコロニー状に培養し、分離物を用いない方法である。
これら以外に培養液を交換する方法 32)もバクテリアなどの研究では用いられている。フィルターを使い上下方向に容器が接続するタイプの共培養容器は、Boyden chamber 33-35)あるいは、Boyden chamber を改変した Transwell® co-culture plate が標準的に使用されてきた。
Boyden chamber は、1962年に Stephan Boyden により開発され、上下で培養容器を接続し、上側の培養容器の底面をフィルターにすることにより、フィルターを介して共培養する方式である。Transwell® co-culture plate 以外に、一般名として Cell culture insert と呼称されることも多い。
初期は、invasion などの評価に用いられたが、これまで多くの間接共培養の方法として標準的に用いられるようになった。しかし、上側にある培養容器の細胞は、顕微鏡の焦点距離の問題により、精細な画像を得ることが難しく、また上側の細胞培養容器の底面の素材が、下側の細胞培養容器の素材と異なるといった不利な点がある。細胞の挙動は、底面の素材により影響を受けることも多く、底面の素材が異なる影響は大きい。また、フィルターを一体化して容器を作る必要があるために、フィルターの種類は少なくなってしまう。
また、共培養に関する効率の点でも、上下タイプの共培養容器は、その構造上の特性からどうしても、バケツの中にバケツを入れたような構造となってしまう。そのため、容器の容積比が1:3といったように大きく異なり、細胞が分泌した液性因子の希釈が起こってしまう。また、上側の容器の細胞はフィルターの上に位置するため、細胞密度が高くなるとフィルターの穴を塞ぐことになり、共培養効果が時間とともに低下してしまう。
意外なことに、横方向に接続するタイプのフィルター分離タイプの容器は存在しなかった。最近、バクテリア研究のための横方向の容器の報告があるが 32)、観察を目的としていない。我々は、横方向接続型の新しい細胞培養容器で、顕微鏡で観察が可能な水平型共培養容器を開発した(UniWells™ : 富士フイルム和光純薬株式会社より販売)。
我々が開発した共培養容器 31)であるため、本稿にてご紹介すると、容器と容器の間に市販の任意のフィルターを入れることができる培養容器であり、それぞれの容器は単体でも培養でき、任意の時点で 2 つの容器を結合することができる。別々の環境で培養してから共培養に持ち込み、培養液の量をコントロールすることで容易に共培養状態をコントロールすることもできる(Figure 3.)。
この水平型共培養容器の最大のメリットは、細胞とフィルターの位置関係が離れていることから、前述のデメリットであった細胞高密度による液性因子の移動性低下も認めず、また容器の容積比も1:1であることから、共培養効果は最大の効率となり、かつ両者の細胞を下面から同時観察が可能なことである。
使い方には、2つの方法があり、1つは、単体で培養した後、2つの容器を接続(結合)して共培養する方法である。もう1つは、最初から2つの容器を接続して組み立てておき、接続面までの高さを利用して、共培養状態をコントロールする手法である。
A法:スタンドアロンタイプで培養して、後に共培養系として組み立てる方法
B法:最初に最終形まで組み立てて、培養液量により共培養をコントロールする方法
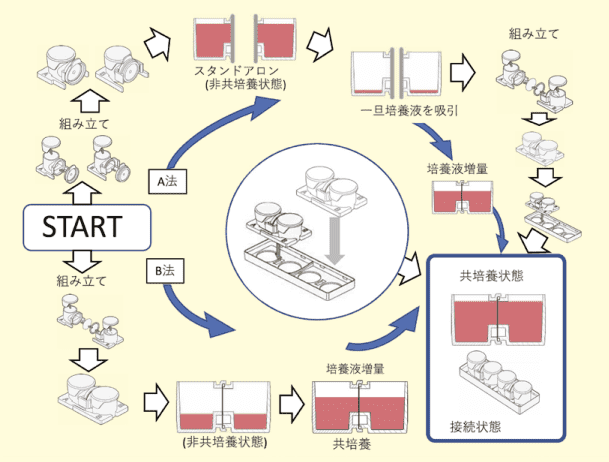
Fig 3.共培養容器の使い方
組み立ては容易であり、研究者は任意の2つの方法を選択して使用することができる。ゲルなどを利用して3D培養を行えば、3D培養での共培養も可能である。セルカルチャーインサートタイプの容器は、上下方向で培養容器を繋いでいるため、顕微鏡で両方の細胞を同時には観察できないが、我々の開発した共培養容器は、水平方向に接続させているため、両方の細胞を同時に観察することができる。
いずれのシステムを用いるにせよ、Co-culture systems は、細胞間相互作用を観察する研究や、細胞の相互作用を利用する細胞工学技術にとって有効である。共培養システムは、細胞工学にとって様々な手法を提供可能にし、薬剤探索にも大変有効と考えられる 24)。
エクソソーム研究の今後について
様々な研究が展開されているがん、免疫疾患、神経疾患、再生医療分野だけなく、現在は原因やメカニズムが未知の疾患についてもエクソソームの関与が明らかになってきている。エクソソームと疾患に関する研究は、エクソソームの抽出方法が標準化していないという注意点はあるものの、疾患とエクソソーム内包物の関係が明らかになってくると思われる。
しかし、エクソソームに関する生理学的機能、分泌・取り込みの基礎的なメカニズムに関する知見がまだまだ不足しており、特に生体内にあたかも暗証番号のような相互作用システムが存在する可能性を考えると、革新的な研究を成し遂げるためには、共培養システムを用いたエクソソーム研究が重要であると考えている。
共培養システムを利用した先駆的な研究が多く行われることにより、今後エクソソームを介した「生体暗証番号」が解明されることを期待する。
参考文献
- Taylor, D. D. and Gercel-Taylor, C. : Gynecol. Oncol., 110, 13 (2008). DOI: 10.1016/j.ygyno.2008.04.033
- Murakami, Y. et al. : PLoS One, 7, e48366 (2012). DOI: 10.1371/journal.pone.0048366
- Moon, P. G. et al. : Proteomics, 11, 2459 (2011). DOI: 10.1002/pmic.201000443
- Hoshino, A. et al. : Nature, 527, 329 (2015). DOI: 10.1038/nature15756
- Kosaka, N. et al. : J. Clin. Invest., 126, 1163 (2016). DOI: 10.1172/JCI81130
- Valadi, H. et al. : Nat. Cell Biol., 9, 654 (2007). DOI: 10.1038/ncb1596
- Ratajczak, J. et al. : Leukemia, 20, 847 (2006). DOI: 10.1038/sj.leu.2404132
- Chargaff, E. and West, R. : J. Biol. Chem., 166, 189 (1946).
- Wolf, P. : Br. J. Haematol., 13, 269 (1967). DOI: 10.1111/j.1365-2141.1967.tb08741.x
- Johnstone, R. M. et al. : J. Biol. Chem., 262, 9412 (1987).
- Yanez-Mo, M. : J. Extracell. Vesicles, 4, 27066 (2015). DOI: 10.3402/jev.v4.27066
- Smyth, T. et al. : J. Control. Release, 199, 145 (2015). DOI: 10.1016/j.jconrel.2014.12.013
- Wiklander, O. P. et al. : J. Extracell. Vesicles, 4, 26316 (2015). DOI: 10.3402/jev.v4.26316
- Busato, A. et al. : Int. J. Nanomedicine, 11, 2481 (2016). DOI: 10.2147/IJN.S104152
- Hu, L. et al. : Magn. Reson. Med., 74 (1), 266 (2014). DOI: 10.1002/mrm.25376
- Chen, Y. et al. : Oncogene, 36, 4692 (2017). DOI: 10.1038/onc.2017.100
- Yuyama, K. et al. : J. Neurochem., 105, 217 (2008). DOI: 10.1111/j.1471-4159.2007.05128.x
- Rappa, G. et al. : Mol. Cancer, 12, 62 (2013). DOI: 10.1186/1476-4598-12-62
- Chowdhury, R. et al. : Oncotarget, 6, 715 (2015). DOI: 10.18632/oncotarget.2711
- Saeed-Zidane, M. et al. : PLoS One, 12, e0187569 (2017). DOI: 10.1371/journal.pone.0187569
- Ekstrom, K. et al. : J. Extracell. Vesicles, 1 (2012). doi: 10.3402/jev.v1i0.18389
- Cottet, S. et al. : J. Biol. Chem., 277, 33978 (2002). DOI: 10.1074/jbc.M201726200
- Tanouchi, Y. et al. : Curr. Opin. Biotechnol., 23, 791 (2012). DOI: 10.1016/j.copbio.2012.01.006
- Moraes, C. et al. : Ann. Biomed. Eng., 40, 1211 (2012). DOI: 10.1007/s10439-011-0455-6
- Yang, Y. et al. : Int. J. Oncol., 47, 244 (2015). DOI: 10.3892/ijo.2015.3001
- Hergenreider, E. et al. : Nat. Cell Biol., 14, 249 (2012). DOI: 10.1038/ncb2441
- Wang, X. et al. : J. Mol. Cell. Cardiol., 74, 139 (2014). DOI: 10.1016/j.yjmcc.2014.05.001
- Shin, Y. et al. : Nat. Protoc., 7, 1247 (2012). DOI: 10.1038/nprot.2012.051
- Su, M. J. et al. : Sci. Rep., 6, 30110 (2016). DOI: 10.1038/srep30110
- Li, Y. et al. : Stem Cell Res, Ther., 8, 198 (2017). DOI: 10.1186/s13287-017-0648-5
- Shimasaki, T. et al. : Biol. Pharm. Bull., 41, 1311 (2018). DOI: 10.1248/bpb.b18-00223
- Moutinho, T. J., Jr. et al. : PLoS One, 12, e0182163 (2017). DOI: 10.1371/journal.pone.0182163
- Boyden, S. : J. Exp. Med., 115, 453 (1962). DOI: 10.1084/jem.115.3.453
- Thomsen, R. and Lade Nielsen, A. : Glia, 59, 1782 (2011).
- Albini, A. et al. : Cancer Res., 47, 3239 (1987).











