【連載】エクソソームと生命現象「第 6 回 エクソソームとウイルス」
本記事は、和光純薬時報 Vol.87 No.3(2019年7月号)において、東海大学総合医学研究所造血腫瘍分野 東海大学医学部血液・腫瘍内科 柿崎 正敏様、幸谷 愛様に執筆いただいたものです。
はじめに
ウイルス感染症は有史以前から存在していたが、病原体としてウイルスが認識されるようになったのは、1898年に口蹄疫ウイルスが発見されてからである。ヒトの病気に関わるウイルスは数百種類とされており、日常でよく遭遇する呼吸器や消化器などの急性感染症から、AIDSやB型・C型肝炎、子宮頸がんなど慢性疾患としての経過をたどる感染症まで多種多様である。近年、ウイルスの生存戦略にウイルスと同様に細胞外小胞(Extracellular vesicles: EVs)に属するエクソソームが関与していることが報告され注目を集めている。
本稿では、ウイルス感染細胞から放出されるエクソソームがウイルス性疾患に関連する報告を紹介し、さらに、我々が研究対象とするB型肝炎ウイルス(Hepatitis B virus: HBV)感染細胞由来エクソソームの機能について概説する。
エクソソームの分泌
エクソソームは、後期エンドソームである多胞性エンドソーム(Multi vesicular body: MVB)中に出芽している腔内膜小胞(intraluminal vesicles: ILVs)と呼ばれる~100 µm程度の様々なサイズからなる小胞由来であると考えられている1)。ILVsの形成にはESCRT (endosomal sorting complex required for transport) と呼ばれるタンパク質複合体が関与している。MVBが細胞膜と融合し、エクソソームは細胞外に分泌される。
ウイルスの出芽
ウイルスの出芽には、細胞膜から直接出芽する経路やMVB経由で出芽する経路など、いくつかの経路が存在している。レトロウイルス、フラビウイルス、ラブドウイルスやパラミクソウイルスなどの多くのエンベロープを持つRNAウイルスは細胞膜からの出芽を円滑に進めるためにESCRT複合体およびESCRT関連タンパク質と相互作用することが報告されている2)。また、HBVやE型肝炎ウイルス (Hepatitis E virus: HEV) もESCRT複合体およびESCRT関連タンパク質と相互作用し、MVB経由で放出されることが報告されている2, 3)。
以上のことから、ウイルスはESCRT機構をハイジャックすることで出芽を円滑に進めていると考えられる。
ウイルス感染細胞由来エクソソームの機能
出芽以外にも、ウイルスはESCRT機構をハイジャックすることで、エクソソームにウイルスゲノムやウイルス関連タンパク質などを輸送させることが知られており、エクソソームをウイルスの生存に有利に利用していると考えられている。
実際に、HIV感染細胞由来のエクソソームには、HIVウイルスタンパク質の一つであるNefが内包されていることがわかっており、Nefを内包するエクソソームを取り込んだ細胞はHIVに対する感受性が亢進する4, 5)。また、EBV陽性のB細胞リンパ腫由来のエクソソームには、EBVがコードするmiRNAを内包することがわかっており、このエクソソームを取り込んだマクロファージは腫瘍随伴マクロファージ様の性質変化を引き起こし、腫瘍細胞の増殖を促す6)。
上記の様に現在までに様々なウイルス感染細胞由来のエクソソームの機能解析が進んできている。以下の項目では、我々が研究を進めているHBV感染細胞由来のエクソソームの機能について概説する。
HBV
HBVは全世界的な感染症であり、HBV持続感染者は全世界でも4億人存在すると推定され、その大部分はアジア、アフリカ地域に集中しており、本邦でもHBVキャリアは約100万人と推定される。本邦では、母子感染予防策により新規感染は減り、核酸アナログによってウイルス複製は制御可能になりつつあるが、未だウイルスの完全排除に至る治療法はない。
HBVを完全排除するための治療法開発には、まずB型肝炎が慢性化するプロセスの解明が必要であるが、慢性化に至るプロセスは不明な部分が多く残されている。近年、慢性B型肝炎患者の血中に存在する単球では、PD-L1の発現が上昇し7)、さらに、HBV特異的CD8陽性T細胞でPD-1の発現が上昇し細胞障害能が著しく低下していることがわかってきている8)。
このことから、B型肝炎の慢性化の原因の一つとしてPD-1/PD-L1-axisが関与している可能性が考えられている。そこで、我々は、B型肝炎慢性化に至るプロセスにHBV感染細胞から放出されるエクソソームを含むEVsが関与しているのではと仮定し、研究を行ってきた。
HBV感染細胞由来EVsの機能
HBV感染細胞からは、エクソソームのほかに、HBs抗原のみを持つ非感染性の中空粒子は、HBs抗体のデコイとして機能していると考えられているが、実際の機能は未知のままである。本稿では、エクソソーム、中空粒子、HBVビリオンを含めてEVsと表記する。
まず我々は、HBV感染細胞由来EVsがどのような細胞に取り込まれるかを検索するため、ヒトの末梢血単核細胞 (Peripheral blood mononuclear cells: PBMCs) の培養上清に蛍光ラベルしたHBV感染細胞由来EVsを投与し24時間後にFACSで解析した。その結果、単球に選択的にEVsが取り込まれることが明らかとなった(図1A)。さらに、EVsを取り込んだ単球では、PD-L1の発現が上昇し(図1A)、免疫細胞の活性化マーカーであえるCD69の発現が減少した。
次に、PD-L1とCD69の発現の増減に関与している粒子を特定するために、密度勾配遠心法を用いて、エクソソーム、中空粒子、HBVビリオンを分離し、それぞれの粒子をPBMCs培養上清に投与し24時間後にPD-L1の発現を確認した。その結果、すべての粒子でPD-L1の発現が上昇しCD69の発現が減少したが、特に、エクソソームと中空粒子がPD-L1の発現を上昇させ(図1B)CD69の発現を減少させた。
以上のことから、HBV感染細胞由来のエクソソームと中空粒子は、取り込んだ単球に対して免疫抑制能を有している可能性が示唆された9)。
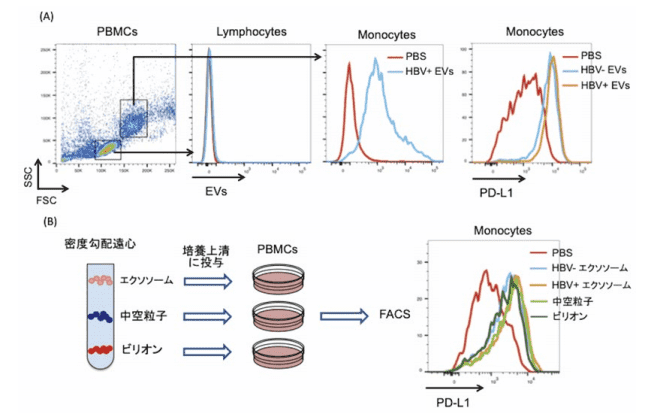
図1.
次に、in vivoにおいてもHBV感染細胞由来EVsが免疫抑制を誘導するかを調べるために、HBV感染マウスモデルを用いて検討した。マウス生体内で肝炎実験系を得るために、HBs抗原で3回免疫したマウスに野生型HBVレプリコンプラスミドを、Hydrodynamic injection (HDI) 法を用いて肝臓にトランスフェクションする。これより、HBV肝炎モデルが得られる。
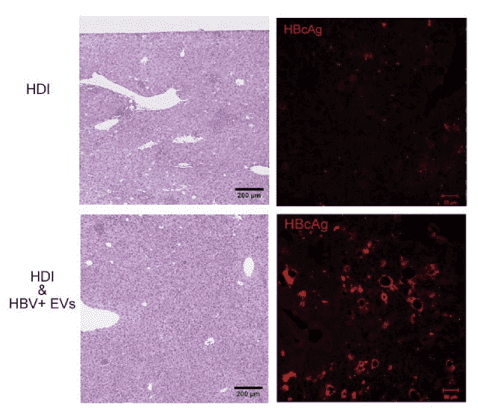
図2.
HDIをして2時間後にHBV感染細胞由来のEVsを尾静脈から投与し、3日後の肝臓における細胞浸潤とHBc抗原の発現を検索した。その結果、HBV感染細胞由来のEVsを投与しなかったマウスの肝臓では、多数の細胞浸潤が認められ、さらに、HBc抗原はほとんど確認できなかった(図2)。
一方、HBV感染細胞由来のEVsを投与したマウスの肝臓では、細胞浸潤がほとんど確認できず、さらに、HBc抗原が多数認められた(図2)。
以上の結果から、HBV感染細胞由来EVsがin vivoにおいて免疫抑制を誘導することが示唆された。
おわりに
発見された当初、エクソソームは不要なタンパク質や核酸を細胞外に放出するための仕組みと考えられていた。ところが、今や、細胞間コミュニケーターとして機能し、様々な疾患の診断・治療のターゲットとして注目を集めている。本稿では、ウイルス感染細胞由来エクソソームの機能に関わるいくつかの報告を紹介したが、エクソソームはあらゆる生命現象に関与することが報告されている。
多くの研究によりエクソソームの生物学的意義が明らかにされつつあるが、その作用機序や生成過程の詳細については、未解明の部分も多く残されている。我々の研究が今後のエクソソーム研究の一助となることを願う。
参考文献
- Murk, J. L. et al. : Semin. Cell Dev. Biol., 13(4), 303 (2002). DOI: 10.1016/s1084952102000605
- Selzer, L. and Zlotnick, A. : Cold Spring Harb. Perspect. Med., 5 (12), 0021394 (2015). doi: 10.1101/cshperspect.a021394
- Nagashima, S. et al. : J. Gen. Virol., 95, 2166 (2014). DOI: 10.1099/vir.0.066910-0
- Campbell, T. D. et al. : Ethn. Dis., 18 (2 Suppl 2), S2-14 (2008).
- Arenaccio, C. et al. : J. Virol., 88, 11529 (2014). DOI: 10.1128/JVI.01712-14
- Higuchi, H. et al . : Blood , 131 (23), 2552 (2018). DOI: 10.1182/blood-2017-07-794529
- Huang, Z. Y. et al. : Viral Immunol., 30 (3), 224 (2017). DOI: 10.1089/vim.2016.0122
- Boni, C. et al. : J. Virol., 81, 4215 (2007). DOI: 10.1128/JVI.02844-06
- Kakizaki, M. et al . : PLoS One , 13 (12), e0205886 (2018). DOI: 10.1371/journal.pone.0205886















