【連載】エクソソームと生命現象「第9回 エクソソームの生体内挙動」
本記事は、和光純薬時報 Vol.88 No.2(2020年4月号)において、京都大学大学院 薬学研究科 病態情報薬学 高橋 有己様に執筆いただいたものです。
はじめに
細胞から放出される細胞外小胞は、産生する細胞に由来する RNA やタンパク質、脂質といった分子を内包するとともに、その細胞外小胞を取り込んだ細胞へとその内包物質を送り届ける、いわば細胞間の運び屋として生体内で機能している。細胞外小胞はその放出様式や、物性等から様々に分類されるが、中でも最も注目されるのが粒子径 100nm 前後の、エクソソームとも呼ばれる小さな細胞外小胞である。生体内での情報伝達機構としてのエクソソームの役割に注目が集まり、その生理機能の解明を目的とした研究が盛んに行われるとともに、その生理機能を利用した疾患治療法の開発や、生体内での運び屋としての機能に着目したデリバリーキャリアとしての利用を目的とした研究にも注目が集まる。
一方で、その生理機能の解明あるいは、治療手段やデリバリーキャリアとしての利用のためには、生体内におけるエクソソームの生体内挙動は重要な情報である。筆者らはこれまでにエクソソームを利用した疾患治療法並びにデリバリーキャリアの開発を目的として、エクソソームの生体内挙動の解析を行ってきた。そこで本稿ではこれまでに明らかとなっているエクソソームの生体内挙動について、我々のこれまでの検討結果を中心に紹介したい。
培養細胞から回収されたエクソソームの生体内挙動
エクソソームの生体内挙動の解析は以下のように行う。まず、目的のエクソソームを産生する細胞からエクソソームを回収し、そのエクソソームを何らかの方法で標識する。次に、これを生体に投与し、その挙動を標識したプローブで検出する(図1左)。従って、エクソソームの標識法が生体内挙動の解析には重要である。
エクソソームの標識に際しては、PKH 色素あるいは Di 系の色素のような、脂溶性蛍光色素を用いた標識法が繁用されているが、蛍光色素には感度や定量性における問題点が存在する。我々は、定量性と感度に優れた発光性プローブを利用した標識の開発を目的として、発光性レポータータンパク質Gaussia luciferase(gLuc)と、エクソソームの外膜移行性タンパク質 Lactadherin(LA)の融合タンパク質 gLuc-LA を利用したエクソソーム標識法を開発した 1)。また、発光より定量性に優れた標識プローブである放射性同位体を利用したエクソソーム標識法の開発にも成功している 2)。
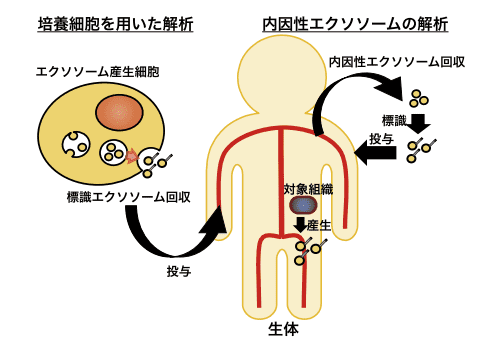
図1.エクソソームの生体内挙動解析の模式図
開発した方法を用いて標識したエクソソームを静脈内投与し、その挙動を解析したところ、エクソソームの産生細胞の種類や回収方法によらず、血管内へと投与したエクソソームは半減期数分程度と速やかに血中から消失し、主に肝臓・脾臓・肺へと分布することを明らかとした 3, 4)。また、速やかな血中からの消失の要因として肝臓や脾臓に豊富に存在するマクロファージに着目した検討を行った。その結果、全身のマクロファージを除去したマウスにおいては、静脈内投与後の血中の滞留性が劇的に上昇することを見出し、血中からの速やかな消失は主にマクロファージによるエクソソーム取り込みに起因することを明らかとした 5)。
また、エクソソームの生体内挙動に影響を及ぼす因子として、エクソソームの表面分子である脂質並びに表面タンパク質に着目した検討を行った。その結果、エクソソームの膜脂質の中でもホスファチジルセリンに代表される負電荷リン脂質に起因した負電荷がマクロファージによるエクソソーム取り込みに関与すること 6)、並びに例えばインテグリンのような表面タンパク質がエクソソームの肺への移行に関与することを見出した 7)。
マクロファージをはじめとした免疫細胞に取り込まれやすいというエクソソームの特性を利用した免疫療法の開発が期待されるが、そのためには投与後のエクソソームの挙動の解析が必要である。そこで、エクソソームを利用したがん免疫療法の開発を目的として、腫瘍組織内に投与されたエクソソームの挙動を解析した。その結果、腫瘍組織内に投与されたエクソソームは、その多くは腫瘍組織内に留まること、腫瘍組織内にとどまったエクソソームの一部は腫瘍組織内のマクロファージに取り込まれるもののその多くはがん細胞へと取り込まれることを明らかとした 8)。
そこで、がん細胞による取り込みの抑制と免疫細胞への取り込みの増大を目的として、DNA の二本鎖形成能を利用したエクソソームの集合体の調製法を開発した 9)。調製した集合体は、がん細胞に取り込まれにくい一方で、抗原提示細胞へより取り込まれやすくなった。この結果は集合体化によるサイズの増大がエクソソームの局所動態の制御法として有用である可能性を示すものである。
生体内に存在するエクソソームの挙動
以上に記述したエクソソームの体内動態情報は培養細胞から回収したエクソソームを用いての検討結果であるが、生体内におけるエクソソームの真の生理機能の解明のためには、生きた動物個体の中において産生されるエクソソームを対象とした動態の解析が望ましい。しかしながらその実現は技術的に非常に困難である。
近年、エクソソーム局在性タンパク質 CD63 と GFPの変異体である pHluorin との融合タンパク質 CD63-pHluorin を利用した、生きた個体レベルでのエクソソームの挙動の観察が報告されている 10)。ゼブラフィッシュの組織特異的にCD63-pHluorin を発現させ、そこから産生されるエクソソームの挙動を蛍光顕微鏡により観察しエクソソームは主にマクロファージや血管内皮細胞に取り込まれること、その取り込みはスカベンジャー受容体を介したものであることが明らかとされている。また、同時期に、エクソソーム移行性タンパク質 Syntenin と GFP の融合タンパク質を安定に発現するがん細胞を移植したゼブラフィッシュにおいてもマクロファージおよび血管内皮細胞による取り込みが観察されている 11)。
これらの生物個体レベルでの検討結果は、培養細胞由来のエクソソームを用いての結果とよく相関しており興味深い。これらの方法は、体が透明であるゼブラフィッシュの特性を利用して個体レベルでのエクソソームの挙動の追跡を可能とした非常に優れた方法であるが、哺乳類をはじめとした他の生物種での利用は困難である。従って、より種々のモデル動物に適用可能な、個体レベルでの観察を可能とする方法の開発が望まれていた。
近年我々は、生体内に内因性に存在するエクソソームとして、マウス血液中に存在する内因性エクソソームに着目し、その生体内挙動の解析に取り組んだ(図 1 右上)12)。初めに、血中からのエクソソームの回収方法、並びにそのエクソソームの標識法について検討を行った結果、サイズ排除クロマトグラフィーを用いて回収したエクソソームを gLuc-LA を用いて標識することで、血液中の内因性エクソソームの回収と標識が可能であることを見出した。
この標識エクソソームを用いて静脈内投与後、すなわち再び血中に戻した後の挙動について解析したところ、血中から半減期数分程度と速やかに消失し、肝臓をはじめとした臓器へ分布した。一方で、血中におけるエクソソーム濃度は産生と消失のバランスにより決定されていることから、その血中濃度と消失速度から産生速度を計算したところ、マウス血液にはタンパク質量にして 18μg のエクソソームが毎分産生されていることが明らかとなり、生体内においてはエクソソームの血中濃度は産生と消失とのダイナミックな平衡のもとに維持されていることを見出した。
今後は、血液中に存在する総エクソソームのみならず、特定の対象組織や細胞から産生される内因性のエクソソームの生体内挙動の解析(図 1 右下)についても取り組んでいく予定である。
おわりに
以上、これまでに明らかとなっているエクソソームの生体内挙動について我々の成果を中心に紹介した。今後これらの情報を基に、さらにエクソソームの生理機能が明らかとなるとともに、これを利用した治療法の開発が進展するものと期待する。一方で、生体内において内因性に産生されるエクソソームの挙動については未だ情報が不十分であることから、その解析が望まれる。筆者もこれらの課題に取り組むとともに、これまでに明らかとした生体内挙動の情報を基にエクソソームを利用した疾患治療法の開発に取り組むことで、エクソソーム研究の発展に貢献していくことを祈願しつつ、本稿を終わりたい。
参考文献
- Takahashi, Y. et al. : J. Biotechnol., 165, 77 (2013). DOI: 10.1016/j.jbiotec.2013.03.013
- Morishita, M. et al. : J. Pharm. Sci., 104, 705 (2015). DOI: 10.1002/jps.24251
- Yamashita, T. et al. : Eur. J. Pharm. Biopharm., 98, 1 (2016). DOI: 10.1016/j.ejpb.2015.10.017
- Charoenviriyakul, C. et al. : Eur. J. Pharm. Sci., 96, 316 (2017). DOI: 10.1016/j.ejps.2016.10.009
- Imai, T. et al . : J. Extracell. Vesicles, 4, 26238 (2015). DOI: 10.3402/jev.v4.26238
- Matsumoto, A. et al. : J. Pharm. Sci., 106, 168 (2017). DOI: 10.1016/j.xphs.2016.07.022
- Charoenviriyakul, C. et al. : Mol. Pharm., 15, 1073 (2018). DOI: 10.1021/acs.molpharmaceut.7b00950
- Matsumoto, A. et al. : Cancer Sci., 108, 1803 (2017). DOI: 10.1111/cas.13310
- Matsumoto, A. et al . : Biomaterials , 225, 119518 (2019). DOI: 10.1016/j.biomaterials.2019.119518
- Verweij, F. J. et al. : Dev. Cell, 48, 573 (2019). DOI: 10.1016/j.devcel.2019.01.004
- Hyenne, V. et al. : Dev. Cell, 48, 554 (2019). DOI: 10.1016/j.devcel.2019.01.014
- Matsumoto, A. et al. : J. Extracell. Vesicles, 9, 1696517 (2020). DOI: 10.1080/20013078.2019.1696517
シリーズ終了にあたって
2018年4月号(Vol. 86, No. 2)から始まりました「エクソソームと生命現象」は、本稿をもちまして最終回を迎えました。本誌に寄稿いただきました先生方にこの場を借りて御礼申し上げます。おかげさまで本シリーズはエクソソーム研究に関する情報をさまざまな視点でお届けすることができました。
読者の皆様におかれましては、2年間に渡って続いた本シリーズをご愛読いただき御礼申し上げます。皆様のエクソソーム研究の一助になりましたら幸いです。















