【連載】ペプチド医薬合成基礎講座 「第1回 ペプチド医薬の周辺」
本記事は、和光純薬時報 Vol.87 No.2(2019年6月号)において、サイエンスライター 佐藤 健太郎 様に執筆いただいたものです。
1970年代以降、合成低分子医薬は一世を風靡し、多くのすぐれた医薬品が世に送り出された。しかし一方でこの分野は行き詰まりも指摘されており、医薬品開発の中心は抗体医薬をはじめとしたバイオ医薬にシフトしている。
こうした状況の中、医薬品開発の次代を担うジャンルとして、ペプチド医薬が注目を集めつつある。その長所と短所、新たなデザインと合成のアプローチなどについて、本連載で述べてゆきたい。
人類は有効な医薬を求め、様々な対象を探索してきた。最初に探索の対象になったのは植物や鉱物の成分であり、これは天然物創薬として現代にまで受け継がれている。20世紀以降は有機合成化学の進歩により、低分子の人工合成による創薬が盛んになった。
特に、医薬分子とタンパク質との相互作用の様子が解明され、理論的なバックボーンも固まった1980年代以降、合成創薬は全盛期を迎え、多くの画期的医薬品がこの分野から登場した。製薬企業が大型商品を連発し、巨大な利益を稼ぎ出したのはこの時代である。
しかし、21世紀に入ってからは低分子医薬開発の勢いに翳りが見え始め、製薬業界は2010年問題ともいわれた危機の時代を迎えた。この時期に登場したのが、バイオテクノロジーによって製造したタンパク質を用いるタイプの医薬であった。特に、体内で免疫作用を担う抗体を改変して作り出される抗体医薬は広く用いられ、がんやリウマチなど難病の治療に大きな進歩をもたらした。中でも抗PD-1抗体ニボルマブ(商品名オプジーボ)は、肺がんなどの画期的な治療薬として注目を集め、2018年ノーベル生理学・医学賞の対象となったことは記憶に新しい。
ただし、これら抗体医薬は、その分子サイズの大きさ(分子量約15万)ゆえに、基本的に細胞の中には入って行けない。また、通常のタンパク質同様に胃腸で消化されてしまうため、経口投与も不可能である。このため、治療可能な疾患はかなり限定され、低分子医薬に完全に取って代わるものにはなりえない。
こうした状況から、現在ポスト抗体医薬となる新ジャンルの探索に力が注がれている。以前に本誌連載で取り上げた、核酸医薬などもその一つだ。そして近年、ペプチドを医薬として用いる分野に、改めて注目が集まっている。本連載では、こうしたペプチド医薬が注目される理由、合成手法、新たな展開などについて述べてゆきたい。
医薬としてのペプチド
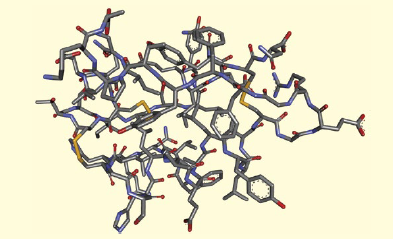
図1.インスリンの構造。51のアミノ酸から成る
ペプチドは、いくつかのアミノ酸がアミド結合で連結した化合物である。明確な区分はないが、アミノ酸の数が数十以下のものをペプチド、100以上のものをタンパク質と呼ぶことが多い。ペプチドには、ホルモンや伝達物質などとして生体内で重要な生理作用を担うものが数多くある。血糖値の調整を行うインスリン(図1)、鎮痛作用などを示すエンドルフィン類はその代表的なものである。
これら生理作用を示すペプチド類には、そのまま医薬として用いられるものもある。糖尿病にはインスリンが、低身長症には各種成長ホルモンが、それぞれ不可欠な治療薬となっている。
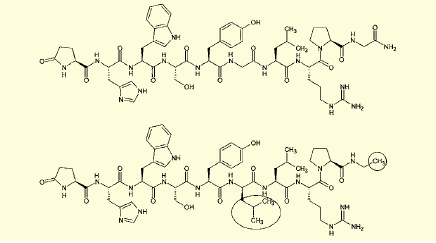
図2.GnRH(上)とリュープロレリン(下)。丸囲みは構造の相違部分
また、これらのペプチドのアミノ酸配列を改変し、医薬品としての性質を改良したものも用いられる。たとえば、インスリンのアミノ酸配列を一部改変し、即効性を高めたインスリンアナログ類はよく知られている。また前立腺がんなどの治療薬であるリュープロレリンは、性腺刺激ホルモン放出ホルモン(GnRH)の構造を改変し、より強力なアゴニストとしたものである(図2)。
ペプチドミメティック
ペプチドそのものを医薬とするのではなく、ペプチドに似せた化合物をデザインして医薬とする手法も広く行われている。たとえば、プロテアーゼの標的となるペプチド配列を変換した化合物を投与し、プロテアーゼの働きを阻害するような手法である。
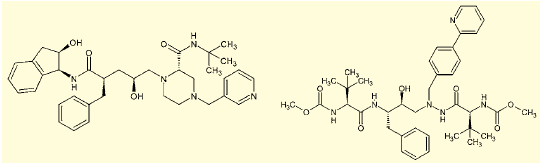
図3.インジナビル(左)とアタザナビル(右)
HIVプロテアーゼ阻害剤であるインジナビルやアタザナビル(AIDS治療薬)はその代表的な例だ(図3)。ペプチドに類似しているものの、アミド結合をC-C結合に変換するなどしてあり、切断を受けない構造になっている。その他、レニン阻害剤(高血圧治療薬)など、多くのジャンルでペプチドミメティック型の医薬が開発され、臨床の現場で用いられている。
ペプチド医薬の問題点
ペプチドは強い生理作用を持つものが多く、合成も比較的容易であるにもかかわらず、医薬として成功しているものは決して多くはない。その要因として、ペプチドは胃腸の消化酵素によって素早く分解されるため、経口投与が不可能である点が挙げられる。このため上記に挙げたインスリンやリュープロレリンなどは、皮下注射による投与が行われる。この点、経口投与が可能な一般的低分子医薬に比べて不利である。
ペプチドミメティック型の医薬は経口投与も可能だが、分子量が大きくなりがちであること、分子が細長い構造になること、また水溶性官能基が多いせいで膜透過性が低く、体内動態に優れないケースが多い。このためペプチドミメティックは研究例の多さの割に、医薬としての成功例は少ないともいわれる。
逆に言えば、易分解性と体内動態の悪さという難点を解決できれば、ペプチド関連化合物は医薬として極めて有望であり、引き出されていないポテンシャルがあるということになる。
特殊ペプチド創薬
体内動態に優れたペプチド型化合物も存在している。たとえばシクロスポリンは、11のアミノ酸から成るペプチドでありながら、経口投与でも十分な薬効を示し、免疫抑制剤として活用されてきた。
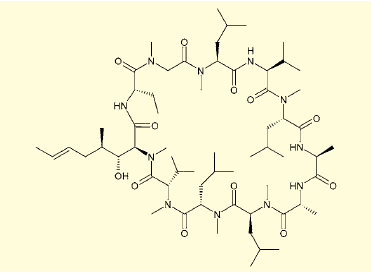
図4.シクロスポリン
この鍵は、その大環状骨格にある。環状であること、またD-アミノ酸を含んでいるため、シクロスポリンは消化酵素にペプチドとして認識されず、分解を受けにくいと考えられる(図4)。また、大環状骨格であるということは、分子全体がフラフラと動かず、柔軟でありながらある程度固定された配座を取りやすいということでもある。これは、タンパク質との相互作用に有利に働く。また、形がしっかり決まった分子は、膜を透過しやすいという利点も大きい。天然のマクロライド類に、医薬として成功を収めているものが多いことは、こうした大環状分子の有利さの証といえる。
にもかかわらず、これまで大環状骨格を持った合成医薬の例は極めて少ない。これは、大環状骨格の構築の難しさが大きな要因だ。長い鎖状分子上の遠く離れた反応点同士を連結させるのはエントロピー的に極めて不利であるため、高度希釈法などの面倒な合成手法と、長い反応時間が必要となる。多種多様な化合物を作り、構造の最適化を行わねばならない創薬研究においては、これはあまりにも不利である。
しかし最近、この壁を乗り越え、多数の大環状ペプチドを一挙に作り出し、スクリーニングを行う技術が開発された。東京大学の菅裕明教授が開発した一連の技術がそれだ。この方法では、一挙に1兆種類もの環状ペプチドを合成し、標的タンパク質に対して最適な構造を持つものを選び出すことができる。
その鍵となったのは、フレキシザイムと呼ばれる技術だ。菅らはこの方法によってタンパク質の生合成系を改変し、天然のタンパク質を構成する20種以外の自由なアミノ酸を連結させることに成功した。さらに工夫を加えることで、これを大環状アミノ酸とし、高速にスクリーニングを行うことを実現している。一連の技術は、世界の製薬業界においても大いに注目され、次世代医薬品開発の根幹として期待を受けている。
またこれ以外にも、ペプチド及びタンパク質の化学合成の技術は大いに進展しており、以前なら不可能であったサイズのタンパク質なども、フラスコ内で合成が可能になっている。本連載ではこうした合成手法にスポットを当て、ペプチド医薬の新たな可能性について紹介してゆきたい。
関連記事









